2. 河南省医药科学研究院,河南 郑州 450000
2. Institute of Medicine of Henan Province, Zhengzhou 450000, China
近年来,大量研究证实在许多恶性肿瘤中蛋白4.1的表达呈不同程度的下降或缺失,它的异常表达会导致肿瘤发生及肿瘤的恶化[1-3]。蛋白4.1B是4.1家族(包括4.1R、4.1B、4.1N和4.1G)的重要成员[4-5],由EPB41L3基因编码。蛋白4.1B定位在细胞与细胞之间的接触位点,作为衔接蛋白连接细胞质膜与细胞骨架或者胞质效应分子,介导细胞骨架相关的细胞运动和粘附;调节细胞生长、分化、上皮样结构的建立[6]。4.1B发挥了“细胞骨架连接蛋白”对肌动蛋白应力纤维的调节作用,从而抑制细胞的运动性发挥抑癌作用[7];在多种肿瘤细胞中,蛋白4.1B的表达对于细胞增殖调控、细胞黏附及信号转导均有重要意义[8-9]。蛋白4.1B可能是人类癌症的一个重要的预后指标,也可能是一个潜在的抗肿瘤治疗的靶点。
恶性黑色素瘤(malignant melanoma, MM)又称为恶黑,发病率占皮肤恶性肿瘤的第3位,也是发病率增长最快的恶性肿瘤之一,年增长率为3%~5%,其恶性度高、转移早,预后差,死亡率高[10-11]。在本研究中,以MEF细胞为阳性对照,利用PCR技术扩增蛋白4.1家族,经过筛选得出:在核酸及蛋白水平,4.1B在小鼠黑色素瘤细胞系B16、B16-F10细胞均呈现缺失表达。研究结果表明EPB41L3可能是肿瘤抑制基因,但其在肿瘤发生发展过程中的功能仍不完全清楚[12-13]。本研究中通过构建真核表达载体pEGFP-N1-EPB41L3,将EPB41L3基因导入B16、B16-F10细胞,并成功使其表达蛋白4.1B,进一步验证了蛋白4.1B在小鼠黑色素瘤细胞系中的肿瘤抑制作用。
1 材料和方法 1.1 细胞株野生型C57BL/6小鼠胚胎成纤维细胞(MEF细胞)以及4.1B敲除的MEF细胞(MEF 4.1B-/-)由美国纽约血液中心安秀丽教授惠赠,小鼠黑色素瘤细胞系B16和B16-F10购于中国科学院上海生命科学研究院细胞资源中心。MEF、B16、B16-F10细胞均用含10%胎牛血清的DMEM培养基,分别于37℃,5% CO2的培养箱中培养,根据细胞生长情况,每2~3 d用含EDTA的胰酶消化MEF、B16细胞并传代,用不含EDTA的胰酶消化B16-F10细胞并传代,传代至对数生长期做相关细胞实验。
1.2 主要材料及试剂兔抗鼠4.1R、4.1G、4.1N、4.1B多克隆抗体由美国纽约血液中心安秀丽教授惠赠;HRP-羊抗兔IgG购买于武汉博士德生物工程有限公司;胎牛血清购于浙江天杭生物科技有限公司;兔抗鼠EGFP单克隆抗体由美国血液中心安秀丽教授惠赠;DMEM(Dulbecco's Modified Eagle Medium)购于美国Gibco公司;Trizol试剂、PrimeSTARTM HS(Premix)、DNA Maker、XhoⅠ、BamHⅠ内切酶和T4连接酶购于TaKaRa公司;UltraSYBR Mixture购于北京康为世纪生物科技有限公司;Revertaid first strand cDNA synthesis kit购于Fermentas公司;转染试剂Lipofectamine 2000购自美国Invitrogen公司。基因测序由金唯智公司完成。
1.3 引物设计根据GeneBank上所提供的小鼠EPB41、EPB41L3、EPB41L1、EPB41L2及内参β-actin的mRNA序列,采用Primer Premier 5软件设计EPB41、EPB41L3、EPB41L1、EPB41L2及内参β-actin各自的特异性PCR引物(表 1)。pEGFP-N1-EPB41L3真核表达载体引物设计后应用BLAST软件进行在线筛查对比,以消除潜在的同源干扰,上游引物(引入XhoⅠ位点):5'-AAACTCGAGATGACGACCGAATCAGGATCAGACTCAGAATCGAAGC-3';下游引物(引入BamHⅠ位点):5'-AAAGGATCCCGATCCTCTCCGTCCTCTGGTGTGATT-3('划线部分为酶切位点,前面为保护碱基)。以EPB41L3基因序列为模板,根据荧光定量PCR引物设计原则,设计EPB41L3特异性的引物序列(表 2)。
| 表 1 4.1蛋白家族PCR引物序列 Table 1 Primer sequences for amplification of the 4.1 protein family members |
| 表 2 EPB41L3的qPCR引物序列 Table 2 Gene-specific primers used for quantitative real-time PCR of EPB41L3 |
待细胞生长至状态良好,TRIzol法提取MEF、MEF 4.1B-/-、B16、B16-F10细胞基因组RNA,Nanodrop 2000测得RNA浓度及纯度,以不大于1μg的RNA利用反转录试剂盒合成cDNA。以反转录产物为模板进行PCR反应,反应体系50μL:cDNA 2μL,上、下游引物各2μL,高保真酶Premix 25μL,ddH2O 19 uL。PCR反应条件:94℃5 min;94℃30 s,60℃30 s,72℃3 min,共30个循环;72℃10 min。扩增后取PCR产物5 uL于1%琼脂糖凝胶中电泳,于凝胶图像分析系统下观察并拍照。
1.5 Western blot检测蛋白4.1的表达培养MEF、B16、B16-F10细胞,当细胞铺满瓶底时,胰酶消化收集细胞,1000 r/min,5 min离心收集细胞,并用PBS清洗3遍。加入200μL裂解液和2μL PMSF,冰上裂解30 min,4℃,12 000 r/min,15 min,取上清。用BCA法酶标仪570 nm测蛋白浓度,调整蛋白浓度使其一致,加入2×Loading buffer,水浴煮沸5 min。细胞总蛋白经10% SDS-PAGE分离后,湿转法转膜到NC膜。用含50 g/L脱脂奶粉的TBST封闭2 h,TBST冲洗3次,10 min/次。分别加入兔抗鼠4.1R、4.1N、4.1G和4.1B多克隆抗体(1:100),4℃孵育过夜,TBST冲洗3次,10 min/次。加入HRP-羊抗兔lgG(1:4000),37℃水平摇床孵育1 h,TBST冲洗3次,10 min/次。ECL试剂盒显色发光,Azure c600-多功能分子成像系统采集图像。
1.6 Real time PCR法检测4.1B mRNA相对表达量以GAPDH为内参,使用荧光定量PCR Mix进行real time PCR,反应体系20μL:PCR Mix 10μL,ddH2O6.4μL,正反向引物各0.8μL,cDNA模板为2μL。反应条件为:95℃,10 min;95℃15 s,60℃1 min,共40个循环;溶解曲线,60℃到95℃梯度升温溶解。实验数据采用△△Ct法统计分析。
1.7 构建pEGFP-N1-EPB41L3真核表达载体将真核表达载体pEGFP-N1与EPB41L3基因纯化产物分别经XhoⅠ、BamHⅠ双酶切和胶回收,利用T4连接酶进行连接,将EPB41L3基因导入pEGFP-N1表达载体中,经转化到DH5α宿主菌后涂布于LB平板,挑取单菌落并提取质粒进行酶切鉴定,再经过DNA测序进一步确认。验证正确后再进行大量扩增,保存重组质粒,命名为pEGFP-N1-EPB41L3。
1.8 pEGFP-N1-EPB41L3重组质粒转染黑色素瘤细胞系B16、B16-F10当黑色素瘤细胞系B16、B16-F10细胞成长状态良好时,消化处理细胞并用血球计数板计数,将5×105个细胞重悬于1 mL DMEM培养液中,转移至6孔细胞培养板,培养24 h左右,待单层细胞生长融合度达到70%~90%时可进行转染。细胞实验分组:转染试剂空白对照组(Control)、pEGFP-N1组以及pEGFP-N1-EPB41L3实验组,瞬时转染24 h后,荧光显微镜观察。Western blot检测4.1B的表达,EGFP(1:2000),二抗(1:6000)。
1.9 MTT法检测蛋白4.1B对黑色素瘤细胞系B16、B16-F10细胞增殖的影响收集上述各实验组细胞,B16-F10细胞以8×103/孔,B16细胞以6×103/孔接种于96孔板,每孔培养液总量为200μL,于37℃5% CO2培养箱中培养,分别在24、48、72、96 h换成无血清培养基,每孔加入20μL5 mg/mL的MTT孵育4 h后终止培养,弃上清,每孔加入150μL DMSO,将培养板置于酶标板,振荡10 min,然后570 nm处检测各孔吸光度。增殖率=(实验组-对照组)/对照组。
1.10 统计学处理计数数据以均数±标准差表示,采用GraphPad Prism 5.0软件进行分析,两组间采用student's T test比较,以P<0.05表示差异具有统计学意义。
2 结果 2.1 蛋白4.1家族成员在小鼠黑色素瘤细胞中的表达筛选以MEF细胞的cDNA为模板进行PCR,EPB41、EPB41L3、EPB41L1、EPB41L2基因均有目的条带,说明在MEF细胞中,蛋白4.1家族核酸水平均正常表达,这与文献报道相符,因此MEF作为阳性对照是可信的。以黑色素瘤细胞系B16和B16-F10的cDNA为模板进行PCR,核酸水平验证蛋白4.1家族的表达(图 1A);以总蛋白为模板采用Western blot的方法验证蛋白4.1家族在蛋白水平的表达情况(图 1B)。结果提示:在核酸和蛋白水平,蛋白4.1B在B16和B16-F10中均表达缺失。
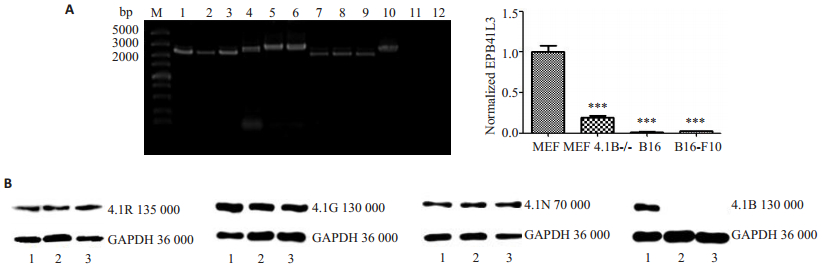
|
图 1 蛋白4.1家族成员在小鼠黑色素瘤细胞中的表达筛选 Figure 1 Expression of protein 4.1 family members in melanoma cells. A: mRNA expression of 4.1 family members in MEF, B16, and B16-F10 cells detected by real-time PCR. M: DNA marker (DL5000); Lanes 1, 4, 7, 10: Expression of EPB41, EPB41L2, EPB41L1, and EPB41L3 mRNA in MEF cells, respectively; Lanes 2, 5, 8, 11: Expressions of EPB41, EPB41L2, EPB41L1, and EPB41L3 mRNA in B16 cells, respectively; Lanes 3, 6, 9, 12: Expression of EPB41, EPB41L2, EPB41L1, and EPB41L3 mRNA in B16-F10 cells. ***P < 0.001; B: Expressions of 4.1 protein family members detected by Western blotting. 1: MEF cells; 2: B16 cells; 3: B16-F10 cells. |
提取MEF细胞总RNA,逆转录为cDNA,PCR扩增小鼠EPB41L3基因。利用T4连接酶将经XhoⅠ、BamHⅠ双酶切的EPB41L3片段和pEGFP-N1载体进行连接,随后连接产物转化到DH5α感受态细胞中,挑取经Kana筛选的菌落进行培养,提取质粒,质粒产物经XhoⅠ单酶切,XhoⅠ、BamHⅠ双酶切,并进行1%琼脂糖凝胶电泳后可见约7.3kb线性化pEGFP-N1-EPB41L3重组质粒、4.7 kb线性化pEGFP-N1载体和2.6 kb的EPB41L3条带(图 2),测序结果与Genebank中的EPB41L3序列完全一致。结果表明,重组载体pEGFP-N1-EPB41L3构建成功。
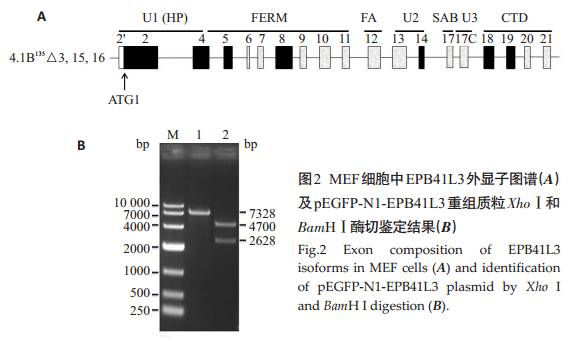
|
图 2 MEF细胞中EPB41L3外显子图谱(A)及pEGFP-N1-EPB41L3重组质粒XhoⅠ和BamHⅠ酶切鉴定结果(B) Figure 2 Exon composition of EPB41L3 isoforms in MEF cells (A) and identification of pEGFP-N1-EPB41L3 plasmid by XhoⅠand BamHⅠdigestion (B). |
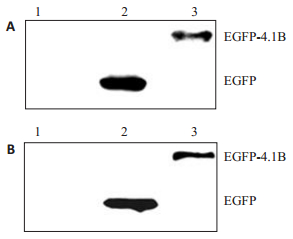
将pEGFP-N1-EPB41L3瞬时转染小鼠黑色素瘤细胞B16、B16-F10细胞24 h后,在荧光显微镜下观察到B16和B16-F10细胞发出清晰的绿色荧光信号(图 3),荧光显微镜分析结果说明,pEGFP-N1-EPB41L3载体在黑色素瘤B16、B16-F10细胞中表达了EGFP-4.1B融合蛋白。pEGFP-N1-EPB41L3载体转染导入B16和B16-F10细胞24 h后,Real-time PCR分析结果进一步说明,pEGFP-N1-EPB41L3载体在B16、B16-F10细胞中表达了EGFP-4.1B融合蛋白(图 4);Western blot检测结果显示,与control和pEGFP-N1细胞相比,pEGFP-N1-EPB41L3转染的B16、B16-F10细胞表达了蛋白4.1B(图 5)。
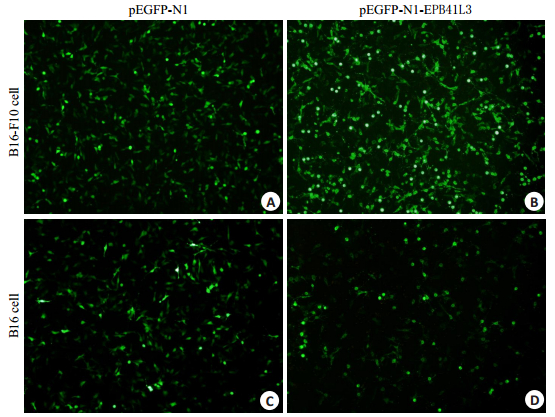
|
图 3 pEGFP-N1-EPB41L3重组质粒在B16-F10、B16细胞中表达EGFP-4.1B融合蛋白 Figure 3 Expression of EGFP-4.1B fusion protein in B16 and B16-F10 cells transfected with pEGFP-N1-EPB41L3 recombinant plasmid. |
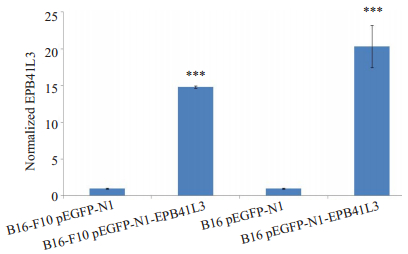
|
图 4 Real-time PCR分析重组质粒pEGFP-N1-EPB41L3转染后B16-F10、B16细胞EPB41L3基因mRNA水平的表达 Figure 4 EPB41L3 mRNA expression level analyzed by real-time PCR in B16 and B16-F10 cells transfected with pEGFP-N1-EPB41L3 recombinant plasmid. ***P < 0.001 pEGFP-N1-EPB41L3 vs pEGFP-N1. |
|
图 5 Western Blot分析重组质粒pEGFP-N1-EPB41L3转染后B16-F10、B16细胞4.1B蛋白水平的表达 Figure 5 Expressions of 4.1B protein detected by Western blotting in B16-F10 cells (A) and B16 cells (B) transfected with pEGFP-N1-EPB41L3 recombinant plasmid. 1: Nontransfected cells; 2: Cells transfected with pEGFP-N1; 3: Cells transfected with pEGFP-N1-EPB41L3. |
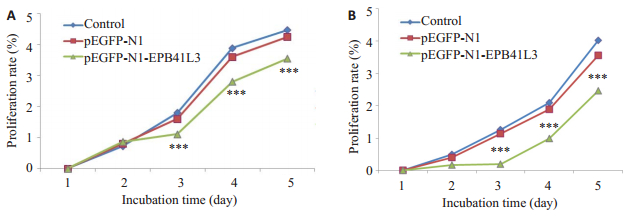
抑制B16、B16-F10细胞体外增殖MTT实验结果显示,蛋白4.1B的表达对黑色素瘤细胞B16、B16-F10的增殖均有抑制作用。在第2,3天,外源蛋白4.1B的表达对B16-F10细胞增殖有显著性抑制作用;B16细胞的MTT结果显示从第1天起蛋白4.1B的表达就对B16细胞增殖起抑制作用(图 6)。
|
图 6 EGFP-4.1B蛋白抑制B16-F10(A)、B16(B)细胞的体外增殖 Figure 6 Proliferation of B16-F10 (A, 8×103cells) and B16 cells (B, 6×103cells) transiently transfected with EGFP-4.1B recombinant plasmid. The data are presented as absorbance at 570 nm. ***P < 0.001 pEGFP-N1-EPB41L3 vs pEGFP-N1 or Control. |
蛋白4.1超家族不仅在维持细胞形态、连接细胞表面糖蛋白和细胞骨架方面起重要作用[14],在肿瘤发生、发展、转移中也起到重要的调控作用。蛋白4.1B与血影蛋白-肌动蛋白[15]、14-3-3蛋白家族[16]、整合素[17-1]、肺癌肿瘤抑制因子1(tumor suppressor in lung cancer-1, TSLC-1)[3, 19]等分子相互作用发挥肿瘤抑制因子的作用。近年研究表明在多种肿瘤细胞中,蛋白4.1B的表达对于细胞增殖[6]、运动性[20]、黏附[9]、信号转导[6]、上皮间质转化(Epithelial-mesenchymal transition, EMT)[21-22]等都具有重要意义。蛋白4.1B在多种组织中都有表达,相关研究证实蛋白4.1B在多种恶性肿瘤或良性肿瘤如非小细胞肺癌[2]、前列腺癌[23]、肾细胞癌[24]、卵巢癌[25]等中出现表达缺失或下调。本课题组选取小鼠黑色素瘤细胞B16、黑色素瘤高转移细胞B16-F10作为研究对象,以MEF细胞为阳性对照,首次发现,蛋白4.1B在小鼠黑色素瘤细胞系B16、B16-F10细胞中显著性表达缺失。推测蛋白4.1B可能在黑色素瘤细胞的恶化过程中具有一定作用。
我们选择了pEGFP-N1真核表达系统,成功构建了pEGFP-N1-EPB41L3重组质粒,瞬时转染小鼠黑色素细胞B16、B16-F10,成功获得了表达蛋白4.1B的细胞系。MTT法检测细胞增殖显示外源蛋白4.1B抑制黑色素瘤细胞的增殖,依据相关文献推测蛋白4.1B可能通过以下两种通路抑制细胞生长:蛋白4.1B的非保守区(U2)定位在细胞质膜,通过依次激活Src、Rac1、MLK3和JNK,从而减少细胞周期蛋白A(cyclin A)的表达,降低Rb蛋白过磷酸化[26];蛋白4.1B与它的结合配偶体PRMT5相互作用,通过甲基化组蛋白H4抑制细胞周期蛋白E1启动子活化间接抑制细胞生长[27]。前期实验结果显示B16、B16-F10细胞表达外源蛋白4.1B后,在显微镜下可观察到细胞形态逐渐变圆,随着培养时间延长,细胞逐渐脱离,表现出细胞凋亡特征。有研究证实蛋白4.1B可通过TLR4或gab-1激活JNK,启动凋亡蛋白酶1介导的凋亡[2]或依赖凋亡蛋白酶8介导细胞凋亡[29]。推测蛋白4.1B在抑制黑色素细胞增殖和促进其凋亡过程中发挥着重要作用,蛋白4.1B的缺失表达可能是导致黑色素瘤恶性度高、易发生转移的原因之一。
在多种肿瘤进展的早期阶段,蛋白4.1B表达量的不同程度下降会启动肿瘤生成。本研究结果表明,4.1B蛋白表达缺失的黑色素瘤细胞B16和B16-F10重新表达4.1B蛋白后,其细胞增殖作用被显著性抑制,这进一步证实EPB41L3基因编码的蛋白4.1B可能是肿瘤进展中的负调控分子。因此,通过使肿瘤细胞表达4.1B蛋白可能成为新的肿瘤治疗方式,通过DNA甲基转移酶抑制剂抑制EPB41L3基因启动子去甲基化,通过腺病毒、慢病毒、质粒使缺失EPB41L3基因的肿瘤细胞重新表达蛋白4.1B有望成为新的肿瘤治疗策略。
| [1] |
Xi C, Ren CX, Hu AJ, et al. Defective expression of Protein 4.1N is correlated to tumor progression, aggressive behaviors and chemotherapy resistance in epithelial ovarian cancer[J].
Gynecol Oncol,2013, 131 (3) : 764-71.
DOI: 10.1016/j.ygyno.2013.08.015. ( 0) 0)
|
| [2] |
Zhang YJ, Xu RB, Li GQ, et al. Loss of expression of the differentially expressed in adenocarcinoma of the lung (DAL-1) protein is associated with metastasis of non-small cell lung carcinoma cells[J].
Tumor Biol,2012, 33 (6) : 1915-25.
DOI: 10.1007/s13277-012-0452-x. ( 0) 0)
|
| [3] |
Takahashi Y, Iwai M, Kawai T, et al. Aberrant expression of tumor suppressors CADM1 and 4.1B in invasive lesions of primary breast cancer[J].
Breast Cancer,2012, 19 (3) : 242-52.
DOI: 10.1007/s12282-011-0272-7. ( 0) 0)
|
| [4] |
Baines AJ, Lu HC, Bennett PM. The protein 4.1 family: hub proteins in animals for organizing membrane proteins[J].
Biochim Biophys Acta,2014, 1838 (2) : 605-19.
DOI: 10.1016/j.bbamem.2013.05.030. ( 0) 0)
|
| [5] |
Parra MK, Gallagher TL, Amacher SL, et al. Deep intron elements mediate nested splicing events at consecutive AG dinucleotides to regulate alternative 3' splice site choice in vertebrate 4.1 genes[J].
Mol Cell Biol,2012, 32 (11) : 2044-53.
DOI: 10.1128/MCB.05716-11. ( 0) 0)
|
| [6] |
Wang Z, Zhang J, Ye M, et al. Tumor suppressor role of protein 4.1B/DAL-1[J].
Cell Mol Life Sci,2014, 71 (24) : 4815-30.
DOI: 10.1007/s00018-014-1707-z. ( 0) 0)
|
| [7] |
Cavanna T, Pokorná E, Veselý P, et al. Evidence for protein 4.1B acting as a metastasis suppressor[J].
J Cell Sci,2007, 120 (Pt 4) : 606-16.
( 0) 0)
|
| [8] |
Nagata M, Sakurai-Yageta M, Yamada D, et al. Aberrations of a cell adhesion molecule CADM4 in renal clear cell carcinoma[J].
Int J Cancer,2012, 130 (6) : 1329-37.
DOI: 10.1002/ijc.v130.6. ( 0) 0)
|
| [9] |
Heller G, Geradts J, Ziegler B, et al. Downregulation of TSLC1 and DAL-1 expression occurs frequently in breast cancer[J].
Breast Cancer Res Treat,2007, 103 (3) : 283-91.
DOI: 10.1007/s10549-006-9377-7. ( 0) 0)
|
| [10] |
Martinez-Cardús A, Vizoso M, Moran S, et al. Epigenetic mechanisms involved in melanoma pathogenesis and chemoresistance[J].
Ann Transl Med,2015, 3 (15) : 209.
( 0) 0)
|
| [11] |
Teixido C, Gonzalez-Cao M, Karachaliou N, et al. Predictive factors for immunotherapy in melanoma[J].
Ann Transl Med,2015, 3 (15) : 208.
( 0) 0)
|
| [12] |
Dickinson PJ, Surace EI, Cambell M, et al. Expression of the tumor suppressor genes NF2, 4.1B, and TSLC1 in canine meningiomas[J].
Vet Pathol,2009, 46 (5) : 884-92.
DOI: 10.1354/vp.08-VP-0251-D-FL. ( 0) 0)
|
| [13] |
盛誉乔, 梅珊, 祁元明, 等. 4.1B蛋白的抑制肿瘤作用[J].
生命的化学,2008, 28 (6) : 711-4.
( 0) 0)
|
| [14] |
Hoover KB, Bryant P4. 1 family: organizers of the membrane and cytoskeleton[J].
Curr Opin Cell Biol,2000, 12 (2) : 229-34.
DOI: 10.1016/S0955-0674(99)00080-0. ( 0) 0)
|
| [15] |
Gimm JA, An XL, Nunomura W, et al. Functional characterization of spectrin-actin-binding domains in 4.1 family of proteins[J].
Biochemistry,2002, 41 (23) : 7275-82.
DOI: 10.1021/bi0256330. ( 0) 0)
|
| [16] |
Robb VA, Li W, Gutmann DH. Disruption of 14-3-3 binding does not impair protein 4.1B growth suppression[J].
Oncogene,2004, 23 (20) : 3589-96.
DOI: 10.1038/sj.onc.1207445. ( 0) 0)
|
| [17] |
Jung Y, Kissil JL, McCarty JH. beta8 integrin and band 4.1B cooperatively regulate morphogenesis of the embryonic heart[J].
Dev Dyn,2011, 240 (1) : 271-7.
DOI: 10.1002/dvdy.22513. ( 0) 0)
|
| [18] |
Wang J, Song J, An C, et al. A 130-kDa protein 4.1B regulates cell adhesion, spreading, and migration of mouse embryo fibroblasts by influencing actin cytoskeleton organization[J].
J Biol Chem,2014, 289 (9) : 5925-37.
DOI: 10.1074/jbc.M113.516617. ( 0) 0)
|
| [19] |
Busam RD, Thorsell AG, Flores AA, et al. Structural basis of tumor suppressor in lung cancer 1 (TSLC1) binding to differentially expressed in adenocarcinoma of the lung (DAL-1/4.1B)[J].
J Biol Chem,2011, 286 (6) : 4511-6.
DOI: 10.1074/jbc.M110.174011. ( 0) 0)
|
| [20] |
Schulz WA, Ingenwerth M, Djuidje CE, et al. Changes in cortical cytoskeletal and extracellular matrix gene expression in prostate cancer are related to oncogenic ERG deregulation[J].
BMC Cancer,2010, 10 : 505.
DOI: 10.1186/1471-2407-10-505. ( 0) 0)
|
| [21] |
Chen X, Guan X, Zhang H, et al. DAL-1 attenuates epithelial-to mesenchymal transition in lung cancer[J].
J Exp Clin Cancer Res,2015, 34 : 3.
DOI: 10.1186/s13046-014-0117-2. ( 0) 0)
|
| [22] |
Yu F, Yang H, Zhang Z, et al. DAL1/4.1B contributes to epithelialmesenchymal transition via regulation of transforming growth factorbeta in lung cancer cell lines[J].
Mol Med Rep,2015, 12 (4) : 6072-8.
( 0) 0)
|
| [23] |
Schulz WA, Alexa A, Jung V, et al. Factor interaction analysis for chromosome 8 and DNA methylation alterations highlights innate immune response suppression and cytoskeletal changes in prostate cancer[J].
Mol Cancer,2007, 6 : 14.
DOI: 10.1186/1476-4598-6-14. ( 0) 0)
|
| [24] |
Yamada D, Kikuchi S, Williams YN, et al. Promoter hypermethylation of the potential tumor suppressor DAL-1/4.1B gene in renal clear cell carcinoma[J].
Int J Cancer,2006, 118 (4) : 916-23.
DOI: 10.1002/ijc.21450. ( 0) 0)
|
| [25] |
Dafou D, Grun B, Sinclair J, et al. Microcell-Mediated chromosome transfer identifies EPB41L3 as a functional suppressor of epithelial ovarian cancers[J].
Neoplasia,2010, 12 (7) .
( 0) 0)
|
| [26] |
Gerber MA, Bahr SM, Gutmann DH. Protein 4.1B/differentially expressed in adenocarcinoma of the lung-1 functions as a growth suppressor in meningioma cells by activating Rac1-dependent c-Jun-NH(2)-kinase signaling[J].
Cancer Res,2006, 66 (10) : 5295-303.
DOI: 10.1158/0008-5472.CAN-05-1628. ( 0) 0)
|
| [27] |
Fabbrizio E, El Messaoudi S, Polanowska J, et al. Negative regulation of transcription by the typeⅡarginine methyltransferase PRMT5[J].
EMBO Rep,2002, 3 (7) : 641-5.
DOI: 10.1093/embo-reports/kvf136. ( 0) 0)
|
| [28] |
Mariathasan S, Newton K, Monack DM, et al. Differential activation of the inflammasome by caspase-1 adaptors ASC and Ipaf[J].
Nature,2004, 430 (6996) : 213-8.
DOI: 10.1038/nature02664. ( 0) 0)
|
| [29] |
Jiang W, Newsham IF. The tumor suppressor DAL-1/4.1B and protein methylation cooperate in inducing apoptosis in MCF-7 breastcancer cells[J].
Mol Cancer,2006 (5) : 4.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
