2. 中南大学湘雅三医院检验科,湖南 长沙 410013
2. Department of Clinic Laboratory, Third Xiangya Hospital, Central South University, Changsha 410013, China
SUN蛋白是一类含有SUN结构域蛋白的总称,目前发现的SUN蛋白有:SUN1、SUN2、SUN3、SUN4(又称SPAG4)和SUN5(又称SPAG4L或TSARG4)[1]。通过对广谱性表达的SUN1和SUN2的研究发现,SUN蛋白可通过其SUN domain与带有KASH domain的蛋白相互作用(如:Nesprin-2, Nesprin-3等),形成复合物,介导胞浆细胞骨架与核细胞骨架的连接,在细胞分裂中参与细胞核迁移、核膜重塑等生理功能[1-3]。
SUN5是本课题组在研究精子发生过程时最先发现的,并于2001年率先提交GenBank(登录号:AF401350)[4-5]。通过亚细胞定位研究发现,SUN5定位在核膜和内质网[6]。通过对组织表达谱分析发现,SUN5不同于SUN1和SUN2,在正常成熟组织中SUN5主要分布于睾丸[6-7]。通过对模型小鼠的研究发现,小鼠Sun5(又称SRG4)主要在睾丸精母细胞和圆形精子细胞中高表达,其表达高低受生长发育调控[7]。郭睿等[8]研究发现,从粗线期精母细胞阶段到长形精子细胞阶段Sun5(Spag4L)表达下调,在圆形和长形精子细胞中其表达量分别下降了33%和45%。Chalmel等[9]对精子发生中基因表达变化的研究发现,Sun5(Spag4L)基因是一个减数分裂的标志性基因。以上研究说明Sun5在精子发生中可能发挥重要的作用,对SUN5基因的研究将为了解精子发生的分子机制具有重要的意义。
2011年,Frohnert等[10]从小鼠睾丸中克隆了Sun5的一个新剪切本Spag4L-2。最近,我们从人睾丸和Ntera-2细胞中成功地克隆了人类SUN5的另一个新剪切体SUN5β。那么,如何识别这两个不同的剪切体?为了解决这个难题,我们通过比对SUN5和SUN5β的序列差异,在差异区域设计合成短肽,制备多克隆抗体。通过Western blot和免疫荧光实验,检测SUN5抗体的特异性,并用该抗体对人睾丸细胞涂片进行检测,观察SUN5蛋白在人类生殖中的表达,为阐明SUN5在精子发生中的作用奠定基础。
1 材料和方法 1.1 材料Ntera-2细胞由本医学实验中心保藏;胎牛血清、1640培养基、0.25%胰酶等均购自Gibco;HRP标记的羊抗兔二抗购自Protein;Cy3标记的驴抗兔荧光二抗购自碧云天公司。检测SUN5和SUN5β总蛋白的抗体来源于Santa Cruz和博奥森生物公司。
1.2 方法 1.2.1 生物信息学分析应用NCBI中的BLAST软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)和ExPASy对SUN5和SUN5β进行生物信息学分析,观察SUN5和SUN5β的差异区域是否存在功能域。
1.2.2 SUN5抗体的制备与纯化分析SUN5和SUN5β的差异区域,寻找合适的抗原决定簇位点,与澳大利亚南澳大学周鑫福教授合作设计合成短肽,以合成短肽为抗原,免疫2只雄性新西兰兔(2 kg)。免疫前3 d,耳部采血作为阴性对照。初次免疫在背部皮下多点注射,每隔2周加强免疫,每只兔子加强免疫2次,最后1次免疫1周后进行采血,分离血清,并对所制备的SUN5多克隆抗体进行纯化,冻干后分装[11]。
1.2.3 Western blotting检测SUN5在Ntera-2细胞中的表达Ntera-2细胞用1640培养基在37℃、5% CO2的温箱内培养进行培养,待接种的细胞生长到70%后,用0.25%胰酶消化,PBS洗脱3次,用RIPA裂解液进行裂解,提取总蛋白。取1管SUN5多克隆抗体干粉,加入无菌去离子水800µL,甘油200µL,混匀。SUN5抗体分别按1:200、1:500、1:750、1:1000、1:2000稀释,对照GAPDH按照1:1000稀释进行孵育,二抗为HRP标记的羊抗兔抗体,按照1:5000的比例进行稀释,Western blot ting操作按照本实验室已建立的常规方法进行。
1.2.4 免疫荧光检测SUN5在Ntera-2细胞中的定位将Ntera-2细胞用0.02M PBS洗脱后用4%多聚甲醛固定10 min,然后用PBS洗脱3次,5 min/次;0.5% Triton X-100处理细胞15 min,PBS洗脱3次,5 min/次;5% BSA封闭1 h,SUN5抗体按照1:50的比例稀释后进行孵育,阴性对照用5% BSA进行杂交,室温孵育3 h后,用含有Triton X-100的PBS洗脱3次,5 min/次;用Cy3标记的驴抗兔荧光二抗按1:200的比例进行杂交1 h,含有Triton X-100的PBS洗脱3次,5 min/次;DAPI复染3 min,PBS洗脱3次,5 min/次,最后,甘油封片,在倒置荧光显微镜下观察结果。
1.2.5 人睾丸组织细胞涂片中SUN5蛋白表达的检测人睾丸组织来源于临床睾丸活检后废弃的标本,在征得患者口头同意后用于睾丸细胞涂片的制备。人睾丸组织细胞涂片的制备方法参照本课题组已建立的方法进行[12]。SUN5抗体按照1:50的比例进行稀释,免疫荧光实验操作方法同上1.2.4。
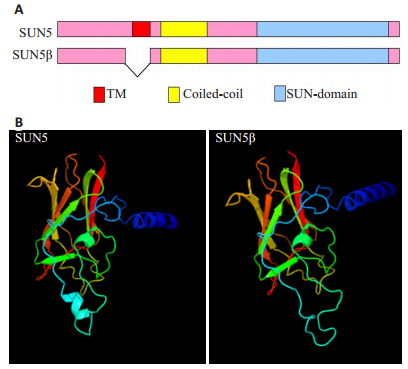
2 结果 2.1 生物信息学分析结果应用NCBI中的BLAST软件和ExPASy中的相关软件对SUN5和SUN5β进行生物信息学分析,结果发现,SUN5β与全长SUN5相比,有一段缺失,而缺失的这段氨基酸编码了跨膜区(图 1A),通过结构预测,发现这段缺失影响了SUN5β的空间构象(图 1B)。
|
图 1 SUN5和SUN5β生物信息学分析结果 Figure 1 Bioinformatics analysis of SUN5 and SUN5β. A: Compared with SUN5, SUN5βshows the absence o f the transmembrane domian; B: The protein conformation of SUN5βwas changed due to the deletion of the transmembrane region. |
在SUN5和SUN5β的差异区域,设计合成短肽,以合成短肽为抗原,免疫2只雄性新西兰兔,成功制备了SUN5多克隆抗体。为验证新制备抗体的质量,首先进行了Western blotting实验,用新制备的SUN5抗体检测Ntera-2细胞中SUN5的表达。结果发现,各实验组标本用GAPDH抗体杂交,均有条带,基本一致,说明样品质量有保障。SUN5抗体稀释倍数从1:100到1:2000,均可检测到目的蛋白的表达,大小约为43 000,目标条带单一(图 2A)。应用商品化的抗体检测Ntera-2细胞中SUN5总蛋白的表达,结果发现,用两种不同品牌的抗体均可以在Ntera-2细胞中检测到SUN5和SUN5β的表达,对应的条带大小符合预期。以上结果说明,新制备的SUN5抗体可以特异性的用于检测全长SUN5蛋白(图 2B)。

|
图 2 Western bloting检测SUN5蛋白在Ntera-2细胞中的表达 Figure 2 Expression of SUN5 detected by Western blotting in Ntera-2 cells. A: Results of Western blot obtained by using different concentrations of SUN5 antibody; B: Western blot result with the new SUN5 antibody, compared with another two SUN5 antibodies, for detecting total SUN5 protein in Ntera-2 cells. |
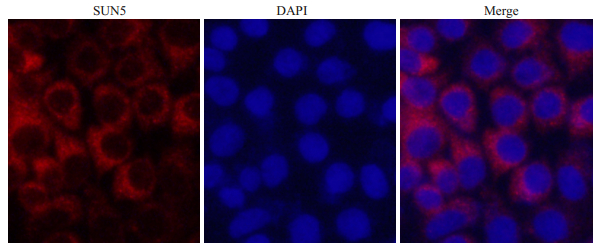
为了验证新制备的SUN5抗体能否用于免疫荧光实验,我们以Ntera-2细胞为实验材料,观察全长SUN5蛋白在Ntera-2细胞中的表达。免疫荧光实验结果表明,用新制备的SUN5抗体可检测到红色荧光标记的SUN5蛋白,细胞核用DAPI染色,图片叠加后发现,红色荧光标记的全长SUN5蛋白主要在核膜和胞浆中表达,与我们前期报道的全长SUN5亚细胞定位的结果一致,说明新制备的SUN5抗体,可特异性的检测全长SUN5蛋白的表达(图 3)。
|
图 3 免疫荧光检测Ntera-2细胞中全长SUN5蛋白的表达 Figure 3 Expression of full-length SUN5 protein detected by immunofluorescence in Ntera-2 cells. |
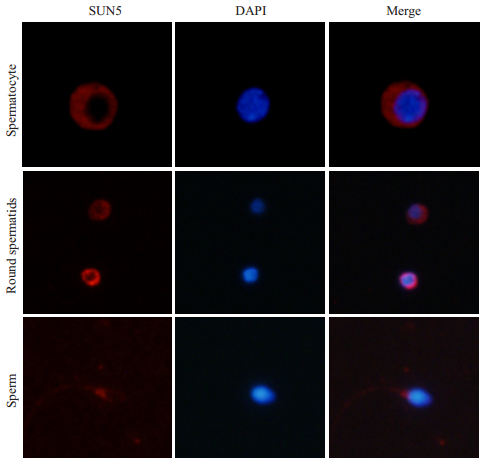
应用新制备的SUN5特异性抗体进行免疫荧光实验检测人睾丸生殖细胞中SUN5蛋白的表达,结果发现,全长SUN5蛋白在精母细胞、圆形精子细胞和成熟的精子中均有表达。在精母细胞和圆形精子细胞中,SUN5蛋白在核膜和细胞浆中均有表达,而在核内不表达。在成熟的精子细胞中,SUN5蛋白除了在核膜表达,还在精子尾部表达(图 4),同样,在精子细胞核内不表达。以上结果说明,SUN5蛋白在精子发生过程中参与了精子减数分裂和精子变态成形阶段的发育过程。
|
图 4 SUN5抗体检测睾丸生殖细胞中全长SUN5的表达 Figure 4 Expression of full-length SUN5 protein detected by new SUN5 antibody in human germ cells. |
真核细胞的核膜有机的将细胞核与细胞质分隔开来,保护细胞核内的遗传物质,维持细胞正常活动的机械特性[13]。SUN蛋白家族是近年来核膜蛋白的一个研究热点。前期大量的研究主要集中在广谱性表达的SUN1和SUN2上,而对具有组织特异性表达的SUN5目前研究尚不够深入。
在前期的研究中,我们首次从人睾丸文库中克隆了SUN5(又称TSARG4)的序列及其小鼠同源基因Sun5(又称SRG4),并提交国际GenBank登录(AF401350,AY307077),阐明了该蛋白的亚细胞定位[4-7]。随后,Frohnert等[10]从小鼠睾丸中克隆了Sun5的一个新剪切本Spag4L-2,说明小鼠睾丸中Sun5存在不同的剪切模式。SUN蛋白的其他成员也存在不同的剪切模式,比如:SUN1就有多个不同的剪切体[14]。最近,我们从人睾丸中克隆了SUN5的另一个剪切体SUN5β,这两个剪切体的功能是否一致,目前尚不清楚。为了区别SUN5和SUN5β,比如,只研究全长SUN5的功能,我们需要特异性的抗体对全长SUN5进行识别,为此,我们通过比对SUN5和SUN5β的序列,在差异区域寻找合适的抗原决定簇位点,设计合成短肽,通过免疫动物制备抗体。Western blot结果显示,新制备的SUN5抗体只识别全长SUN5的抗原表位,不识别SUN5β,而针对总SUN5制备的抗体,则可以同时检测到SUN5和SUN5β。免疫荧光的实验结果显示,新制备的SUN5抗体能够检测到核膜和胞浆中的SUN5蛋白。通过Western blot和免疫荧光实验的验证,说明针对全长SUN5的抗体制备成功,为下一步研究SUN5蛋白的功能提供了一个理想的工具。
此外,在前期的研究中,我们以小鼠为模式动物,发现Sun5 mRNA主要在精母细胞和圆形精子细胞中表达。Frohnert等[10]通过对小鼠Sun5及其新剪切体的研究认为,Sun5定位于精子头部朝向顶体一端的核膜上,有可能介导顶体与核膜的连接。最近,Yassine等[15]通过对野生型和Dpy1912基因敲除小鼠的研究发现,Sun5不参与顶体与核膜的连接。目前,不管是检测人还是小鼠细胞,各个实验室和商品化的SUN5抗体都是针对SUN5总蛋白的,不能区分SUN5的不同剪贴体。在本研究中,我们应用特异性的SUN5抗体,首次检测了全长SUN5蛋白在睾丸生殖细胞中的表达,通过对人睾丸细胞涂片的检测,结果发现,在精母细胞和圆形精子细胞中,SUN5蛋白主要出现在核膜和胞浆中,在核内没有表达;而在成熟的精子中,SUN5蛋白除了在核膜分布,还在精子尾部有表达,说明SUN5蛋白在精子发生过程中可能发挥着重要的生理功能。对SUN5蛋白功能的研究将有助于了解精子发生过程的分子机制。
| [1] |
Meinke P, Schirmer EC. LINC'ing form and function at the nuclear envelope[J].
FEBS Lett,2015, 589 (19, A, SI) : 2514-21.
( 0) 0)
|
| [2] |
Koizumi H, Gleeson JG. Sun proteins enlighten nuclear movement in development[J].
Neuron,2009, 64 (2) : 147-9.
DOI: 10.1016/j.neuron.2009.10.010. ( 0) 0)
|
| [3] |
Sosa BA, Kutay U, Schwartz TU. Structural insights into LINC complexes[J].
Curr Opin Struct Biol,2013, 23 (2) : 285-91.
DOI: 10.1016/j.sbi.2013.03.005. ( 0) 0)
|
| [4] |
邢晓为, 李麓芸, 傅俊江, 等. 人类生精相关新基因TSARG4的cDNA克隆[J].
生物化学与生物物理学报,2003, 35 (3) : 283-8.
( 0) 0)
|
| [5] |
Xing XW, Li LY, Fu JJ, et al. Cloning of human and mouse testis and spermato-genesis related gene 4 (TSARG4), a SPAG4 like gene[J].
Fertil Steril,2003, 80 (9) : S247.
( 0) 0)
|
| [6] |
Jiang XZ, Yang MG, Huang LH, et al. SPAG4L, a novel nuclear envelope protein involved in nuclear migration in meiotic stage of spermatogenesis[J].
DNA Cell Biol,2011, 30 (11) : 875-82.
DOI: 10.1089/dna.2010.1161. ( 0) 0)
|
| [7] |
Xing XW, Li LY, Liu G, et al. Identification of a novel gene SRG4 expressed at specific stages of mouse spermatogenesis[J].
Acta Biochim Biophys Sin (Shanghai),2004, 36 (5) : 351-9.
DOI: 10.1093/abbs/36.5.351. ( 0) 0)
|
| [8] |
郭睿, 李喜霞, 王惠珍. 小鼠睾丸特异基因在生精细胞中阶段性表达的定量分析[J].
动物学杂志,2009, 44 (1) : 39-46.
( 0) 0)
|
| [9] |
Chalmel F, Rolland AD, Niederhauser-Wiederkehr C, et al. The conserved transcriptome in human and rodent male gametogenesis[J].
Proc Natl Acad Sci USA,2007, 104 (20) : 8346-51.
DOI: 10.1073/pnas.0701883104. ( 0) 0)
|
| [10] |
Frohnert C, Schweizer S, Hoyer-Fender S. SPAG4L/SPAG4L-2 are testis-specific SUN domain proteins restricted to the apical nuclear envelope of round spermatids facing the acrosome[J].
Mol Hum Reprod,2011, 17 (4) : 207-18.
DOI: 10.1093/molehr/gaq099. ( 0) 0)
|
| [11] |
何胜平, 陈雅华, 赵瑛瑛, 等. 肝螺杆菌甲基基团趋化信号转导蛋白多克隆抗体的制备及鉴定[J].
南方医科大学学报,2013 (9) : 1295-8.
( 0) 0)
|
| [12] |
杨梦, 左笑丛, 李艳, 等. 一种小鼠睾丸细胞涂片的快速制备方法[J].
细胞与分子免疫学杂志,2014, 35 (2) : 202-5.
( 0) 0)
|
| [13] |
Link J, Jahn D, Alsheimer M. Structural and functional adaptations of the mammalian nuclear envelope to meet the meiotic requirements[J].
Nucleus,2015, 6 (2) : 93-101.
DOI: 10.1080/19491034.2015.1004941. ( 0) 0)
|
| [14] |
Göb E, Meyer-Natus E, Benavente R, et al. Expression of individual mammalian Sun1 isoforms depends on the cell type[J].
Commun Integr Biol,2011, 4 (4) : 440-2.
DOI: 10.4161/cib.15369. ( 0) 0)
|
| [15] |
Yassine S, Escoffier J, Abi NR, et al. Dynamics of sun5 localization during spermatogenesis in wild type and Dpy19l2 knock-out mice indicates that sun5 is not involved in acrosome attachment to the nuclear envelope[J].
PLoS One,2015, 10 (3) : e0118698.
DOI: 10.1371/journal.pone.0118698. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
