2. 第四军医大学基础部生理教研室,陕西 西安 710032
2. Department of Physiology, Faculty of Basic Medicine, Fourth Military Medical University, Xi'an 710032, China
心脏停搏后复灌可能导致的心肌损伤是目前临床心脏外科体外循环、冠脉血管成形术以及心脏移植手术中不可避免的问题,引起的心肌缺血再灌注损伤,造成心肌收缩力下降,心脏机械功能受损[1]。如何改善再灌注后心脏功能成为该领域的研究热点之一。以往的研究结果证实,钙超载是导致缺血再灌注损伤的一个重要原因[2],细胞凋亡是缺血再灌注损伤中细胞死亡的主要方式[3]。实验研究中,常利用大鼠心脏离体钙反常(calcium paradox, CaP)模型来模拟急性钙超载心肌损伤[2],即短时间无钙液灌注后,再恢复有钙液灌注,导致大量心肌细胞死亡,心脏功能障碍。但其具体机制仍不清楚。
2, 3-丁二酮单肟(2, 3-butanedione monoxime, BDM)是一种能使心肌肌球蛋白与肌动蛋白解偶联,从而产生负性肌力作用的药物[4],BDM作为停搏液的添加成分,已被证明可减少心肌能耗,提高心脏对缺血缺氧的耐受性,改善心肌氧供需平衡,而BDM是否可以改善心肌急性钙超载引起的心肌损伤尚未见报道。本研究旨在探讨BDM在改善大鼠离体心脏钙反常损伤中的作用及其机制。
1 材料和方法 1.1 实验动物与试剂健康成年雄性SD大鼠32只,购买于第四军医大学实验动物中心,体质量250~300 g。BDM和2、3、5-氯化三苯基四氮唑(TTC)购自Sigma公司。乳酸脱氢酶(LDH)检测试剂盒购自R & D公司。正常灌流液Krebs-Henseleit(KH solution)的成分和含量(mmol/L): NaCl 120,MgSO4 1.2,CaCl2 1.25,KCl 4.7,KH2PO4 1.2,Glucose 11,NaHCO3 25;无钙KH液配制方法:正常KH液中去除CaCl2,添加0.2 mmol/L Na2EDTA,其它离子成分相同。灌流前45 min用体积分数为95% O2和5% CO2混合气体持续向无钙KH液和正常KH液中通气至实验结束,实验过程中无钙KH液和正常KH液温度始终保持在37℃,pH维持在7.35~7.45。
1.2 大鼠离体心脏灌流模型制备大鼠腹腔注射戊巴比妥钠(40 mg/kg,30 g/L)和肝素(500 U/kg),麻醉后立刻开胸取出心脏置于预冷的4℃KH液中。将主动脉根部悬挂于Langendorff灌流管口,37℃正常KH液由主动脉口逆行灌注,实验过程中灌注压始终维持在80 mmHg。心脏复跳后稳定片刻,于左心耳处剪一小口,将前端带有乳胶球囊的测压管刺破二尖瓣插入左心室,测压管的前端通过压力换能器与记录仪和计算机相连。调节球囊内的液体量使左心室舒张末压维持在0~10 mmHg之间,对心脏平衡灌流15 min,待其跳动稳定后标记为灌注开始,按照实验分组进行灌流。
1.3 实验分组32只大鼠随机分成4组(n=8):正常对照组:用正常KH液灌注40 min;BDM对照组:依次用正常KH液体灌注6 min,含BDM的KH液灌注8 min,正常KH液灌注26 min;钙反常组:依次用正常KH液体灌注7 min,无钙KH液灌注3 min,正常KH液灌注(复钙)30 min;BDM干预钙反常组:在钙反常处理过程中,于无钙KH液灌注之前1 min、无钙KH液灌注期间以及复钙后的前4 min给与BDM处理;依据文献报道,实验选用的观察浓度为20 mmol/L [5]。
1.4 心脏功能的测定实验全程记录左室内压(Left ventricular pressure, LVP)、左室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左室收缩峰压(left ventricular peak systolic pressure,LVPSP)的变化。采用LVPSP和LVEDP的差值作为左室发展压(left ventricular developed pressure, LVDP)。根据既往文献报道,钙反常模型造成的挛缩是心肌损伤的重要原因,可造成LVEDP显著抬升[6]。据此,实验中用LVEDP反映心肌挛缩程度。
1.5 心肌梗死面积测定实验结束后,立即取下心脏于-80℃冻存1 h;沿心脏纵轴将心脏切成6片厚度为1 mm左右的均匀切片,置于10 mg/mL TTC溶液中,37℃水浴避光孵育15 min;4%多聚甲醛浸泡过夜;心脏切片用数码相机拍照,使用OPTIMASv5.2软件双盲法测量心梗面积。红色区为正常心肌组织,白色区为死亡心肌组织,计算心肌梗死面积百分比(%)=(白色区面积/总面积)×100%。
1.6 LDH检测分别收集各组复灌开始后5 min冠脉流出液,按照R & D公司提供的ELISA试剂盒说明书检测每组心脏释放LDH的总活性,实验结果以实验组吸光值/对照组吸光值来表示各组LDH的相对活性。
1.7 TUNEL染色采用常规方法,石蜡包埋切片,按照试剂盒要求处理标本,激光共聚焦显微镜采集图像,每张切片随机选取6个高倍视野,计数每个视野内凋亡细胞核数和总细胞核数,心肌细胞凋亡指数=凋亡细胞核数/总细胞核数。凋亡细胞核为绿色荧光,正常细胞核为蓝色荧光。
1.8 Western blotting法检测cleaved caspase-3和细胞色素c蛋白的表达分别取各组新鲜大鼠左室心肌组织,提取蛋白,采用BCA比色法进行蛋白定量;配置12% SDS-PAGE分离胶电泳分离蛋白,蛋白样品在100℃煮沸7 min,每孔7μL细胞蛋白样品上样,置于电泳缓冲液中电泳,分离目的蛋白,90 V转膜60 min,将蛋白质转移至PVDF膜。将目的条带切下,用TBST配制的5% BSA封闭2 h,封闭后以cleaved caspase-3和细胞色素c以及GAPDH一抗(稀释度为1:1000)4℃孵育过夜;TBST洗膜后,用HRP标记的羊抗兔二抗(稀释度为1:5000)37℃孵育2 h,TBST洗膜,ECL显色,曝光后扫描,用Image J图像分析软件进行光密度分析。以GAPDH为内参。
1.9 统计学分析数据采用均数±标准差表示,应用GraphPad Prism 5.0统计软件进行分析,两组间差异采用Tukey检验,各组间差异比较采用单因素方差分析(One-way ANOVA),以P<0.05表示差异有统计学意义。
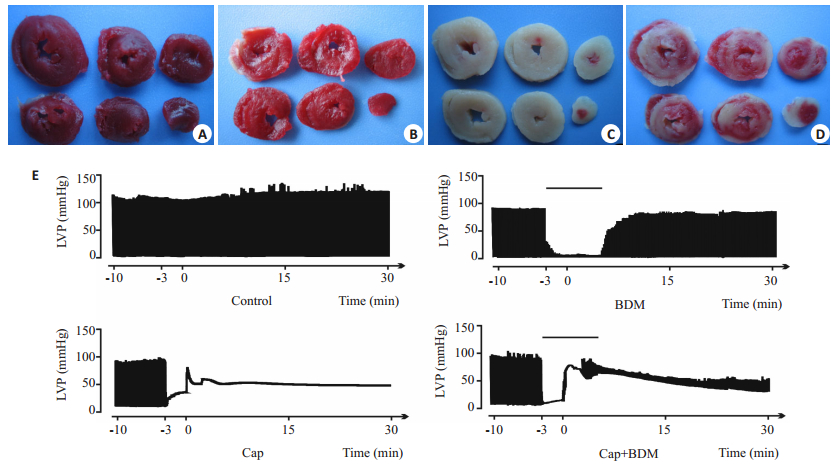
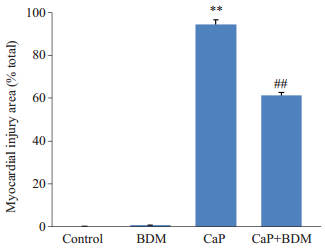
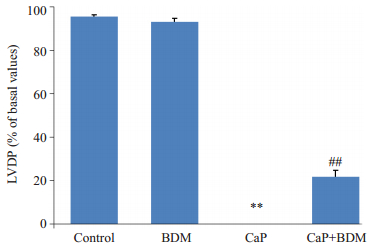
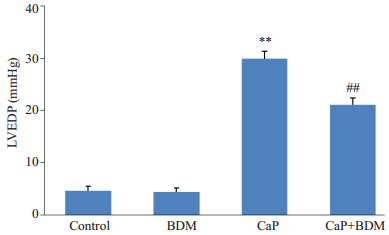
2 结果 2.1 BDM对大鼠心功能和心肌梗死面积的影响平衡灌注期,各组大鼠心脏LVEDP、LVDP均无显著差异,对照组大鼠心脏正常KH液灌注40 min,心功能无明显改变,心肌细胞未见梗死;用含BDM(20 mmol/L)的KH液灌注8 min,与平衡期相比,LVP明显降低,恢复正常KH液灌注后,心功能和心梗面积与对照组相比没有显著性变化(P>0.05);钙反常组大鼠心脏3 min无钙液、30 min正常KH液接替灌注后,与正常对照组相比,LVEDP显著抬升,LVDP为0(P<0.01),心肌细胞几乎全部死亡(P<0.01);BDM干预组大鼠心脏可显著降低LVEDP和心肌损伤面积(P<0.01),且LVDP有所恢复(P<0.01,图 1)。图 2为各组间心肌梗死面积比例,图 3和4分别为各组大鼠心脏复钙灌注末LVDP恢复比例和LVEDP的水平。
|
图 1 各组心肌组织TTC染色和左室内压力原始图 Figure 1 TTC staining of heart slices and left ventricular pressure (LVP) in each group. A: Control group; B: BDM group; C: CaP group; D: CaP+BDM group; E: Left ventricular pressure in each group. |
|
图 2 各组心梗面积百分比 Figure 2 Percentage of myocardial infarct size in each group. **P < 0.01 vs Control; ##P < 0.01 vs CaP. |
|
图 3 复钙灌注末LVDP恢复率 Figure 3 Recovery of LVDP at the end of the experiment. **P < 0.01 vs Control; ##P < 0.01 vs CaP. |
|
图 4 复钙灌注灌末LVEDP水平 Figure 4 Level of LVEDP at the end of experiments. **P < 0.01 vs Control; ##P < 0.01 vs CaP. |
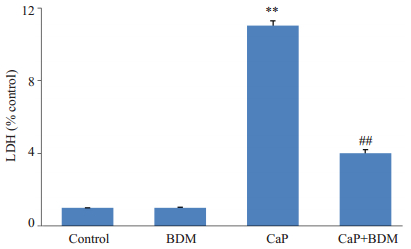
收集复灌开始后5 min冠脉流出液,按照R & D公司提供的ELISA试剂盒使用说明检测心脏释放LDH的总活性,实验结果以实验组吸光值/对照组吸光值表示各组LDH的相对活性。结果(图 5):与Control组相比,CaP组大鼠冠脉流出液中LDH含量显著升高(P<0.01);与CaP组相比,CaP+BDM组大鼠冠脉流出液中LDH含量明显降低(P<0.01);BDM组与Control组比较无显著差异。结果提示BDM干预钙反常处理的大鼠心脏可以明显降低LDH的释放。
|
图 5 各组LDH活性与对照组的比值 Figure 5 Ratio of LDH value to the control group. **P < 0.01 vs Control; ##P < 0.01 vs CaP. |
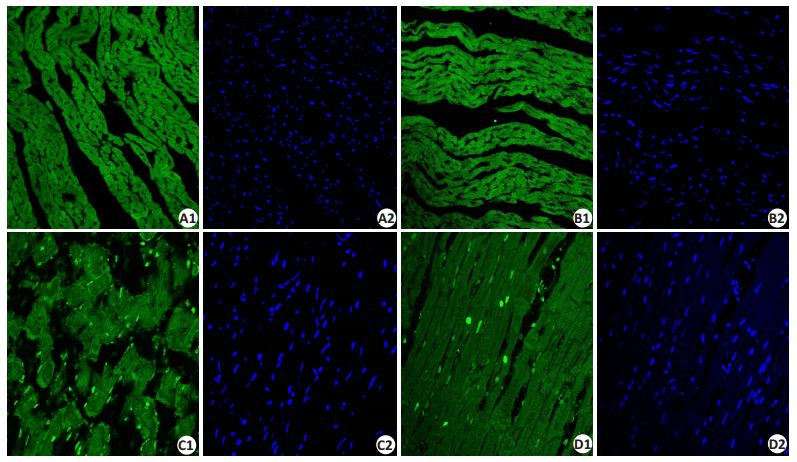
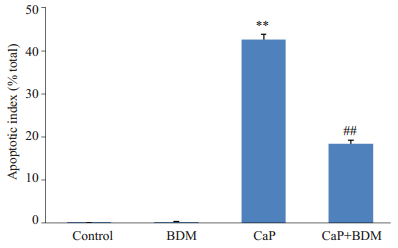
Control组和BDM组心脏组织切片未见TUNEL染色阳性细胞(图 6,P>0.05)。与Control组相比,CaP组心脏组织切片可见大量TUNEL染色阳性细胞(P<0.01),而CaP给予BDM处理后,TUNEL染色阳性细胞数量明显减少(P<0.01)。提示BDM干预钙反常处理的大鼠心脏减少了由钙反常引起的心肌细胞凋亡。图 7为各组细胞凋亡指数的比较。
|
图 6 各组大鼠心肌组织切片TUNEL染色 Figure 6 Myocardial TUNEL-positive cells in each group (Original magnification:×40). A: Control; B: BDM; C: CaP; D: CaP+BDM. 1: Apoptosis nucleus; 2: Normal nucleus. |
|
图 7 各组大鼠心肌细胞凋亡指数 Figure 7 The myocardial apoptotic index in each group. **P < 0.01 vs Control; ##P < 0.01 vs CaP. |
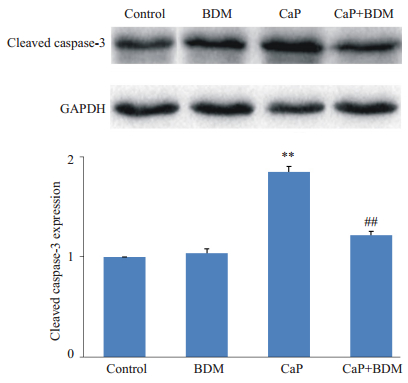
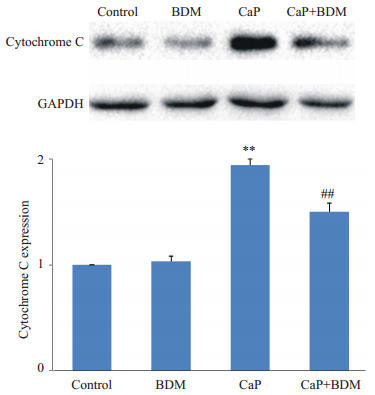
Western blot法检测各组cleaved caspase-3和细胞色素c蛋白表达水平,结果(图 8,9)显示:与Control组相比,CaP组大鼠心肌组织中的cleaved caspase-3和细胞色素c蛋白表达明显升高(P<0.01);与CaP组相比,CaP+BDM组大鼠心肌cleaved caspase-3和细胞色素c蛋白表达减少(P<0.01);BDM组与Control比较无显著性差异。结果提示BDM干预钙反常处理后抑制了cleaved caspase-3和细胞色素c蛋白表达的上调。
|
图 8 各组cleaved caspase-3与对照组的比值 Figure 8 The ratio of cleaved caspase-3 to the control group. **P < 0.01 vs Control; ##P < 0.01 vs CaP. |
|
图 9 各组细胞色素c与对照组的比值 Figure 9 Ratio of cytochrome c to the control group. **P < 0.01 vs Control; ##P < 0.01 vs CaP. |
心脏停搏一段时间后恢复血液供应,不但未使心肌细胞的缺血性损伤减轻或恢复,反而加重了其损伤程度甚至导致细胞不可逆的病理性死亡,形成再灌注心肌损伤[1],这是导致复灌后心脏功能障碍的重要原因。缺血再灌注损伤过程伴有挛缩现象的发生[6],挛缩是如何参与心肌损伤,其具体机制还不十分清楚。本研究采用大鼠离体心脏钙反常模型模拟心肌急性钙超载,证明BDM能通过抑制挛缩和细胞凋亡减轻钙超载引起的心肌损伤,改善复钙灌注后心脏机械功能,提示挛缩通过引起细胞凋亡导致大鼠心脏急性钙超载损伤,进一步完善了以往的研究。
心脏停搏后,心肌细胞发生缺血、缺氧、ATP耗竭和酸中毒等一系列病理变化,一方面激活Na+通道、Na+/H+交换体和Na+/HCO3-同向转运体,增加胞内Na+浓度[7];另一方面,缺血期ATP快速耗尽,钠泵转运Na+出胞的方式被抑制,胞内Na+大量积累。再灌注时,膜上钠钙交换体(Na+/Ca2+ exchanger, NCX)反向模式激活,胞外Ca2+大量、快速进入心肌细胞[8],引发胞内钙超载。与此同时,再灌注使部分线粒体功能恢复,ATP合成增多,肌动蛋白与肌球蛋白相互作用增加,出现依赖Ca2+、但不受控的收缩活动即挛缩[9]。有文献报道,挛缩引起细胞骨架解体和肌节破坏,导致心脏功能障碍[10]。本研究发现,钙反常组大鼠心脏复钙灌注后产生强烈挛缩,冠脉流出液中LDH含量和舒张末期左室内压显著升高,心肌组织几乎全部死亡;BDM干预钙反常组大鼠能明显减轻心脏挛缩程度,降低冠脉流出液中LDH含量和舒张末期左室内压,减小心肌梗死面积,改善心功能,提示BDM可以抑制挛缩减轻钙超载心肌损伤。
细胞凋亡是心肌再灌注损伤中重要的细胞死亡方式,是由基因控制的程序化细胞死亡过程[11]。心肌缺血后,胞内ATP快速耗竭,结果使bax蛋白从胞质转移至线粒体外膜,引起线粒体功能障碍,线粒体发生肿胀,线粒体通透性转换孔开放[12],导致细胞色素c由线粒体释放到胞质,激活caspase-3,caspase-3是caspase家族中关键的效应分子,可降解核糖聚合酶使DNA链断裂[13],引起细胞凋亡,进而导致心肌损伤。本研究发现钙反常组大鼠心脏cleaved caspase-3和细胞色素c的表达量均显著升高,而BDM干预钙反常组大鼠心脏cleaved caspase-3和细胞色素c的表达量较钙反常组大鼠明显降低,同时TUNEL染色发现BDM能明显降低细胞凋亡指数,提示BDM通过减轻细胞凋亡改善钙超载心肌损伤。
此外,BDM通过降低收缩蛋白对胞内钙离子的敏感性并促进肌动蛋白和肌球蛋白横桥的解离抑制兴奋收缩耦联过程,进而抑制心肌收缩[14]。另有研究证实,BDM通过抑制钙离子跨膜转运过程和细胞膜钙通道活性,直接降低胞内钙浓度[15]。因此,BDM还可以通过抑制收缩蛋白对钙离子的敏感性和降低细胞内钙浓度,减轻挛缩引起的心肌缺血再灌注损伤,改善再灌注后心脏功能。
总之,本研究证实BDM可以明显抑制急性钙超载引起的挛缩和细胞凋亡,改善心功能,减轻大鼠离体心脏钙超载损伤,是一种潜在的缺血再灌注心肌保护药物。然而,抑制挛缩并不能完全消除心肌损伤,说明还有其它分子和机制的参与,这将有待进一步的研究,而阐明这些机制将有利于更好的认识和防治心肌缺血再灌注损伤。
| [1] |
Prasad A, Stone GW, Holmes DR, et al. Reperfusion injury, microvascular dysfunction, and cardioprotection the ``dark side{''} of reperfusion[J].
Circulation,2009, 120 (21) : 2105-12.
DOI: 10.1161/CIRCULATIONAHA.108.814640. ( 0) 0)
|
| [2] |
Garcia-Dorado D, Ruiz-Meana M, Inserte JA, et al. Calciummediated cell death during myocardial reperfusion[J].
Cardiovasc Res,2012, 94 (2) : 168-80.
DOI: 10.1093/cvr/cvs116. ( 0) 0)
|
| [3] |
Thuerauf DJ, Marcinko M, Gude N, et al. Activation of the unfolded protein response in infarcted mouse heart and hypoxic cultured cardiac myocytes[J].
Circ Res,2006, 99 (3) : 275-82.
DOI: 10.1161/01.RES.0000233317.70421.03. ( 0) 0)
|
| [4] |
Chung CS, Mechas C, Campbell KS. Myocyte contractility can be maintained by storing cells with the myosin ATPase inhibitor 2, 3 butanedione monoxime[J].
Physiol Rep,2015, 3 (6) : e12445.
DOI: 10.14814/phy2.12445. ( 0) 0)
|
| [5] |
Voigtländer J, Leiderer R, Mühlbayer D, et al. Time-dependent efficacy of initial reperfusion with 2, 3 butanedione monoxime (BDM) on release of cytosolic enzymes and ultrastructural damage in isolated hearts[J].
Thorac Cardiovasc Surg,1999, 47 (4) : 244-50.
DOI: 10.1055/s-2007-1013152. ( 0) 0)
|
| [6] |
Zhang JY, Tong W, Wu F, et al. Different roles for contracture and calpain in Calcium Paradox-Induced heart injury[J].
PLoS One,2012, 7 (12) : e52270.
DOI: 10.1371/journal.pone.0052270. ( 0) 0)
|
| [7] |
Ten Hove M, Van Emous JG, Van Echteld CJ. Na+ overload during ischemia and reperfusion in rat hearts: Comparison of the Na+/H+ exchange blockers EIPA, cariporide and eniporide[J].
Mol Cell Biochem,2003, 250 (1/2) : 47-54.
DOI: 10.1023/A:1024985931797. ( 0) 0)
|
| [8] |
Piper HM, Abdallah Y, Schafer C. The first minutes of reperfusion: a window of opportunity for cardioprotection[J].
Cardiovasc Res,2004, 61 (3) : 365-71.
DOI: 10.1016/j.cardiores.2003.12.012. ( 0) 0)
|
| [9] |
Kojima A, Kitagawa H, Omatsu-Kanbe M, et al. Ca2+ paradox injury mediated through TRPC channels in mouse ventricular myocytes[J].
Br J Pharmacol,2010, 161 (8) : 1734-50.
DOI: 10.1111/j.1476-5381.2010.00986.x. ( 0) 0)
|
| [10] |
Mani H, Tanaka H, Adachi T, et al. How does the Ca2+-paradox injury induce contracture in the heart-A combined study of the intracellular Ca2+ dynamics and cell structures in perfused rat hearts-[J].
Acta Histochem Cytochem,2015, 48 (1) : 1-8.
DOI: 10.1267/ahc.14059. ( 0) 0)
|
| [11] |
Morciano G, Giorgi C, Bonora M, et al. Molecular identity of the mitochondrial permeability transition pore and its role in ischemiareperfusion injury[J].
J Mol Cell Cardiol,2015, 78 : 142-53.
DOI: 10.1016/j.yjmcc.2014.08.015. ( 0) 0)
|
| [12] |
Krolikowski JG, Bienengraeber M, Weihrauch D, et al. Inhibition of mitochondrial permeability transition enhances isoflurane-induced cardioprotection during early reperfusion: the role of mitochondrial KATP channels[J].
Anesth Analg,2005, 101 (6) : 1590-6.
( 0) 0)
|
| [13] |
Bernardi P, Rasola A. Calcium and cell death:the mitochondrial connection[J].
Subcell Biochem,2007, 45 : 481-506.
DOI: 10.1007/978-1-4020-6191-2. ( 0) 0)
|
| [14] |
Brines L, Such-Miquel L, Gallego D, et al. Modifications of mechanoelectric feedback induced by 2, 3-butanedione monoxime and Blebbistatin in Langendorff-perfused rabbit hearts[J].
Acta Physiol (Oxf),2012, 206 (1) : 29-41.
DOI: 10.1111/apha.2012.206.issue-1. ( 0) 0)
|
| [15] |
Lou Q, Li WW, Efimov IR. The role of dynamic instability and wavelength in arrhythmia maintenance as revealed by panoramic imaging with blebbistatin vs. 2, 3-butanedione monoxime[J].
Am J Physiol Heart Circ Physiol,2012, 302 (1) : H262-9.
DOI: 10.1152/ajpheart.00711.2011. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
