肾脏血供占心输出量的20%,90%~95%分布于皮质,是高灌注且少侧枝循环的脏器。围术期休克、体外循环、血管活性药物应用等因素,均易导致患者肾实质尤其是皮质的缺血再灌注损伤(I/R)[1-2]。右美托咪定是α2受体激动剂,是临床常用的镇静镇痛药。已有研究者经食道超声监测肾段动脉发现,右美托咪定可增加心脏瓣膜手术患者体外循环期间和体外循环后的肾血流量[3]。国内外的多项研究也表明右美托咪定降低抗利尿激素的分泌,增加尿量,具有肾保护作用[2, 4]。然而,右美托咪定对围术期肾I/R损伤高危患者的肾皮质和髓质的微循环灌注的影响尚未见报道。超声造影(CEUS)定量分析技术能够实时动态观察肾脏整体血供情况,评价肾实质血流灌注的变化规律[1, 5]。本试验拟通过CEUS技术评价右美托咪定对兔肾缺血再灌注损伤时肾血流灌注的影响,为其肾保护作用提供可靠的理论依据。
1 材料和方法 1.1 动物分组清洁级健康成年新西兰家兔24只,雌雄不限,体质量2.2~2.7 kg。动物由南京医科大学附属南京医院动物中心提供,动物许可证号为SCXK(苏)2012-0008。自由饮水进食。按随机数字表法将动物分成3组:对照组(C组)、肾缺血再灌注损伤组(I/R组)和右美托咪定组(DEX组),每组各8只。DEX组于缺血前30 min给予10μg/kg腹腔注射,对照组不做任何处理。
1.2 肾缺血再灌注损伤模型的建立经耳缘静脉建立静脉通道,给予10%水合氯醛静脉注射麻醉(2.0 mL/kg)。双肾区剃毛,俯卧位固定。消毒皮肤后行双侧腰背部正中旁切口,钝性分离肾周脂肪囊,暴露肾脏。结扎右肾蒂,切除右肾。用无创血管夹夹闭左侧肾蒂,观察左肾颜色由鲜红变暗红,表明缺血成功。60 min后松开血管夹,观察左肾颜色由暗红变鲜红,表示再灌注成功。术后自由饮水进食。
1.3 超声造影检查所有家兔于再灌注24 h时水合氯醛麻醉,采用ESAOTE Mylab 65型彩色超声诊断仪(意大利百胜公司),LA532探头置于左肾最大冠状截面,多普勒超声观察肾脏的大小和皮质厚度,彩色多普勒血流成像(CDFI)定位肾门动脉,测量血流阻力指数(RI)。内置实时造影匹配成像技术(CnTi)进行超声造影检查,进入造影模式,设定相关参数:增益55%,深度4 cm,频率7.5 MHz,机械指数MI 0.08,声压50 DB,聚焦范围置于中间位置。按说明书将5 mL生理盐水注入超声造影剂SonoVue冻干粉末(意大利Bracco公司)中,用力摇匀配置成六氟化硫(SF6)微泡混悬液。抽取0.2 mL/kg快速团注入兔耳缘静脉内,随后注入3 mL生理盐水。同时启动超声仪内置计时键和动态存储键,连续扫描6 min。存储的动态图像应用TomTec分析软件进行脱机分析。尽可能取同一深度和位置、直径为3 mm的外层皮质为感兴趣区域(ROI),绘制时间-强度曲线(TIC),分析指标为:达峰时间(TTP)、峰值强度(PSI)、曲线上升斜率(Grad)和曲线下面积(AUC)。所有参数测量3次,取平均值。
1.4 超声造影检查超声造影结束后,经兔耳中央动脉抽血检测血肌酐(Scr)和血尿素氮(BUN),过量麻醉剂处死家兔,取左肾行病理形态学检查。应用AU2700全自动生化分析仪(Olympus光学株式会社,日本)检测血清肌酐和血尿素浓度。
1.5 统计学处理使用SPSS l6.0软件包进行统计学分析,计量资料以均数±标准差表示,采用单因素方差分析和配对t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 肾灰阶超声造影表现实时造影匹配成像技术下行超声造影,经对照组家兔耳缘静脉团注造影剂后,造影剂快速从肾窦沿肾各级动脉达肾包膜下,约4~8 s。之后肾皮质和髓质回声依次增强,直至整个肾皮质和髓质形成“火球样”增强。30~50 s开始消退,皮质消退最晚(图 1)。
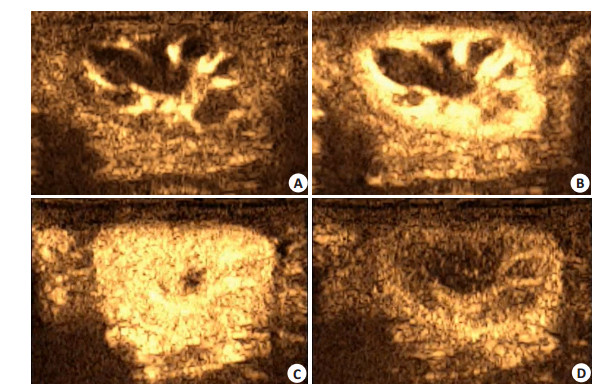
|
图 1 对照组家兔左肾超声造影声像图 Figure 1 Constract Enhanced Ultrasound of left kidney of rabbit in the Control group. A: Interlobar artery of kidney began to develop; B: Cortex of kidney began to develop; C: Perfusion of renal cortex and medulla reached peak; D: Interlobar artery of kidney began to fade away and cortex was still developping. |
与对照组比较,I/R组和DEX组肾的长径、前后径和皮质厚度增加,差异有统计学意义(P < 0.05)。与I/R组比较,DEX组肾的长径、前后径和皮质厚度减少(P < 0.05,表 1)。
| 表 1 3组家兔肾大小和肾功能测值比较 Table 1 Size of kidneys and renal function of rabbits in 3 groups (n=8, Mean±SD) |
与对照组比较,I/R组和DEX组的血肌酐和尿素氮水平升高(P < 0.05)。与I/R组比较,DEX组的血肌酐和尿素氮水平降低(P < 0.05,表 1)。
2.4 3组家兔肾皮质的血流灌注情况时间-强度曲线分析可见,对照组肾皮质感兴趣区的曲线上升支陡直,并迅速达峰,之后快速下降;缺血再灌注损伤组肾皮质曲线上升和下降过程均较对照组缓慢。与对照组比较,I/R组和DEX组的达峰时间延长,峰值强度和曲线上升斜率降低,曲线下面积显著增加(P < 0.05);与I/R组比较,DEX组的达峰时间缩短,峰值强度和曲线上升率增高,曲线下面积减少(P < 0.05,表 2)。
| 表 2 3组家兔肾皮质时间-强度各参数比较 Table 2 Size of the kidneys of rabbits in the 3 groups (n=8, Mean±SD) |
对照组兔肾小球、肾小管和间质无异常改变。I/R组兔肾小球淤血严重,肾小管上皮细胞气球样变性、空泡变大并坏死,管腔狭窄,肾间质充血、水肿,炎症细胞浸润明显。DEX组肾小球轻度淤血,肾小管上皮细胞轻度肿胀,间质轻度水肿(图 2)。
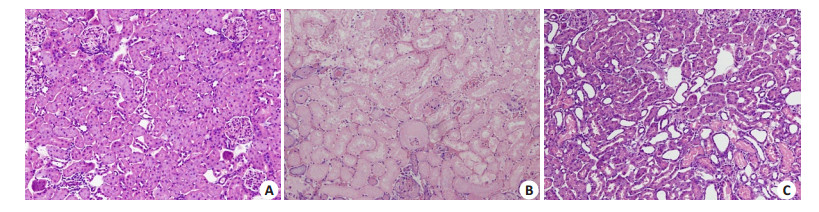
|
图 2 3组家兔肾脏病理学形态 Figure 2 Renal pathologies in the 3 groups of rabbits (HE staining, original magnification:×100). A: Control group; B:I/R group; C:DEX group. |
有研究者经食道超声彩色多普勒血流成像技术,发现右美托咪定可增加心脏瓣膜手术患者肾段动脉的血流[3]。本研究应用超声造影定量分析技术,从外周静脉团注超声造影剂六氟化硫,从微循环角度阐述右美托咪定对肾脏血流灌注的影响。六氟化硫是直径与红细胞大小相仿的良好血流示踪剂,可使肾脏增强显影,实时动态观察肾脏皮质微循环灌注的变化[5-6]。本研究结果显示,超声造影定量分析技术清晰显示了肾微循环灌注的层次和特征,缺血和再灌注损伤可致造影剂开始显影时间延迟,肾皮质和髓质充盈灌注达高峰时间延迟,造影剂灌注峰值强度下降,造影剂从肾脏消退时间延迟;而右美托咪定可减轻肾缺血和灌注损伤,表现为病理学形态和肾功能的改善,造影剂显影开始时间、达峰时间和消退时间缩短,灌注峰值强度增加。本研究首次从微循环水平提出了右美托咪定肾保护的实验依据,为后续研究提供了初步理论基础。
本研究中,I/R组肾脏再灌注24 h后,肌酐和尿素氮水平升高,肾大小和病理改变明显。病理改变表现为肾小管上皮细胞空泡变性、坏死,管腔狭窄,肾小球结构破坏,血管淤血栓塞,间质水肿炎性细胞浸润。提示肾缺血再灌注损伤模型建立成功。与I/R组比较,DEX组肾大小和病理改变轻微,血肌酐和尿素氮显著下降。提示右美托咪定明显改善肾缺血再灌注损伤,具有肾保护作用,与文献报道一致[2, 4]。
肾缺血再灌注损伤与细胞凋亡、炎症级联反应有关,最终导致肾微循环障碍,血流灌注下降[1, 7]。超声造影技术利用造影剂自由通过毛细血管,并经超声增强显影,造影动态影像经时间强度曲线分析,实时动态反映实质脏器的血流灌注情况[5, 8]。因肾皮质血流占肾整体血流的90%以上,可反映肾实质的血流灌注情况[5],故本研究选取肾皮质感兴趣区作为观察区域。时间强度曲线参数达峰时间反映造影剂进入组织的灌注速度[9]。本研究中,缺血和再灌注使肾皮质区TIC曲线上升速度减慢,曲线上升斜率降低,达峰时间延长,曲线下降更慢,同时CDFI监测显示肾血流阻力指数增加,与文献报道一致[6, 9]。以上结果提示了缺血再灌注24 h后肾脏血流灌注减慢,造影剂进入肾内各级血管包括毛细血管床的时间延长,肾微循环阻力增加,SF6微泡滞留肾微循环的时间延长。结合肾组织病理改变,原因与以下有关[5-6, 10-11]:(1)缺血和再灌注引起全身和局部交感活性增强,肾皮质血管强烈收缩,内皮细胞受损,炎性细胞趋化粘附并瘀滞于内皮,微血栓形成,血流缓慢;(2)肾小管上皮细胞肿胀变性,管腔狭窄,加之肾间质水肿,压迫小血管导致血管阻力增加,静脉回流受阻;(3)由于微血栓形成和血管阻力增加等因素引起血流缓慢,造影剂进入肾实质微循环的速度减慢,大量SF6微泡瘀滞在肾血管床内,同时廓清速度也减慢。
TIC曲线参数峰值强度是造影剂在局部切面增强最显著的强度,与组织灌注量有良好的相关性[9, 12]。曲线下面积反应的是一定时间内特定ROI内造影增强的累积效应,与造影剂的分布容积、血流速度及灌注时间相关[5-6]。本研究中,缺血和再灌注导致肾皮质区峰值强度降低,曲线下面积显著增加,与文献报道相符[11-13]。峰值强度下降的主要原因是肾血流阻力增加,血液粘滞,血流缓慢,进而肾内血流灌注速度降低,灌注量减少,同时TIC曲线下降也缓慢,造影剂廓清速度减慢[12-13]。另外,血管内皮细胞通透性增加,大量炎性细胞瘀滞于微血管和间质中。炎性细胞对造影剂有一定的吞噬作用,使被吞噬的微泡继续保留声学活性,最终形成造影增强的累积效应,使曲线下面积增加[11]。
右美托咪定可抑制肾组织缺血和再灌注引起的炎症反应,减轻肾小球淤血、肾小管上皮细胞肿胀、管腔狭窄以及肾实质水肿淤血[14]。右美托咪定还具有抗交感作用,降低全身和局部的去甲肾上腺素的水平,使肾中小动脉舒张[3, 15-16]。本研究发现右美托咪定可明显改善缺血和再灌注引起的病理改变,降低肾血流阻力指数,与文献报道一致。而右美托咪定对缺血再灌注引起的肾实质微循环是否有影响,目前还未见文献报道。本研究结果显示,右美托咪定组肾皮质TIC曲线参数中达峰时间缩短,峰值强度和曲线上升率增高,曲线下面积减少。这提示右美托咪定可改善肾实质微循环,增加肾血流灌注。右美托咪定改善微循环依赖于其减轻肾组织病理变化和舒张肾中小动脉的双重作用,使血流阻力降低,血流灌注增加,超声造影表现为六氟化硫微泡进入血管床时间和廓清时间缩短。另一项CEUS研究发现右美托咪定降低健康犬腹腔脏器包括肾脏的血流量,TIC参数达峰时间延长,峰值强度下降[17],与本研究右美托咪定增加肾血流和改善肾微循环的结果不符。原因可能是Restitutti [17]的研究中犬的肾脏未受到缺血和再灌注创伤,且10μg/kg右美托咪定经静脉给予剂量偏大引起肾动脉血管收缩所致。具体机制还需进一步研究。
综上所述,右美托咪定可改善缺血/再灌注引起的肾微循环灌注变化,超声造影定量分析技术清晰显示了肾微循环灌注的层次和特征,在评价和监测右美托咪定改善肾血流灌注方面具有潜在临床应用价值。
| [1] |
Andonian S, Coulthard T, Smith AD, et al. Real-Time quantitation of renal ischemia using targeted microbubbles: in-vivo measurement of p-selectin expression[J].
J Endourol,2009, 23 (3) : 373-8.
DOI: 10.1089/end.2008.0229. ( 0) 0)
|
| [2] |
Si Y, Bao H, Han L, et al. Dexmedetomidine protects against renal ischemia and reperfusion injury by inhibiting the JAK/STAT signaling activation[J].
J Transl Med,2013, 11 (1) : 141.
DOI: 10.1186/1479-5876-11-141. ( 0) 0)
|
| [3] |
牛姣姣.右美托咪定对心脏瓣膜置换病人肾血流和肾功能的影响[D].长沙:中南大学, 2013: 27-9.
( 0) 0)
|
| [4] |
Gonullu E, Ozkardesler S, Kume T, et al. Comparison of the effects of dexmedetomidine administered at two different times on renal ischemia/reperfusion injury in rats[J].
Brazilian J Anesthesiol (Elsevier),2014, 64 (3) : 152-8.
DOI: 10.1016/j.bjan.2013.06.003. ( 0) 0)
|
| [5] |
Mahoney M, Sorace A, Warram J, et al. Volumetric ContrastEnhanced ultrasound imaging of renal perfusion[J].
J Ultrasound Med,2014, 33 (8) : 1427-37.
DOI: 10.7863/ultra.33.8.1427. ( 0) 0)
|
| [6] |
Li M, Luo Z, Chen X, et al. Use of contrast-enhanced ultrasound to monitor rabbit renal ischemia-reperfusion injury and correlations between time-intensity curve parameters and renal ICAM-1 expression[J].
Clin Hemorheol Microcirc,2015, 59 (2) : 123-31.
( 0) 0)
|
| [7] |
Wahhabaghai H, Heidari R, Zeinoddini A, et al. Hyperoxia-induced preconditioning against renal ischemic injury is mediated by reactive Oxygen species but not related to heat shock proteins 70 and 32[J].
Surgery,2015, 157 (6) : 1014-22.
DOI: 10.1016/j.surg.2015.01.025. ( 0) 0)
|
| [8] |
Dubory A, Laemmel E, Badner A, et al. Contrast enhanced ultrasound imaging for assessment of spinal cord blood flow in experimental spinal cord injury[J].
J Vis Exp,2015 (99) : e52536.
( 0) 0)
|
| [9] |
Siracusano S, Bertolotto M, Ciciliato S, et al. The current role of contrast-enhanced ultrasound (CEUS) imaging in the evaluation of renal pathology[J].
World J Urol,2011, 29 (5) : 633-8.
DOI: 10.1007/s00345-011-0699-7. ( 0) 0)
|
| [10] |
Malek M, Nematbakhsh M. Renal ischemia/reperfusion injury; from pathophysiology to treatment[J].
J Renal Injury Prev,2015, 4 (2) : 20-7.
( 0) 0)
|
| [11] |
Jing XX, Wang ZG, Ran HT, et al. Evaluation of renal ischemia–reperfusion injury in rabbits using microbubbles targeted to activated neutrophils[J].
Clin Imaging,2008, 32 (3) : 178-82.
DOI: 10.1016/j.clinimag.2008.03.001. ( 0) 0)
|
| [12] |
King KG, Gulati M, Malhi H, et al. Quantitative assessment of solid renal masses by contrast-enhanced ultrasound with time-intensity curves: how we do it[J].
Abdom Imaging,2015, 40 (7) : 2461-71.
DOI: 10.1007/s00261-015-0468-y. ( 0) 0)
|
| [13] |
Schneider AG, Goodwin MD, Schelleman A, et al. Contrastenhanced ultrasound to evaluate changes in renal cortical perfusion around cardiac surgery: a pilot study[J].
Crit Care,2013, 17 (4) : R138.
DOI: 10.1186/cc12817. ( 0) 0)
|
| [14] |
Cakir M, Polat A, Tekin S, et al. The effect of dexmedetomidine against oxidative and tubular damage induced by renal ischemia reperfusion in rats[J].
Ren Fail,2015, 37 (4) : 704-8.
DOI: 10.3109/0886022X.2015.1011550. ( 0) 0)
|
| [15] |
De Carvalho AL, Vital RB, Kakuda CM, et al. Dexmedetomidine on renal ischemia-reperfusion injury in rats: assessment by means of NGAL and histology[J].
Ren Fail,2015, 37 (3) : 526-30.
DOI: 10.3109/0886022X.2015.1006118. ( 0) 0)
|
| [16] |
Sarkar A, Tripathi RK, Choubey S, et al. Comparison of effects of intravenous clonidine and dexmedetomidine for blunting pressor response during laryngoscopy and tracheal intubation:A randomized control study[J].
Anesth Essays Res,2014, 8 (3) : 361-6.
DOI: 10.4103/0259-1162.143144. ( 0) 0)
|
| [17] |
Restitutti F, Laitinen MR, Raekallio MR, et al. Effect of MK-467 on organ blood flow parameters detected by contrast-enhanced ultrasound in dogs treated with dexmedetomidine[J].
Vet Anaesth Analg,2013, 40 (6) : e48-56.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
