肾细胞癌(RCC)占肾肿瘤的80%~90%,成人恶性肿瘤的3%[1]。随着现代腹部影像技术的发展,肾脏肿瘤的早期检出率得到明显提高[2]。肾脏根治性切除术是肾肿瘤治疗的传统方法[3]。然而,多位研究者报道11%~23%怀疑为肾恶性肿瘤患者在术后病理学诊断为良性病灶[4-6]。根治性肾脏切除术存在潜在的过度治疗和肾功能损伤,因此催生了开腹和腹腔镜肾部分切除术的临床应用,提高了生存率且减少了肾损伤[7-8]。为进一步减少手术创伤、降低并发症的发生、提高患者生存率和生活质量,局部消融技术逐渐在临床上广泛应用,包括冷冻消融术和射频消融术[9]。虽然微波消融技术已被广泛应用于肝癌的治疗[10],但仅有少量报道描述其在治疗肾癌的临床研究,且样本量相对局限,随访时间相对较短[11-13]。微波消融治疗肿瘤的原理是在快速变化的电磁场作用下,达到高温50℃4~6 min和60℃即刻,组织中的水分子剧烈震动摩擦生热,使蛋白质变性、细胞膜破裂,导致细胞凝固坏死[14-15]。虽然射频消融被广泛应用于临床,但和射频消融相比,微波消融具有瘤内升温快,消融体积大,消融时间短,组织传导率和阻抗较低等优势[15-18]。本研究通过较大样本量、较长随访时间的研究,评估超声引导经皮水冷微波消融治疗小肾细胞癌的安全性及临床疗效。
1 对象和方法 1.1 研究对象从2006年4月~2015年10月在我科接受经皮微波消融治疗的140位肾癌患者,术前均签署了知情同意书。我科在微波治疗实体肿瘤领域具有丰富的临床经验,微波消融有较高的热效率,对血供丰富的肾肿瘤有良好的凝固能力[19],因此对所有入组患者首选进行微波消融治疗,并测量和记录每个病灶的基本资料,包括肿瘤最大直径、肿瘤数目、肿瘤病理类型、肿瘤生长模式、肿瘤位置如是否毗邻肠道、合并症、术前和术后1周的肌酐、尿素氮水平、消融变量(包括消融次数、时间、功率)、并发症、肿瘤复发或转移的时间、位置,最后的随访时间和状态及死亡原因。
1.2 术前评估所有病灶均在微波消融前要经超声引导肾脏病灶穿刺活检进行病理学诊断。入组标准:肾肿瘤最大直径≤4 cm[20-22];无肾静脉血栓或肾外转移;凝血酶原时间< 25 s;凝血酶原活动度>40%;血小板计数>40×109/L;双肾肾肿瘤、孤立肾肿瘤、对侧肾的肾功能有中度或重度损坏;复发肾肿瘤、因手术后粘连而无法行外科切除术;无手术适应症;患者不愿或拒绝手术且在超声引导下有合适的进针途径。
微波消融术前,经过超声造影和计算机断层扫描(CT)或磁共振成像(MRI)来评估肿瘤结节数和门静脉血栓情况。在超声造影引导下测量出肿瘤最大径。通过临床检查、胸片、腹部超声及CT或MRI来判断是否有肾外转移。
1.3 肾肿瘤的生长模式肾肿瘤的生长模式分为3个类型:外凸型、实质型和内生型。外凸型肾肿瘤生长在肾脏的外轮廓上,无组织成分扩展至肾静脉窦;实质型肾肿瘤生长在肾脏实质内,无组织凸出肾轮廓,也无组织扩展至肾静脉窦;内生型肾肿瘤已延伸至肾静脉窦,靠近肾集合系统或输尿管。
根据肿瘤生长位置和肠道的关系,将肿瘤位置分为不毗邻肠道和毗邻肠道(在CT或MRI和超声图像上,肿瘤位置和肠道的距离小于5 mm,在超声引导微波消融过程中,因肠道蠕动和患者体位变化的关系,此距离可能会改变)。
1.4 超声引导微波消融微波消融设备输出功率为2450 MHz的微波消融仪(KY-2000,南京康友公司),消融针直径1.9 mm(15G)长18 cm。针内置有双通道,通过蠕动泵使蒸馏水在其内循环流动。用1%的利多卡因进行局麻,然后在超声引导下用带有18G针头的自动活检枪进行组织活检穿刺,一般会取2~3条组织。随后在超声引导下将微波消融针经皮进入肿瘤内部预定位置。小于2 cm的肿瘤放置1根微波针,2 cm或者更大的肿瘤,要放置2根针,两根针的距离不能超过1.8 cm。微波消融输出功率50 W作用5~10 min,如果消融范围没有涵盖整个肿瘤,则要适当延长微波消融作用的时间。
待消融针进入肿瘤预定位置后,用异丙酚(利康药业,美国威明顿)和克他命(双鹤药业,中国北京)联合进行静脉麻醉,消融期间要进行血液动力学监测。退微波针时要停止水循环,保证有足够的热量灼烧针道内残留肿瘤组织,以防止针道种植。
1.5 微波消融过程中的温度监测微波消融设备同时具备温度监测系统,可以实时监测微波消融过程中的温度变化。对于位置安全的肿瘤,如果距离肿瘤边缘5~10 mm的温度达到60℃或者超过54℃持续3 min,即认为肿瘤完全坏死。
对于高风险部位的肿瘤,要实时监测肿瘤边缘的温度、肾脏毗邻的集合系统和肠道周围的温度。对于无开腹手术史的患者,安全温度设定为54℃,有开腹手术史的患者设定温度为50℃。消融过程进行断续消融,当温度达到设置的安全温度,停止消融,待温度降低至45℃,启动微波消融治疗。
1.6 随访及统计分析患者消融术后1~3 d行增强影像检查评估治疗效果,术后1,3,6月及之后每6个月行超声造影和增强CT/ MRI随访检查,观察肿瘤有无复发或转移。利用Cox风险模型对所有的风险因素进行数据分析,总生存率、无病生存率、局部进展率用Kaplan-Meier法进行分析。各患者的局部进展率偏差用时序检验,连续变量比较用t检验、秩和配对检验、方差分析。SNK-q(多种统计方法的多重比较)、秩和符号检验和Fisher精准检验用于比较子集之间的分类变量。所有的数据使用程序SPSS 18.0进行统计分析。P < 0.05认为差异有统计学意义。
2 结果 2.1 微波消融结果表 1示从2006年4月~2015年10月经超声引导下微波消融治疗140例肾癌患者(男性102,女性38,年龄范围21~87岁,平均年龄64.5岁)共151个肾肿瘤(大小范围:0.6~4.0 cm;均值2.8±0.8 cm),其中129例患者有1个病灶,11例患者有2个病灶。所有的151个病灶中,有46个(30.5%)紧邻肠道或肾盂(肿瘤边缘与肠道或肾盂的距离至少5 mm)。患者术前均通过超声引导下穿刺活检确定了肿瘤病理类型:肾透明细胞癌130例,肾乳头状细胞癌5例,肾嗜酸细胞癌4例,肾囊性细胞癌1例。140例患者总共完成167次(1.1±0.3,1~2次)微波消融治疗。135个结节1次微波消融便治疗成功,16个结节治疗了2次。消融时间为3.5~18 min(8.2±3.4 min)。随访平均时间36.4月(范围2~115.8月)。
| 表 1 患者和肿瘤的临床特征 Table 1 Clinical data of the patients with renal cell carcinoma |
在随访过程中,140例患者中有16例死亡,其中8例死于非肾细胞癌(分别是1例胃出血、1例脑溢血、1例心力衰竭、1例肺气肿、1例肝衰、1例高血压、1例肝硬化和1例冠心病)和8例死于肾细胞癌恶化。1、3、5年总生存率分别为98.4%、94.8%、89.5%,1、3、5年无病生存率分别为98.4%、93.0%,83.1%。
经167次微波消融治疗后有5例(3.6%,5/140)出现了主要的并发症,包括1例由于肝功能障碍引起的肝性脑病,1例糖尿病并高危肿瘤紧邻肾脏集合系统引起的尿瘘,1例肿瘤紧邻结肠引起肠瘘,1例动静脉瘘,1例需引流的胸腔积液。肝性脑病的患者经静脉保肝药物治疗1周后治愈,尿道瘘的患者经静脉抗感染和抗糖尿病治疗10 d后治愈,肠穿孔的患者经肠造瘘术和静脉抗感染治疗后40 d治愈,动静脉瘘的患者在瘘管处经超声引导皮下注射0.15 mL凝血酶溶液,于3 d后出院,胸腔积液患者经超声引导下穿刺抽液250 mL后2 d出院。由肾周水肿引起其他较小的并发症可经药物治疗控制,微波消融对患者的血清尿素氮和肌酐水平没有明显的影响。对于肾功能不全的患者在消融前经充分的透析后病情不会出现恶化。
2.2 肿瘤大小和位置的影响表 2比较的是肿瘤特点和治疗效果。内生型肿瘤的消融次数比外生型和实质型的多(P=0.02)。外凸型、实质型和内生型肿瘤的技术有效率皆为100%(68/68、72/72、15/15),并无统计学意义(P=1.00)。
| 表 2 肿瘤的特征和微波消融疗效 Table 2 Tumor characteristics and efficacy of microwave ablation |
肿瘤临近肠道(均值2.7 cm,范围0.9~4.0 cm)和肿瘤不临近肠道(均值3.1 cm,范围在1.2~4.0 cm)的技术有效率皆为100%(46/46、105/105)。
2.3 单因素和多因素分析单因素分析(表 3)显示无病生存率与肿瘤数量相关(P=0.05),有统计学意义;与年龄、消融时间、病理类型等无关,无统计学差异。
| 表 3 患者无病生存的单因素分析 Table 3 Univariate analysis of prognostic factors for disease-free survival |
多因素分析显示无病生存率与肿瘤数量(P=0.015,表 4)、肿瘤生长模式(P=0.049)相关。多发结节和内生型肿瘤的患者复发率相对高,需要相对长的消融时间。
| 表 4 患者预后Cox风险多因素分析 Table 4 Multivariate analysis of prognostic factors with Cox proportional hazards model |
目前射频和冷冻消融是治疗肾肿瘤最常使用的消融方法,和射频消融相比,微波消融可形成更大的消融范围和更高的瘤内温度,传输受组织电阻率和炭化的影响小,更有助于肾肿瘤尤其是血供丰富的肾肿瘤治疗[17]。本组所有患者经微波消融后,皆取得技术有效,在平均36.4月的随访期内,患者5年整体生存率和无病生存率分别为89.5%、83.1%,并发症发生率3.6%,无严重并发症发生,说明微波消融局限性肾肿瘤安全、有效。
国内外报道,经皮射频消融小于4 cm的肾肿瘤,患者技术有效率91%~97%,局部进展率0%~23%,生存率97.6%~99%[19, 23-24]。文献报道冷冻消融小肾细胞癌可以达到96.9%~100%的技术有效率,局部进展率1.3%~5.2%,生存率94.1%~100%[25-28]。关于微波消融小肾癌,目前报道十分有限,大多为小样本量、短期随访的报道,Yu等[11]关于微波消融治疗98例肾肿瘤的研究是目前已报道的微波消融最大样本量的研究,其报道技术有效率100%,局部复发率为1.0%,5年生存率和无病生存率分别为82.6%,97%,术后并发症1.7%;Guan等[29]报道微波消融治疗48例肾肿瘤,3年无病生存率90.4%,术后并发症12.5%;但Castle等[13]报道微波消融治疗平均大小3.65 cm的肾细胞癌的效果令人失望,在18个月的随访中肿瘤的局部进展率为38%(3/8),术中并发症比率为20%(2/10),术后并发症比率为40%(4/10),他在研究中使用3.7 cm频率915 MHz的外科微波消融针,50%的肿瘤邻近肾盂。而本研究使用5 mm或者11 mm频率2450 MHz冷循环微波消融针,45例(32.1%)的肿瘤临近肠或肾盂。与既往报道相比,本组研究对于治疗小肾细胞癌取得了可比的疗效,但本组研究是截止目前报道的样本量最大、随访时间最长的微波消融治疗小肾细胞癌的研究。
本组研究中邻近肠道或肾盂的肿瘤45例(32.1%),消融过程中在瘤周5~10 mm处放置测温针,实时监测消融温度且使用断续式热消融方式,对于无开腹手术史的患者,安全温度设定为54℃,有开腹手术史的患者设定温度为50℃,以避免热损伤导致肠粘连。随访期内无局部进展,2例出现远处转移,此组高危部位肾细胞癌治疗效果满意。外凸型和实质型肿瘤的周围被无血管的脂肪包绕,而相对的血管床就像散热器一样包绕着内生型肿瘤,会降低消融温度和缩小消融范围。因此,高危部位的肿瘤患者需要微波消融联合其他的治疗方法,如放疗、动脉栓塞、化疗、输尿管注水冲洗、人工腹腔液体灌注分离肿瘤周边肠管等,以确保安全有效的治疗。
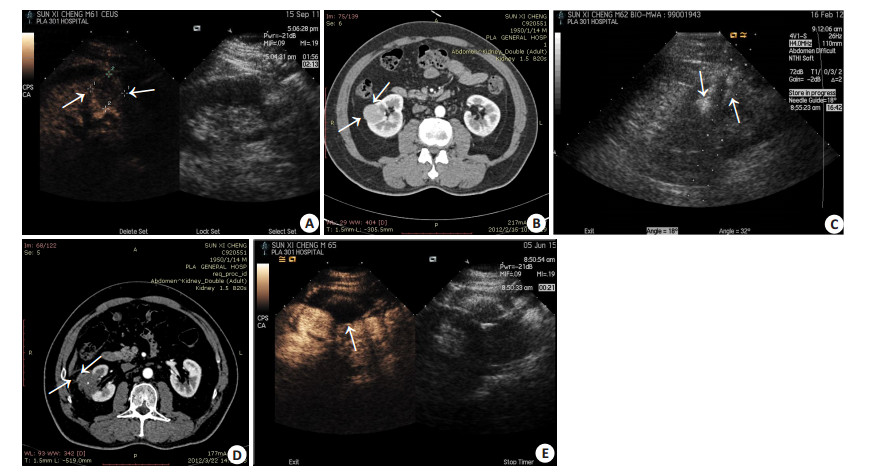
|
图 1 62岁男性右侧肾脏透明细胞癌患者,行微波消融治疗前后影像图像 Figure 1 Images of right renal clear cell carcinoma before and after microwave ablation in a 62-year-old male patient. A: Contrast-enhanced ultrasound scan showed a hypoenhancement lesion (3.0 cm×3.0 cm) before ablation; B: Contrast-enhanced computed tomography (CT) image showed a uniform density lesion before ablation with unclear border and rich blood supply; C: Two MW antennas (arrow) inserted into the tumor during ablation; D: Contrast-enhanced CT scan showed a non-enhancement ablation zone one month after ablation, indicating complete necrosis of the tumor; E: Contrast-enhanced ultrasound scan showed a non-enhancement ablation zone that completely covered the tumor 3 years after ablation. |
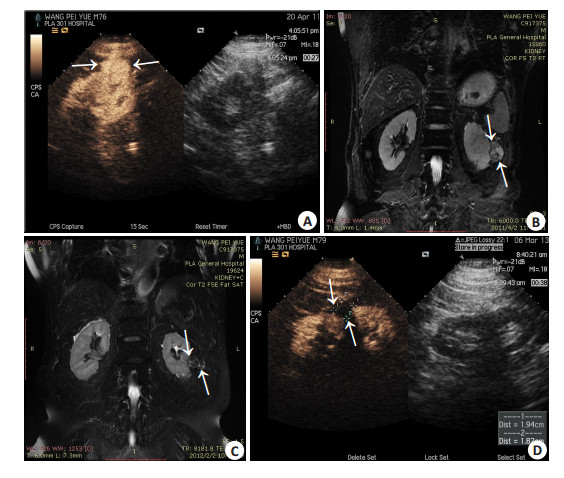
|
图 2 76岁男性左侧肾脏透明细胞癌患者,行微波消融治疗前后影像图像 Figure 2 Images of right renal clear cell carcinoma in a 76-year-old male patient before and after microwave ablation. A: Contrast-enhanced ultrasound scan showed a hypoenhancement lesion (3.6 cm×2.9 cm) before ablation; B: Contrast-enhanced magnetic resonance imaging showed a hypo-enhancement lesion at T2 before ablation; C: Contrast-enhanced magnetic resonance imaging showed a slightly hypointense region 6 months after ablation, and the volume of the tumor was diminished; D: Contrast-enhanced ultrasound scan showed a non-enhancement ablation zone that completely covered the tumor 2 years after ablation. |
本研究取得如此好的疗效,总结以下5点经验:(1)微波消融术前结合MR/CT影像资料,超声精准定位,科学制定消融方案;(2)对于靠近肠道的肿瘤,从2013年开始,微波消融时结合人工腹水,有利分离肠管,此后无肠管损伤并发症发生;(3)对于靠近肾盂的肿瘤,在肿瘤边缘5~10 mm处放置测温针,保证肿瘤达到坏死温度又不损伤集合系统;(4)术后增强核磁、超声造影评估消融疗效,提高技术成功率,降低复发率;(5)微波有更高的热效率,在三维空间上有较高的肿瘤覆盖能力,提高技术成功率。
本研究也存在一定的局限性。首先,没有纳入大于4 cm的肿瘤,与重要器官(比如肠或输尿管)相邻的患者相对少,接下来的研究需要包括更大的肾细胞癌,并评估肿瘤在不利位置的治疗效果。其次,回顾性质的研究阻碍了统一途径的随访,这可能会影响对临床结果的评估。最后,需要多中心更长时间的随访周期来评估长期疗效。
总之,我们的研究结果显示超声引导下经皮水冷微波消融治疗肾细胞癌肿瘤坏死彻底,患者长期生存效果好,严重并发症发生率低,对肾细胞癌患者是一种安全有效的治疗方法,且可保存肾功能,为丧失手术机会和单肾、肾功不全患者提供了治疗新希望。
| [1] |
Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2007[J].
CA Cancer J Clin,2007, 57 (1) : 43-66.
DOI: 10.3322/canjclin.57.1.43. ( 0) 0)
|
| [2] |
Boring CC, Squires TS, Tong T, et al. Cancer statistics, 1994[J].
CA Cancer J Clin,1994, 44 (1) : 7-26.
DOI: 10.3322/canjclin.44.1.7. ( 0) 0)
|
| [3] |
Permpongkosol S, Chan DY, Link RE, et al. Laparoscopic radical nephrectomy: long-term outcomes[J].
J Endourol,2005, 19 (6) : 628-33.
DOI: 10.1089/end.2005.19.628. ( 0) 0)
|
| [4] |
McKiernan J, Yossepowitch O, Kattan MW, et al. Partial nephrectomy for renal cortical tumors: pathologic fndings and impact on outcome[J].
Urology,2002, 60 (6) : 1003-9.
DOI: 10.1016/S0090-4295(02)01967-2. ( 0) 0)
|
| [5] |
Fuji Y, Komai Y, Saito K, et al. Incidence of benign pathologic lesions at partial nephrectomy for presumed RCC renal masses: Japanese dual-center experience with 176 consecutive patients[J].
Urology,2008, 72 (3) : 598-602.
DOI: 10.1016/j.urology.2008.04.054. ( 0) 0)
|
| [6] |
Kutikov A, Fossett LK, Ramchandani P, et al. Incidence of benign pathologic fndings at partial nephrectomy for solitary renal mass presumed to be renal cell carcinoma on preoperative imaging[J].
Urology,2006, 68 (4) : 737-40.
DOI: 10.1016/j.urology.2006.04.011. ( 0) 0)
|
| [7] |
Novick AC. Laparoscopic and partial nephrectomy[J].
Clin Cancer Res,2004, 10 (18 Pt 2) : S6322-7.
( 0) 0)
|
| [8] |
Uzzo RG, Novick AC. Nephron sparing surgery for renal tumors: indications, techniques and outcomes[J].
J Urol,2001, 166 (1) : 6-18.
DOI: 10.1016/S0022-5347(05)66066-1. ( 0) 0)
|
| [9] |
Hui GC, Tuncali K, Tatli S, et al. Comparison of percutaneous and surgical approaches to renal tumor ablation: metaanalysis of effectiveness and complication rates[J].
J Vasc Interv Radiol,2008, 19 (9) : 1311-20.
DOI: 10.1016/j.jvir.2008.05.014. ( 0) 0)
|
| [10] |
Liang P, Dong B, Yu X, et al. Prognostic factors for survival in patients with hepatocellular carcinoma after percutaneous microwave ablation[J].
Radiology,2005, 235 (1) : 299-307.
DOI: 10.1148/radiol.2351031944. ( 0) 0)
|
| [11] |
Yu J, Zhang G, Liang P, et al. Midterm results of percutaneous microwave ablation under ultrasound guidance versus retroperitoneal laparoscopic radial nephrectomy for small renal cell carcinoma[J].
Abdom Imaging,2015, 40 (8) : 3248-56.
DOI: 10.1007/s00261-015-0500-2. ( 0) 0)
|
| [12] |
Carrafello G, Mangini M, Fontana F, et al. Single-antenna microwave ablation under contrast-enhanced ultrasound guidance for treatment of small renal cell carcinoma: preliminary experience[J].
Cardiovasc Intervent Radiol,2010, 33 (2) : 367-74.
DOI: 10.1007/s00270-009-9745-x. ( 0) 0)
|
| [13] |
Castle SM, Salas N, Leveillee RJ. Initial experience using microwave ablation therapy for renal tumor treatment: 18-month follow-up[J].
Urology,2011, 77 (4) : 792-7.
DOI: 10.1016/j.urology.2010.12.028. ( 0) 0)
|
| [14] |
Goldberg SN, Gazelle GS, Mueller PR. Thermal ablation therapy for focal malignancy: a unifed approach to underlying principles, techniques, and diagnostic imaging guidance[J].
AJR Am J Roentgenol,2000, 174 (2) : 323-31.
DOI: 10.2214/ajr.174.2.1740323. ( 0) 0)
|
| [15] |
Brace CL. Radiofrequency and microwave ablation of the liver, lung, kidney, and bone: what are the differences[J].
Curr Probl Diagn Radiol,2009, 38 (3) : 135-43.
DOI: 10.1067/j.cpradiol.2007.10.001. ( 0) 0)
|
| [16] |
Simon CJ, Dupuy DE, Mayo-Smith WW. Microwave ablation: principles and applications[J].
Radio Graphics,2005, 25 (Suppl 1) : S69-83.
( 0) 0)
|
| [17] |
Wright AS, Sampson LA, Warner TF, et al. Radiofrequency versus microwave ablation in a hepatic porcine model[J].
Radiology,2005, 236 (1) : 132-9.
DOI: 10.1148/radiol.2361031249. ( 0) 0)
|
| [18] |
Yu J, Liang P, Yu X, et al. A comparison of microwave ablation and bipolar radiofrequency ablation both with an internally cooled probe: results in ex vivo and in vivo porcine livers[J].
Eur J Radiol,2011, 79 (1) : 124-30.
DOI: 10.1016/j.ejrad.2009.12.009. ( 0) 0)
|
| [19] |
Tracy CR, Raman JD, Donnally C, et al. Durable oncologic outcomes after radiofrequency ablation: experience from treating 243 small renal masses over 7.5 years[J].
Cancer,2010, 116 (13) : 3135-42.
DOI: 10.1002/cncr.v116:13. ( 0) 0)
|
| [20] |
Sugimoto K, Shimizu N, Nose K, et al. Clinical outcome of small renal cell carcinoma after delayed surgery versus immediate surgery[J].
JCancer,2013, 19, 4 (6) : 514-8.
( 0) 0)
|
| [21] |
Ali AM, Rajagoppal P, Sayed A, et al. Transplant of kidneys with small renal cell carcinoma in incompatible, heavily immuno-suppressed recipients[J].
Ann R Coll Surg Engl,2012, 94 (6) : e189-90.
DOI: 10.1308/003588412X13373405384738. ( 0) 0)
|
| [22] |
Pahernik S1, Huber J, Pfitzenmaier J, et al. Small renal cell carcinoma: oncological outcome with tumour size[J].
Scand J Urol Nephrol,2011, 45 (6) : 432-5.
DOI: 10.3109/00365599.2011.621143. ( 0) 0)
|
| [23] |
Lyrdal D, Andersson M, Hellstrom M, et al. Ultrasound-guided percutaneous radiofrequency ablation of small renal tumors: clinical results and radiological evolution during follow-up[J].
Acta Radiol,2010, 51 (7) : 808-18.
DOI: 10.3109/02841851.2010.489054. ( 0) 0)
|
| [24] |
Zagoria RJ, Pettus JA, Rogers M, et al. Long-term outcomes after percutaneous radiofrequency ablation for renal cell carcinoma[J].
Urology,2011, 77 (6) : 1393-7.
DOI: 10.1016/j.urology.2010.12.077. ( 0) 0)
|
| [25] |
Mues AC, Okhunov Z, Haramis G, et al. Comparison of percutaneous and laparoscopic renal cryoablation for small (3.0 cm) renal masses[J].
J Endourol,2010, 27 (7) : 1097-100.
( 0) 0)
|
| [26] |
Rodriguez R, Cizman Z, Hong K, et al. Prospective analysis of the safety and efficacy of percutaneous cryoablation for pT1NxMx biopsy-proven renal cell carcinoma[J].
Cardiovasc Intervent Radiol,2011, 34 (3) : 573-8.
DOI: 10.1007/s00270-010-9934-7. ( 0) 0)
|
| [27] |
Kunkle DA, Uzzo RG. Cryoablation or radiofrequency ablation of the small renal mass: a meta-analysis[J].
Cancer,2008, 113 (10) : 2671-80.
DOI: 10.1002/cncr.v113:10. ( 0) 0)
|
| [28] |
Chalasani V, Martinez CH, Lim D, et al. Surgical cryoablation as an option for small renal masses in patients who are not ideal partial nephrectomy candidates: intermediate-term outcomes[J].
Can Urol Assoc J,2010, 4 (6) : 399-402.
( 0) 0)
|
| [29] |
Guan W, Bai J, Liu JH, et al. Microwave ablation versus partial nephrectomy for small renal tumors: intermediate-term results[J].
J Surg Oncol,2012, 106 : 316-21.
DOI: 10.1002/jso.v106.3. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
