2. 广州军区广州总医院心内科, 广东 广州 510010
2. Department of Cardiology, Guangzhou General Hospital of Guangzhou Command, Guangzhou 510010, China
钙化性主动脉瓣膜病(CAVD)是一种随龄而增加的以瓣膜内大量钙质沉积为特征的老年人常见的心脏瓣膜病变。随着人类寿命的延长,老年人此病的发生率日益增加,并随着风湿性心脏病发病率的降低,该疾病已经成为老年人瓣膜置换的首要病因[1]。瓣膜间质细胞是瓣膜基质胶原的主要来源,在维持瓣膜的正常结构、新陈代谢和生物学功能等方面发挥重要作用[2]。CAVD的发病机制的学说目前主要有以下四种[3]:钙化及骨化学说、细胞外基质重塑学说、新生血管学说、慢性炎症学说;瓣膜间质细胞在CAVD各种发病机制中均被活化,出现异常增殖、分化,说明其在CAVD发生发展过程中具有重要作用。Clavel等[4]早前通过钙化的瓣膜做组织学分析时的研究证实,瓣膜间质细胞增殖异常,胶原纤维发生增生,弹性纤维产生断裂与分层。这一研究结果提示我们,抑制瓣膜间质细胞的异常增殖,将成为治疗CAVD新切入点。
mTOR是细胞生长的中枢控制因子,在调节细胞生长与增殖方面起着关键作用且与细胞周期密切相关[5]。既往研究提示CAVD的进展涉及一个积极的生物过程,而促进这种发展的分子机制与动脉粥样硬化相似,目前已有研究证实雷帕霉素具有抗动脉粥样硬化的作用[6],而其在钙化性主动脉瓣膜病的研究中鲜有报道;本课题组前期实验证实雷帕霉素通过抑制相关成骨蛋白活性从而抑制瓣膜间质细胞的钙化[7];本实验旨在观察雷帕霉素是否能够抑制瓣膜间质细胞增殖的活性,为进一步研究雷帕霉素在钙化性主动脉瓣膜病的研究提供理论基础。现将本实验报道如下。
1 材料和方法 1.1 试剂雷帕霉素(RAPA)购自美国sigma;WB抗体来源为S6、P70、P-S6、P-P70和GAPDH购自美国cell signaling;Guava细胞周期检测试剂盒由美国Millipore生产;BCA蛋白浓度检测试剂盒购自南京凯基;PrimeScriptTM PT reagent kit、SYBR® PrimeScriptTM miRNA RT-PCR试剂盒、One Step SYBR® PrimeScript® RT-PCR试剂盒Ⅱ购自日本TAKARA。
1.2 细胞分离培养及鉴定采用胶原酶消化法[8]改良后进行体外分离大鼠瓣膜间质细胞并传代培养。大鼠经手术解剖后,快速取下大鼠主动脉根部及心脏部分,并以预冷的PBS溶液冲洗表面残余血块。将瓣叶浸泡于2 mg/mL的Ⅱ型胶原酶液中,在37 ℃恒温箱内培养40 min,取出后在超净工作台上以无菌棉签拭擦瓣膜的表面,小心轻轻刮下瓣膜表面的内皮层细胞。完成后将主动脉瓣叶小心剪成3 mm×3 mm大小片状,第2次以2 mg/mL的Ⅱ型胶原酶液浸泡,在37 ℃恒温箱内培养2 h后取出,过滤去除瓣膜残渣,重悬后将细胞混合液移入培养瓶中进行常规培养,每培养两天给细胞换液。期间每日通过倒置显微镜观察记录细胞生长状况,待细胞生长铺满培养瓶底约80%时开始传代培养。用免疫荧光化学法检测α-平滑肌肌动蛋白(α-Smooth Muscle Actin, α-SMA)、波形蛋白、血管性血友病因子(vWF)的表达,进行细胞鉴定。
1.3 细胞增殖测定观察细胞生长状态良好,细胞融合度达到85%,做MTT实验。将6孔板中的细胞分为两组,加药组和正常对照组,对照组细胞以正常培养基培养,不作任何处理;雷帕霉素组在正常培养基中加入100 nmol/L的雷帕霉素[9]。种板、呈色后,用酶标仪测定在450 nm处的吸光度,连续7 d。
1.4 细胞周期流式检测将细胞分加药组和正常对照组两组培养,加药培养24 h后取出6孔板,消化洗涤细胞,移入流式管,800 r/min离心5 min,弃上清,加入PBS重悬,800 r/min离心5 min,弃上清,尽量将水吸干,加入1 mL Reagent A液重悬细胞和10 μL Reagent B液,混匀后上机。
1.5 RT-PCR检测mTOR下游靶蛋白S6、P70S6K mRNA表达水平从NCBI网站中检索出大鼠S6、P70S6K与内参GAPDH基因序列,根据生物信息学的分析得出基因序列,设计大鼠S6、P70S6K与内参GAPDH基因Real time PCR检测的引物,见表 1。Trizol法进行总RNA的提取;以2 μg总RNA为反应模板,按照TAKARA逆转录说明书配制逆转录反应体系,总体系为20 μL,合成cDNA的第1链。根据Real-Time PCR试剂盒里的反应体系,加入cDNA、dNTP、引物、缓冲液、酶等,用qPCR仪进行荧光定量PCR检测。
| 表 1 检测基因的引物序列 Table 1 Primer sequences used for RT-PCR |
检测培养细胞中S6、P70、P-S6、P-P70蛋白的表达水平。按照说明书操作进行总蛋白定量。SDS-PAGE电泳后PVDF膜转膜和孵育抗体,5%脱脂奶粉-TBS封闭,一抗1:1500,室温,反应2 h。TBS洗涤PVDF膜5 min×5次,二抗1:5000,室温,反应1 h TBS洗5 min×5次,化学发光,显影,定影。
1.7 统计学方法所有计量数据用均数±标准差表示。统计学方法采用两独立样本t检验。所有统计学均采用SPSS 17.0处理。P < 0.05认为具有统计学差异。
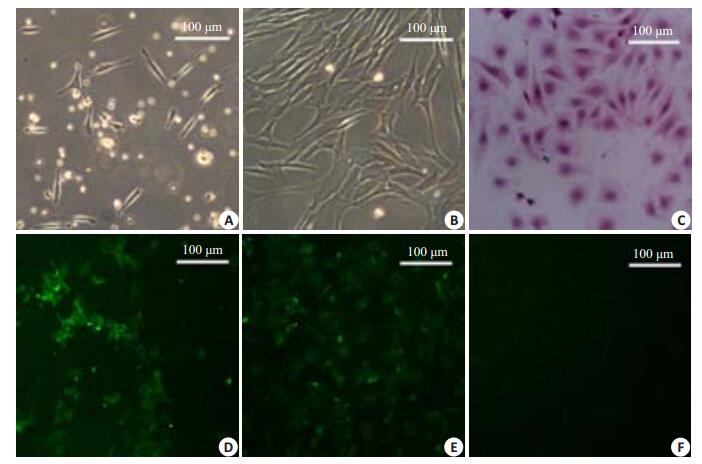
2 结果 2.1 细胞分离及鉴定从动物体(大鼠)中提取主动脉瓣膜组织块原代培养后进行传代,并鉴定所传代细胞是否为目的细胞。瓣膜间质细胞经原代培养1 d后,细胞出现贴壁现象(图 1A);细胞初始形态呈现长梭形,经培养7 d后,细胞开始变圆,且相互重叠呈现铺路石样形状(图 1B),此时经HE染色可见细胞结构完整,状态良好(图 1C)。细胞经免疫荧光检测表明:分离培养的大鼠瓣膜间质细胞中α-SMA(图 1D)、vimentin(图 1E)均为阳性表达,证明分离培养的细胞为主动脉瓣膜间质细胞。
|
图 1 大鼠瓣膜间质细胞 Figure 1 Isolation and identification of rat aortic valvular interstitial cells. A and B: Rat valvular interstitial cells on day 1 and day 7 in primary culture, respectively; C: HE staining; D: α-smooth muscle actin (α-SMA) staining; E: Vimentin staining; F: Human Von Willebrand factor (vWF) staining. |
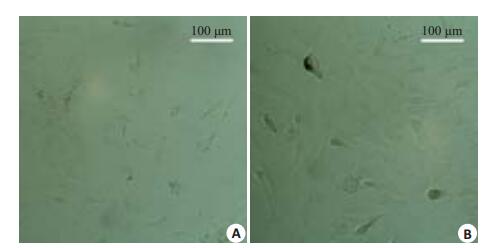
见图 2,经雷帕霉素诱导后的细胞,其生长形态与对照组较为相似,呈长梭形且界限较为清楚,但细胞密度不及对照组高。
|
图 2 主动脉瓣间质细胞 Figure 2 Rapamycin-treated (A) and control (B) rat aortic valvular interstitial cells. |
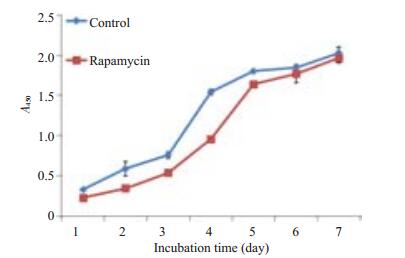
MTT测定细胞生长曲线探讨雷帕霉素对细胞活性的影响。由图 3可见,在加药1、2、3、4、5 d后,正常组细胞活性显著高于给药组细胞(P=0.001,P=0.012,P=0.001,P < 0.001,P=0.001),细胞生长变缓。而在第5天后,给药组细胞活性逐渐接近正常组细胞活性,至第6天时,两组细胞活性相当。
|
图 3 原代大鼠瓣膜间质细胞生长曲线 Figure 3 Growth curves of rapamycin-treated and control aortic valvular interstitial cells in vitro (Mean±SD). |
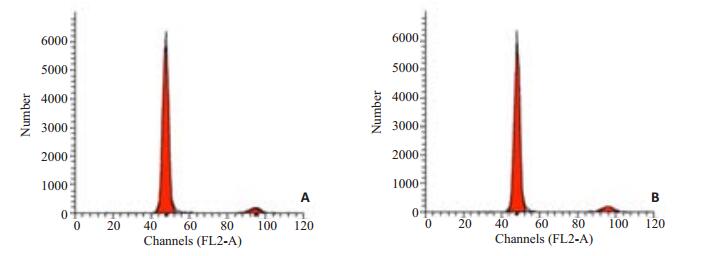
通过流式细胞术检测细胞周期的变化验证雷帕霉素引起细胞增殖减缓是否与细胞周期的改变而引起的。从图 4中可知,加药组和正常对照组细胞的各周期占比均没有明显差别,说明mTOR抑制剂雷帕霉素没有影响细胞周期来使细胞活性降低。
|
图 4 大鼠心瓣膜间质细胞周期分型 Figure 4 Cell cycle analysis of rapamycin-treated (A) and control (B) aortic valvular interstitial cells. |
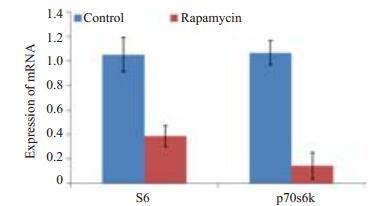
见图 5,Real-Time PCR检测表明,间质细胞加药组中mTOR下游靶蛋白S6(t=6.975,P=0.002)和P70S6K(t=10.773,P < 0.001)的mRNA表达较对照组均显著下降,两组结果有统计学差异。
|
图 5 mTOR下游靶蛋白S6和P70S6K mRNA表达情况 Figure 5 Relative expression of S6 and P70S6K mRNA in rapamycin-treated and control aortic valvular interstitial cells. P < 0.01 vs control. |
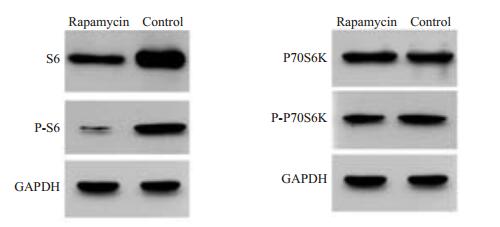
WB检测mTOR下游靶蛋白S6和P70磷酸化水平的变化发现:以对照组P-S6与总S6(total-S6)相对表达量的比值为1,实验组的相对表达量如下(图 6,表 2),同样以对照组P-P70S6K与总P70S6K(total-P70S6K)相对表达量的比值为1,实验组的相对表达量如下(图 6,表 2),经统计学分析,加药组与对照组对比能抑制细胞中P-S6(t=16.100,P < 0.05)和P-P70S6K(t=4.019,P < 0.05)的表达。说明雷帕霉素减缓细胞增殖不是通过改变细胞周期而引起的,而是通过抑制mTOR后下调其靶蛋白S6和P70S6K的磷酸化水平引起细胞增殖减缓。
|
图 6 mTOR下游靶分子S6、P70S6K表达及磷酸化水平表达情况 Figure 6 Relative expression of S6, P70S6K and phosphorylation in rapamycin-treated and control aortic valvular interstitial cells. |
| 表 2 各组P-S6、P-P70S6K相对表达量(P-S6/总-S6,P-P70S6K/总-P70S6K) Table 2 Expression of P-S6 and P-P70S6K in each group(P-S6/ total-S6, P-P70S6K/total-P70S6K)(Mean±SD, n=3) |
既往普遍认为CAVD是被动的退行性钙磷沉积的过程,而现在研究者明确该过程是一种普遍存在且高度保守的细胞通路介导的主动性过程[10]。CAVD的一个主要病理特征是瓣叶的纤维性增生,主要是细胞增殖和细胞外基质重塑的过程。当处于异常血流动力学环境或者其他病理条件刺激下,间质细胞可能向增殖、粘连甚至钙化等表型转化,导致瓣膜结缔组织过度增生、粘连、钙化等病理改变以及瓣膜细胞营养失衡等,进而引起瓣膜狭窄等临床变现。这一现象在Fondard等[11]对钙化的瓣膜做组织学分析时证实,包括瓣膜间质细胞大量增殖,胶原纤维发生增生、融合、交联,弹性纤维断裂、分层。因此,抑制瓣膜间质细胞的增殖可能成为治疗退行性瓣膜疾病的新切入点。瓣膜间质细胞是组成高等动物主动脉瓣瓣叶的主要细胞,在维持心肌瓣膜正常的形态与生理功能上起着非常重要的作用[2]。血管平滑肌细胞与主动脉瓣膜间质细胞有许多相似之处,且血管平滑肌细胞取材难度远远低于主动脉瓣膜间质细胞,因而以往研究者多以血管平滑肌细胞代替主动脉瓣膜间质细胞作为研究CAVD的研究材料。但血管平滑肌细胞往往无法完全代替瓣膜间质细胞的某些功能[12]。因而体外分离培养瓣膜间质细胞的工作变得非常重要。本研究采用改良的胶原酶消化法从大鼠主动脉瓣中成功分离并培养瓣膜间质细胞,并通过免疫细胞荧光法检测证实为瓣膜间质细胞。
mTOR是真核细胞中一种高度保守的蛋白激酶[5],也是免疫抑制剂/抗癌药物雷帕霉素(RAPA)的靶物质,mTOR通过调节剂如p70S6K和4E-BP1影响基因转录及蛋白质合成从而调控细胞生长[5]。mTOR分子和不同蛋白质结合,可形成2种不同复合物,即mTORC1和mTORC2。这2种不同复合物均参与基因转录、蛋白质翻译、核糖体合成等生物过程[13],在机体的器官生长、组织形成以及肿瘤生长中起着重要的作用[5]。其中mTORCl对mTOR抑制剂雷帕霉素敏感,而mTORC2不敏感。p70S6K(核糖体40S小亚基S6蛋白激酶)是mTOR在细胞内的直接作用底物,p70S6K能整合氨基酸以及其他生长因子等所激活的信号通路,从而调节细胞的生长与分化[13]。研究表明,p70S6K活性受到mTOR、丝裂原活化蛋白激酶(MAPK)等多种信号途径的调控,p70S6K被激活后,能活化S6蛋白,而S6蛋白则可提高5’端含有末端寡聚嘧啶(TOP)等一类蛋白的mRNA翻译效率,而这种mRNA能编码多种蛋白翻译所需组分,例如核糖体蛋白以及polyA结合蛋白等,最终促进蛋白质的合成[14]。因此可以推测mTOR/p70S6K信号通路的激活,可能介导了细胞的生长与增殖。鉴于mTOR/p70S6K信号途径在细胞增殖、生长中起重要调控作用。本实验中,我们选用大鼠心瓣膜间质细胞为实验对象,采用mTOR信号通路抑制剂雷帕霉素处理细胞,检测S6、P-S6、p70S6K、P-p70S6K的表达,探讨mTOR/p70S6K信号转导通路的激活,对大鼠心瓣膜间质细胞增殖影响。结果表明,雷帕霉素能抑制瓣膜间质细胞的增殖,在加药1、2、3、4、5 d后,正常组细胞活性显著高于给药组细胞,给药组细胞生长变缓。
既往研究提示CAVD的进展涉及一个积极的生物过程,而促进这种发展的分子机制与动脉粥样硬化相似,目前已有研究证实雷帕霉素具有抗动脉粥样硬化的作用[6],而其在钙化性主动脉瓣膜病的研究中鲜有报道;我们早期的实验结果显示,在主动脉钙化狭窄瓣膜病患者的瓣膜组织中,mTOR下游底物S6磷酸化较正常瓣膜组织中明显升高,说明mTOR在CAVD瓣膜组织中异常活化。因此,我们推测mTOR信号通路活化参与CAVD的发生发展,其抑制剂雷帕霉素可能通过抑制瓣膜间质细胞分化从而阻断CAVD的发生发展。我们前期实验证实雷帕霉素能通过抑制相关成骨蛋白活性从而抑制瓣膜间质细胞的钙化[7]。以往的研究表明,mTOR抑制剂雷帕霉素可能通过抑制mTORC1活性(核糖体S6蛋白磷酸化)而不是抑制mTORC2活性,从而减缓主动脉瓣严重反流引起的左室心肌肥大[15]。在本实验中我们发现,mTOR抑制剂雷帕霉素通过抑制mTOR后下调其靶蛋白S6和P70S6K的磷酸化水平引起细胞增殖减缓,同时通过流式细胞术检测细胞周期的变化,证实雷帕霉素没有影响细胞周期来使细胞活性降低。因此,从本实验研究结果可以得出,通过雷帕霉素干预瓣膜间质细胞后,能抑制mTOR下游靶蛋白S6和P70S6K的磷酸化水平,引起瓣膜间质细胞增殖能力的下降,为雷帕霉素在CAVD体内的研究提供了理论基础。
| [1] |
Schulz O, Brala D, Bensch R, et al. Aortic valve replacement in asymptomatic and symptomatic patients with preserved left ventricular ejection fraction[J].
J Heart Valve Dis,2012, 21 (5) : 576-83.
( 0) 0)
|
| [2] |
Venardos N, Nadlonek NA, Zhan Q, et al. Aortic valve calcification is mediated by a differential response of aortic valve interstitial cells to inflammation[J].
J Surg Res,2014, 190 (1) : 1-8.
DOI: 10.1016/j.jss.2014.03.051. ( 0) 0)
|
| [3] |
Akat K, Borggrefe M, Kaden JJ. Aortic valve calcification:basic science to clinical practice[J].
Heart,2009, 95 (8) : 616-23.
( 0) 0)
|
| [4] |
Clavel MA, Messika-Zeitoun D, Pibarot P, et al. The complex Nature of discordant severe calcified aortic valve disease grading:new insights from combined Doppler echocardiographic and computed tomographic study[J].
J Am Coll Cardiol,2013, 62 (24) : 2329-38.
DOI: 10.1016/j.jacc.2013.08.1621. ( 0) 0)
|
| [5] |
Weber JD, Gutmann DH. Deconvoluting mTOR biology[J].
Cell Cycle,2012, 11 (2) : 236-48.
DOI: 10.4161/cc.11.2.19022. ( 0) 0)
|
| [6] |
Martinet W, De Loof H, De Meyer GR. mTOR inhibition:a promising strategy for stabilization of atherosclerotic plaques[J].
Atherosclerosis,2014, 233 (2) : 601-7.
DOI: 10.1016/j.atherosclerosis.2014.01.040. ( 0) 0)
|
| [7] |
谭焱, 王继业, 易仁亮, 等. 探讨雷帕霉素靶向抑制mTOR对大鼠心瓣膜细胞钙化的影响及其作用机制[J].
中国循环杂志,2015, 30 (9) : 900-3.
( 0) 0)
|
| [8] |
Katwa LC, Ratajska A, Cleutjens JP, et al. Angiotensin converting enzyme and kininase-Ⅱ-like activities in cultured valvular interstitial cells of the rat heart[J].
Cardiovasc Res,1995, 29 (1) : 57-64.
DOI: 10.1016/0008-6363(96)88547-6. ( 0) 0)
|
| [9] |
Jia CH, Li M, Liu J, et al. IKK-β mediates Hydrogen peroxide induced cell death through p85 S6K1[J].
Cell Death Differ,2013, 20 (2) : 248-58.
DOI: 10.1038/cdd.2012.115. ( 0) 0)
|
| [10] |
奚望, 李伟, 殷亮, 等. 钙化性主动脉瓣疾病发病机制及临床诊治研究进展[J].
第二军医大学学报,2015, 36 (3) : 309-14.
( 0) 0)
|
| [11] |
Fondard O, Detaint D, Iung B, et al. Extracellular matrix remodelling in human aortic valve disease:the role of matrix metalloproteinases and their tissue inhibitors[J].
Eur Heart J,2005, 26 (13) : 1333-41.
DOI: 10.1093/eurheartj/ehi248. ( 0) 0)
|
| [12] |
Ferdous Z, Jo H, Nerem RM. Differences in valvular and vascular cell responses to strain in osteogenic media[J].
Biomaterials,2011, 32 (11) : 2885-93.
DOI: 10.1016/j.biomaterials.2011.01.030. ( 0) 0)
|
| [13] |
Zhu J, Zheng C, Chen J, et al. Ghrelin protects human umbilical vein endothelial cells against high glucose-induced apoptosis via mTOR/P70S6K signaling pathway[J].
Peptides,2014, 52 (7) : 23-8.
( 0) 0)
|
| [14] |
Zhang L, Wang H, Zhu J, et al. FTY720 reduces migration and invasion of human glioblastoma cell lines via inhibiting the PI3K/AKT/mTOR/p70S6K signaling pathway[J].
Tumour Biol,2014, 35 (11) : 10707-14.
DOI: 10.1007/s13277-014-2386-y. ( 0) 0)
|
| [15] |
Drolet MC, Desbiens-Brassard V, Roussel E, et al. Blockade of the acute activation of mTOR complex 1 decreases hypertrophy development in rats with severe aortic valve regurgitation[J].
Springerplus,2015, 4 (9) : 435.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
