2. 解放军309医院胸外科, 北京 100091
2. Department of Thoracic Surgery, 309 Hospital of PLA, Beijing 100091, China
肺癌的发病率和死亡率正在逐年上升, 已成为我国因肿瘤死亡的首要原因[1]。目前,肺癌的首选治疗方式仍是手术切除。由于胸腔内支气管、血管等管道结构走形复杂,具有明显的个体差异,如对术中解剖结构判断不准,易引起大出血或重要脏器损伤,增加患者死亡风险。因此,利用CT或MRI等二维图像数据,应用三维重建软件建立肿瘤个体化的数字模型,于术前将肿瘤及毗邻结构以三维立体的形式“真实”地呈现出来,对于辅助手术很有必要。目前,三维重建技术已广泛应用于骨科[2]、肝胆外科[3-4]、神经外科[5]和普外科[6]等领域。曾经有学者对肺癌患者的三维重建进行研究[7-8],但重建方法以及步骤均较为复杂。迄今为止没有建立令人满意的精细的肺肿瘤的三维数字化模型供临床参考。我们将64排螺旋CT胸部扫描数据进行三维重建并应用到临床工作中,进行术前模拟演练,制定个体化的手术方案,取得了满意的效果,现报道如下。
1 资料和方法 1.1 研究对象在2015年5月~2015年8月因发现肺部结节或肿块入院的患者中,选取24例临床确诊为肺癌或疑似肺癌的手术患者作为研究对象,将患者随机分为实验组和对照组,每组各12例。其中实验组患者男性8例,女性4例,年龄36~72岁。对照组男性7例,女性5例,年龄41~71岁。两组患者性别、年龄无统计学意义(P> 0.05)。术前检查未发现远处转移。
1.2 方法 1.2.1 设备(1)GE 64层螺旋CT(美国通用电器公司);(2)Mimics 18.0医用图像与三维重建软件(比利时Materialise公司开发);(3)宏碁计算机Windows7操作系统(台湾宏碁股份有限公司开发)。
1.2.2 原始数据的采集患者取仰卧位,行64层螺旋CT胸部扫描。扫描范围:由胸廓入口处至膈肌水平进行连续扫描。扫描参数:管电压120 KV;有效管电流100~150 mAs;扫描层厚0.5 mm;螺距1.375:1。图像格式:数据以DICOM格式输出并存入移动硬盘。
1.2.3 图像分割将DICOM格式的CT原始数据直接导入到Mimics 18.0软件中,根据不同组织结构的特点选择不同的分割方法。(1)利用软件独有的“肺模块”进行气管支气管树、肺的图像分割。因肿瘤患者往往年龄较大,常伴有肺气肿、肺间质纤维化等疾病,致使肺裂划分往往不准确。以胸部CT图像上的叶间裂为基准对叶间裂曲面进行修改调整。如软件中的“肺模块”无法划分出左右双肺,我们可以通过阈值分割结合手工修改的方法先将左右双肺分割出来后,再行肺叶划分;(2)通过阈值分割的方法对骨骼、皮肤、肺血管进行图像分割,并使用3D编辑(Edit mask in 3D)工具分割出肿瘤的供血动脉分支;(3)应用阈值分割结合手工修改的半自动方法分割肿瘤图像。利用软件“Segmentation”模块里的“Profile line”工具,在CT图像中临近肿瘤区域处选择两点,形成一条两个横跨肿瘤中心的剖面线。调整阈值的上下限使肿瘤组织几乎全部被包含在分割区域内。利用“Crop mask”工具将肿瘤组织进一步局限在较小的区域内,再应用“Region Growing”工具消除噪音。最后结合多层编辑(Multiple slice edit)和3D编辑(Edit mask in 3D)工具将肿瘤完整分割出来,形成肿瘤的最终蒙板“Mask”。
1.2.4 三维数字模型构建对以上分割图像进行去噪、平滑、补洞、去除伪影等修饰,采用表面绘制的方法[9],经过三维计算工具(Calculate 3D)生成高质量的三维数字化模型。进一步借助软件的“手术模拟”(Simulation)工具对三维重建后的模型进行切割、分离等手术模拟操作。
1.3 统计学分析应用SPSS19.0软件进行统计分析,计量资料采用均数±标准差表示,均值的比较采用t检验,P < 0.05认为差异具有统计学意义。
2 结果 2.1 肺、肿瘤及相关结构的三维重建模型成功建立了包括胸部皮肤、骨骼、肺、肿瘤、气管支气管树、肺血管的三维数字化模型。模型图像形态逼真、几何相似性高、立体感强,真实地反应了肺癌的形态特点及其毗邻结构的空间关系。模型可编辑性强,可对模型进行任意移动、旋转、缩放、组合、自定义着色、阶梯化透明显示等操作,可从各个视角、全方位观察各组织结构。通过对肺脏作透明化处理,可清晰直视内部肿瘤及支气管系统和动静脉系统,从而更好的显示出肿瘤的空间位置关系。使用软件“Clipping”工具可以进行二维、三维图像的组合显示。将重建好的三维模型以STL文件格式输出或保存。我们以中央型肺癌(图 1)和周围型肺癌(图 2)为例进行效果展示。
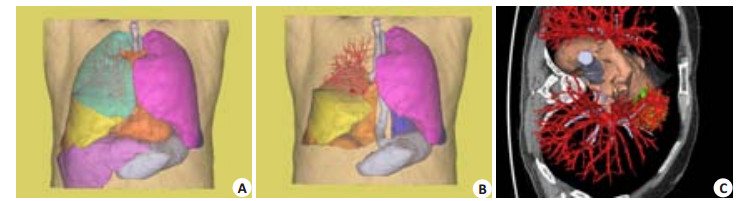
|
图 1 中央型肺癌模型 Figure 1 Central lung cancer model. A: Spatial relations of lung tumor (green) with the skin and pulmonary blood vessels; B: Adjacent relations of lung tumor (green) with the skin and pulmonary blood vessels (with the right upper lobe hidden); C: Relations of lung tumor (green) with the bronchia system and pulmonary blood vessels. |
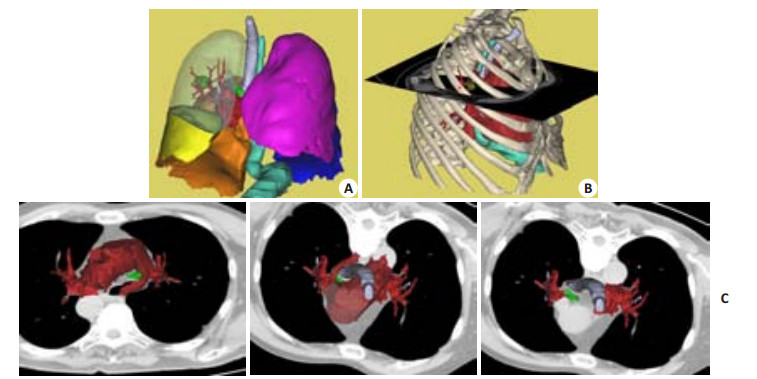
|
图 2 周围型肺癌模型 Figure 2 Peripheral lung cancer model. A: Spatial relations of lung tumor (green) with the pulmonary blood vessels; B: Combination of 2D and 3D display showing the location of the tumor (green) on the rib (red point); C: Relations of the mediastinal lymph node (green) with the bronchia system and pulmonary blood vessels. |
采用Mimics软件手术模拟“Simulation”工具进行术前演练操作。通过软件切割、分离、显隐等工具按可按照手术顺序进行术前模拟演练,效果逼真。通过手术模拟,所有患者均顺利行肿瘤切除,无围手术期死亡,无术后出血、感染等并发症。平均住院天数为14 d。我们以左下肺叶背段切除术(图 3)和右肺中叶切除术(图 4)为例进行术前预演展示。
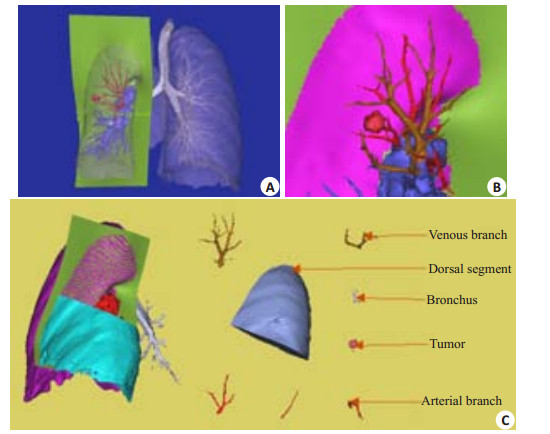
|
图 3 肺段切除术的术前演练 Figure 3 Preoperative exercise of pulmonary segment resection. A: Left lung lobes divided by oblique fissure surface. The tumor was located at the dorsal part of the lower lobe; B: Adjacent relations of the lung tumor with the feeding artery; C: Left lower lobe dorsal segment resection structures. |
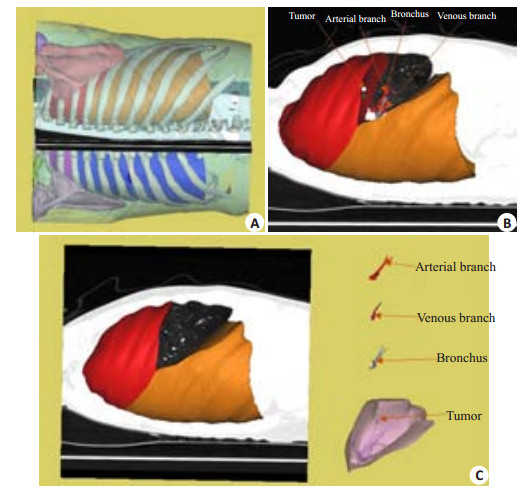
|
图 4 肺段切除术的术前演练 Figure 4 Preoperative virtual surgery of pulmonary lobectomy. A: Patient in operation position; B: Related anatomical structures displayed in the operation position; C: Right middle lobe resection structures. |
实验组手术时间优于对照组,差异有统计学意义(P < 0.05),两组患者的术中出血量以及术后住院时间差异无统计学意义(P>0.05,表 1)。
| 表 1 两组患者手术情况分析 Table 1 Surgical data analysis in the 2 groups |
自64排螺旋CT投入临床工作以来,其时间、空间分辨力较前极大提高,以其快速、大容量容积扫描等特点,实现了三维数据同时采集。本研究基于64排螺旋CT构建了肺癌的三维模型,与64排螺旋CT二维图像[8]相比,更加立体、真实而直观地再现了肺癌及相关解剖结构的形态特点和空间位置关系,为术前评估及术前规划提供多角度的显示方式,还利用软件模拟手术工具进行术前演练。
肿瘤图像分割是构建肺癌模型的关键,也是本研究的基础和前提。肺部肿瘤大小不一、密度不均,形态多不规则,与周围血管、脏器、胸膜等常有粘连或侵犯,而且肿瘤与周围软组织、血管等的边界模糊、灰度值较为接近,不宜采用区域增长等全自动分割方式,故肿瘤分割提取较为困难[10]。目前,肿瘤的分割方式主要有手动分割和半自动分割两种[11]。已有不少研究对于肺肿瘤进行全自动分割,但运算复杂,效果并不理想[7, 12]。手动分割是一种传统的分割方式,完全依靠操作者的医学影像学经验和软件操作技术,可重复性差,对一些肿瘤边缘模糊或极不规则的肿瘤来说便无能为力。本研究使用专业的医学三维重建软件Mimics 18.0版本,对肿瘤图像进行了半自动分割。为真实再现肿瘤的形态和结构,分割过程中尽量用“Flood fill”和“Live wire”等智能化的画图工具,具有自动追踪识别肿瘤的边界信息的功能,比完全手工操作更准确。使用多层编辑(Multiple slice edit)中的插值工具既省时、省力,又可保证肿瘤在层间的顺畅过渡,重建的肿瘤组织光滑、自然,不会出现不连续的阶梯感。对于体积微小或非实性病灶来说需要更高的软件功能和操作技术,目前本研究不能对其进行三维实体重建,只能对其进行空间定位,这也是本研究的局限之处。
在以往的研究中[13-14],由于均采用体绘制的方法对肺癌进行三维重建,对电脑硬件要求极高,只能在专用的医疗工作站上运行,重建的主要目的是用于临床诊断。另外,这些研究的重建图像不能进行自由编辑和输出,其后续应用受到限制。而本研究所建肺癌模型具有以下优势:(1)模型可编辑性强,显示方式多样化。模型可提供各种任意角度、切面、颜色、组合或透明程度的显示,能清晰显示肺癌结构形态及其空间毗邻关系,提供了二维断层影像所不能提供的信息。此外,利用二维、三维图像进行动态连续组合显示,可以获得更加立体、丰富的解剖信息;(2)能以肿瘤所在肺叶为单位进行模型构建。使肺癌模型构建更加合理,可用于实施术前预演以及制定个体化的手术方案;(3)基于个人电脑即可运行,而且能输出多种三维图形格式,用于后续的3D打印、计算机辅助设计等应用;(4)能在三维空间中进行各种长度、面积、体积、角度、密度等参数的精确测量。肿瘤的大小应该由其体积或三维空间内的直径表示,而三维空间测量的精准度要远高于二维平面或手工测量。肿瘤的精确测量也为观察肿瘤生长情况、复发监测、疗效评价等提供了便利。
肺的动静脉血管系统常存在个体变异,行肺癌切除时易误伤变异的小血管分支而导致术中出血,影响手术疗效。术前了解支气管、血管的走形特点是肺段解剖切除安全快速进行的前提条件[15]。Kurenov等[16]研究指出,构建肺癌的三维数字化模型有利于肺癌手术计划的确立,术前利用该模型进行模拟演练能缩短手术时间,有效降低手术风险及手术并发症。三维重建技术的发展使得高难度肺癌手术也可以安全进行[17-18],为手术方案的选择提供指导意义。本研究将计算机图像处理、现代医学影像学、解剖学和胸外手术学相结合,基于64排螺旋CT图像建立了个体化的肺癌数字化模型,为患者提供手术预演,模拟手术效果,并制定手术方案。术中解剖结构验证了肺癌模型的准确性,提高了手术的安全性。肿瘤切除的原则是,在最大限度切除肿瘤的同时,最大限度的保留正常脏器,尽量降低手术创伤。而本研究应用个体化的肺癌模型指导进行肺段的解剖切除既严格遵循了肿瘤切除的原则又符合当前数字化、精准化、个体化医疗的大趋势[19-21]。
综上所述,采用64排螺旋CT数据建立的个体化的肺癌三维模型是可行和有效的,模型准确地反映了复杂而精细的解剖结构和毗邻关系,既有助于制定手术计划,又为后续的虚拟手术打下了基础。
| [1] |
李榕, 韩宝惠. 维生素D与肺癌[J].
肿瘤,2010, 30 (5) : 443-6.
( 0) 0)
|
| [2] |
傅栋, 靳安民, 田京, 等. 颈段脊柱前路手术相关结构的三维可视化[J].
南方医科大学学报,2010, 30 (4) : 888-94.
( 0) 0)
|
| [3] |
侯宝华, 崔鹏, 简志祥, 等. 三维可视化技术在腹腔镜胰体尾囊性肿瘤切除中的临床应用[J].
南方医科大学学报,2013, 33 (11) : 1648-51.
( 0) 0)
|
| [4] |
方驰华, 方兆山, 范应方, 等. 三维可视化、3D打印及3D腹腔镜在肝肿瘤外科诊治中的应用[J].
南方医科大学学报,2015, 35 (5) : 639-45.
( 0) 0)
|
| [5] |
刘付轩聪, 罗荣城. 基于PC的胶质瘤三维可视化模型的建立[J].
山东医药,2011, 51 (26) : 4-5.
( 0) 0)
|
| [6] |
俞金龙, 黄宗海, 崔春晖, 等. 64层CTA断层图像虚拟技术对结直肠肿瘤诊治的应用评价[J].
南方医科大学学报,2011, 31 (9) : 1585-8.
( 0) 0)
|
| [7] |
Armato SG 3rd, Sensakovic WF. Automated lung segmentation for thoracic CT impact on computer-aided diagnosis[J].
Acad Radiol,2004, 11 (9) : 1011-21.
DOI: 10.1016/j.acra.2004.06.005. ( 0) 0)
|
| [8] |
刘五嵩, 王庆兵, 郭玉芳, 等. 64排CT在周围型肺癌中的诊断价值分析[J].
中国实用医药,2015, 10 (3) : 100-1.
( 0) 0)
|
| [9] |
Kim HC, Park SH, Park SI, et al. Three-dimensional reconstructed images using multidetector computed tomography in evaluation of the biliary tract[J].
Abdom Imaging,2004, 29 (4) : 472-8.
( 0) 0)
|
| [10] |
姜晓彤, 罗立民, 汪家旺, 等. 一种肺部肿瘤CT图像序列的自动分割方法[J].
中国图像图形学报,2003, 8 (9) : 1028-33.
( 0) 0)
|
| [11] |
罗述谦, 周果宏.
医学图像处理与分析. 科学出版社[M]. 2003 : 8 .
( 0) 0)
|
| [12] |
裴晓敏, 郭红宇, 戴建平. CT图像中肺实质的自动分割[J].
中国医学影像技术,2009, 25 (7) : 1293-5.
( 0) 0)
|
| [13] |
钱智, 李淼, 周荣林. 64层螺旋CT血管造影及三维重建在青年女性肺癌诊断中的价值[J].
现代肿瘤医学,2015, 23 (8) : 1129-32.
( 0) 0)
|
| [14] |
姚振威, 沈天真, 陈星荣. 肺癌的CT气管、支气管树三维重建[J].
中国医学计算机成像杂志,2004 (6) : 384-7.
( 0) 0)
|
| [15] |
Gonzalez-Rivas D, Fieira E, Mendez L, et al. Single-port video-assisted thoracoscopic anatomic segmentectomy and right upper lobectomy[J].
Eur J Cardiothorac Surg,2012, 42 (6) : 169-71.
DOI: 10.1093/ejcts/ezs482. ( 0) 0)
|
| [16] |
Kurenov SN, Ionita C, Dan S, et al. Three-dimensional printing to facilitate anatomic study, device development, simulation, and planning in thoracic surgery[J].
J Thora Cardiovasc Surg,2015, 149 (4) : 973-9.
DOI: 10.1016/j.jtcvs.2014.12.059. ( 0) 0)
|
| [17] |
Rietzel E, Chon G TY, Choi NC. Four-dimensional image based treatment planning:target volume segmentation and dose calculation in the presence of respiratory motion[J].
Int J Radiat Oncol Biol Phy,2005, 5 (2) : 365.
( 0) 0)
|
| [18] |
Stella F, Dolci G, Dell' Amore A, et al. Three-dimensional surgical simulation-guided navigation in thoracic surgery:a new approach to improve resultsin chest wall resection and reconstruction for malignant diseases[J].
Interact Cardiovasc Thorac Surg,2014, 18 (1) : 7-12.
DOI: 10.1093/icvts/ivt440. ( 0) 0)
|
| [19] |
Nakada T, Akiba T, Inagaki T, et al. Thoracoscopic anatomical subsegmentectomy of the right S2b+S3 using a 3D printing model with rapid prototyping[J].
Interact Cardiovasc Thorac Surg,2014, 19 (4) : 696-8.
DOI: 10.1093/icvts/ivu174. ( 0) 0)
|
| [20] |
Akiba T, Morikawa T, Ohki T. Thoracoscopic lung segmentectomy simulated by a tailor-made virtual lung:computed bronchography and angiography[J].
Thorac Cardiovasc Surg,2013, 61 (2) : 151-3.
( 0) 0)
|
| [21] |
Akiba T, Morikawa T, Ohki T. Simulation of thoracoscopic surgery using 3-dimensional tailor-made virtual lung[J].
J Thorac Cardiovasc Surg,2012, 143 (5) : 1232-4.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
