感音神经性耳聋是临床常见的疾病,包括噪声性聋、老年性聋、药物性聋、突发性聋。其机制可能为通过机械力[1]、氧自由基[2]、钙超载[3]等致使听觉感受器损害,病理改变主要分布于耳蜗和听神经[4],目前主要的治疗方法为配戴助听器或植入人工耳蜗,但是这两种方法对听力损害有所改善的病人使用是受限的[5]。虽然感音性耳聋发生在急性期,药物有时可以改善听力下降,但传统药物治疗有一定的限制,因此人们开始寻找新的药物和治疗方法。由于Cruz等[6]在损伤刚孵育的雏鸡耳蜗毛细胞后发现其仍可再生,Forge等[7]发现豚鼠耳蜗及迷路中也有毛细胞的再生,人们认识到保护和促进毛细胞的再生或许是治疗感音神经性耳聋的新方向。因此,这些新药和新疗法都以耳蜗毛胞作为靶点,保护受损毛细胞,促进毛细胞再生,以期达到治疗目的。Korver等[8]发现D-甲硫氨酸可减少卡铂对毛细胞的损伤,预防听力下降;Lynch等[9]发现,口服4~10 mg/kg ebselen可减少动物噪声暴露后永久性阈移和暂时性阈移的产生;一些中药对于防止毛细胞及听神经细胞损伤,促进毛细胞再生也有一定效果[10-11]。盐酸椒苯酮胺(PPTA)是一类治疗心肌缺血再灌注保护药,可降低心肌耗氧量,增加心肌细胞对钙离子的敏感性,同时不引发钙超载,本课题组先前的研究表明PPTA可改善豚鼠耳蜗缺血再灌注损伤[12],并抑制缺血再灌注后IL-1β、TNF-α,Caspase-3及Fas表达[13-14],本研究在前期工作的基础上进一步探讨其对豚鼠庆大霉素所致听力损伤的保护作用。
1 材料和方法 1.1 实验动物及分组健康成年纯白红目雄性豚鼠60只,体质量300~350 g,双侧耳廓反射灵敏,鼓膜完整,标志清楚,并由ABR检测无听力异常。由南方医科大学实验动物中心提供(动物合格证编号:44002100006861)。随机分为对照组、模型组、同期治疗组、造模后对照组、后期治疗组共5组,每组12只。
1.2 主要实验试剂PPTA溶液(干粉剂,广州众为公司,溶于3 < pH < 5超纯水,2 mg/mL);硫酸庆大霉素注射液(广药白云山国药准字号H44022095);Anti-Endothelin 1抗体(abcam,货号ab117757);Anti-LC3兔抗(sigma,货号L8919);Anti-Beclin1兔抗(Sigma,货号B6186);Anti-Actin兔抗(Sigma,货号A4700);羊抗兔二抗(中杉金桥);Total RNA提取试剂RNAiso Plus,PrimeScript RT reagent Kit With gDNA Eraser,SYBR Premix Ex TaqTM(Takara)。
1.3 实验方法 1.3.1 给药剂量及方法对照组腹腔注射同GM等量生理盐水、听泡内注入人工外淋巴液0.1 mL/次、3次/d,连续7 d;模型组腹腔注射GM 160 mg·kg-1·d-1、听泡内注入人工外淋巴液0.1 mL/次、3次/d,连续7 d;同期治疗组腹腔注射GM 160 mg·kg-1·d-1、听泡内注入PPTA液0.1 mL/次、3次/d,连续7 d;造模后对照组腹腔注射GM 160 mg·kg-1·d-1,连续7 d后再行听泡内注入人工外淋巴液0.1 mL/次、3次/d,连续7 d;后期治疗组腹腔注GM 160 mg·kg-1·d-1,连续7 d后再行听泡内注入0.1 mL/次、3次/d,连续7 d。
1.3.2 听泡注药方法及标本取材豚鼠腹腔内注射2%戊巴比妥钠(30 mg/kg)麻醉后,双耳备皮,37 ℃保温毯保温,常规消毒、铺无菌巾,0.5%利多卡因注射液行局部麻醉,于距耳后沟后1/3约0.5 cm处作切口,切开皮肤约1 cm,钝性分离皮下组织及颞肌,暴露听泡,尖刀片在听泡上钻孔,孔径约1.5 mm,于小孔处置入外径约为1.5 mm的塑料软管,软管内插入内导丝,逐层缝合切口并固定导管。每次给药时可从拔出内导丝后从导管内行听泡注药。各组完成给药及活体检测项目后,断头处死,快速取出听泡,分离耳蜗备用。
1.3.3 听性脑干反应检测各组豚鼠在完成给药后检测听性脑干反应(ABR)。测试采用本单位“听觉电生理动物实验”测听平台,所有豚鼠的ABR检测操作均于隔音屏蔽室中在全麻下进行(2%戊巴比妥钠30 mg/kg腹腔注射)。自制短银针(极间电阻 < 2000 Ω)插入豚鼠双耳前水平颅顶正中皮下作为记录电极,受试耳耳后皮下插入参考电极,对侧耳后皮下插入接地电极。距外耳道口约5 mm处放置测试耳机,对侧耳加噪声(低于刺激声20dBSPL)掩蔽。以短声进行测试,刺激采样的重复频率为11.1次/s(间隔90 ms),交替相位消除伪迹,带通滤波100~3000 Hz,叠加信号500次,分析时程周期20 ms,上下声强级调节为5dBSPL增减。以能引出Ⅲ波的最小声强确定反应阈,每只豚鼠测量3次后取平均值定为反应阈。
1.3.4 Western blot检测耳蜗组织自噬水平取各组豚鼠耳蜗组织,PBS液充分灌洗冲出淋巴液后,显微镜下小心剥除蜗壳,完整保留蜗内组织及蜗轴,将耳蜗组织加入裂解液高速匀浆机充分粉碎后冰上裂解30 min,4 ℃,14 000 r/min,15 min,将样本标准化,取各组蛋白经聚丙烯酰胺凝胶电泳后转膜。5%脱脂奶粉液室温封闭30 min后,加入一抗4 ℃过夜,TBST液洗涤,加入二抗室温孵育2 h,加发光液曝光显像。
1.3.5 RT-PCR检测耳蜗NKCC1 mRNA的表达听泡内取出耳蜗,剥除蜗壳,将耳蜗组织置入2 mL冻存离心管中,液氮迅速冻存后-80 ℃保存。根据表 1的引物设计,对提取Total RNA后合成的cDNA进行RT-PCR检测。以β-action为内参,用2-△△CT进行mRNA的表达定量。
| 表 1 引物序列设计 Table 1 PCR primer sequences |
耳蜗取材后,于蜗顶钻孔,并开放蜗窗及前庭窗,蜗内缓慢注入并整体于4%多聚甲醛中固定24 h,清洗固定液后于10%EDTA脱钙液中脱钙1周,石蜡包埋切片后按试剂盒说明行免疫组织化学染色。每张切片在200倍下分别于螺旋神经节、Corti器及血管纹随机各取3个视野摄像。并Motic系统进行图像分析,以细胞棕黄色染色为阳性,并综合行积分光密度分析。
1.4 统计学处理实验数据以均数±标准差表示,采用SPSS19.0软件进行one-way AVONA方差分析,一组与多组之间比较时采用LSD法,P < 0.05时差异有统计学意义。
2 结果 2.1 ABR结果各组豚鼠给药后ABR反应阈值比较,治疗组豚鼠ABR阈值明显低于于模型组(30.8±8.5 vs 62.95±9.9,P < 0.001),但明显高于对照组(30.8±8.5 vs 15.4±3.3,P < 0.001);后期治疗组ABR值明显低于模型对照组(48.8±9.1 vs 68.3±7.5,P < 0.001),但明显高于治疗组(48.8±9.1 vs 30.8±8.5,P < 0.001),模型组、模型后对照组ABR反应阈差异无统计学意义(P>0.05)。
2.2 自噬蛋白LC3Ⅰ及LC3Ⅱ的表达结果模型组LC3Ⅱ(与actin的比值)及Beclin1的表达量较其余4组明显升高,后期治疗组LC3Ⅱ(与actin的比值)及Beclin1的表达量较造模后对照组降低(图 1)。
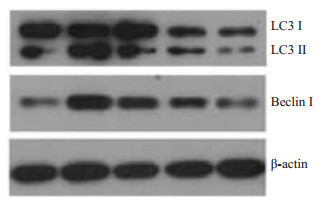
|
图 1 WB检测各组耳蜗组织LC3、Beclin1蛋白表达 Figure 1 Western blotting for detecting protein expression of LC3 Ⅰ (lane 1), LC3 Ⅱ (lane 2) and beclin1 (lane3) in the cochlea. |
模型组NKCC1 mRNA表达较其余4组明显升高(3.582±0.241 vs 1.994±0.113、2.356±0.332、2.588±0.162、1.114±0.127,P < 0.05),后期治疗组NKCC1 mRNA表达明显低于造模后对照组(1.114±0.127 vs 2.588±0.162,P < 0.05),造模后对照组NKCC1 mRNA表达较对照组明显升高(2.588±0.162 vs 1.994±0.113,P < 0.05)。
2.4 ET-1蛋白免疫组化表达结果ET-1在耳蜗螺旋神经节、Corti器和血管纹均有表达,主要表达于胞膜及胞浆中。模型组各部位ET-1表达较其余4组明显增高,对照组各部位ET-1表达低于其余4组,后期治疗组各部位ET-1表达较造模后对照组降低(图 2)。
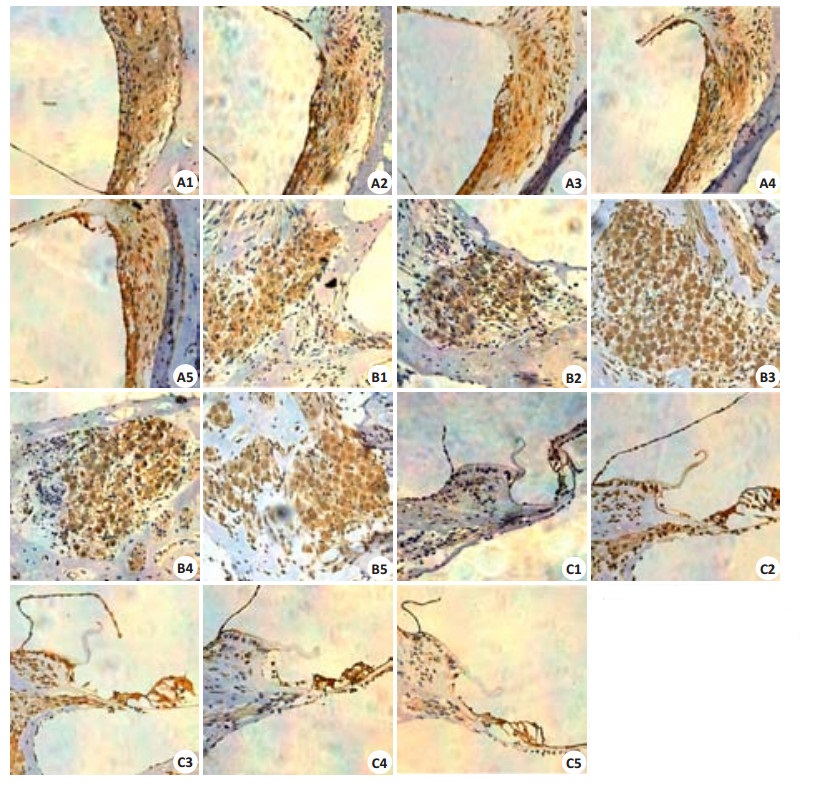
|
图 2 ET-1免疫组化结果 Figure 2 ET-1 immunohistohistochemistry of the tissues in the striavascularis (A), spiral ganglion (B), and the Corti organ (C) (Original magnification: × 400). 1: Control group; 2: Model group; 3:Concurrent treatment group; 4: Model control group; 5: Delayed treatment group. |
在绝大部分感音性耳聋的患者中,内耳毛细胞的损伤或丢失是引起该疾病的主要原因。其中,耳蜗毛细胞缺血缺氧,导致活性氧堆积,是一个重要原因。内耳骨迷路的微血管能够产生ET-1 [15]。研究表明ET-1可以增加AcE及AngⅡ的活性[16-17],而ACE也是强烈的缩血管物质,二者协同可使内耳缺血更加严重;ET-1作用于靶细胞可加速细胞内Ca2+释放,促进胞内Ca2+浓度升高,促进Ca2+通道开放及内流,造成细内钙超载,导致细胞损伤及死亡[17-18]。免疫组化的结果表明,给予GM剌激时,螺旋神经节、Corti器和血管纹ET-1内皮素表达升高,继而刺源小动腺收缩,导致该部位缺血缺氧,使毛细胞损伤。将给予庆大霉的小鼠给予PPTA预防性保护后可以发现内皮素的表达量下降,表明PPTA可以改善内耳的血供,降低钙负载。Na+/K+/2Cl-离子共转运体(NKCC)是有12个跨膜结构域,大小为195 000糖蛋白[19]。在肠上皮细胞中NKCC是主要摄取氯离子的结构[20]。当细胞受到刺激时,其膜上的NKCC就会被激活,导致大量的Na+/K+/Cl-进入细胞,使细胞渗透压严重升高[21],可以导致耳蜗内毛细胞、传入神经纤维的水肿、变性等一系列形态学和功能学的改变[22]。PCR结果表明,当给予庆大霉素刺激时,耳蜗NKCC表达上升,给予PPTA后,表达下降,这与上述文献报道一致。
当外部刺激持续存在时,细胞将发生死亡。细胞的死亡方式包括凋亡、自噬和坏死。众多研究已表明感音性耳聋存在着内耳毛细胞的凋亡[23-25],但是否存在自噬尚无文献报道。自噬是一种真核细胞中普遍存在的由溶酶体参与的自身吞噬细胞器及胞内蛋白的细胞行为,借此进行自身胞内物质的代谢和再利用,并能自我更新细胞器,有效维持细胞的内环境稳态及存活[26]。LC3自噬的关键蛋白,对自噬小体的形成起着至关重要的作用[27]。实验结果表明,当小鼠受到庆大霉素刺激时,其耳蜗细胞自噬水平增加,PPTA保护性用药后,自噬水平又会降低。表明庆大霉素会造成耳蜗细胞自噬性死亡,PPTA可以减少这种现象的发生。
参考Oishi等[28-29]庆大霉素豚鼠耳毒性造模过程,结合实验具体情况,选用体质量较大的雄性豚鼠,行预实验造模,予庆大霉素160 mg/kg、连续注射7 d,可获得较为满意的耳聋模型。根据薛薇等[30]对PPTA人体耐受的研究及陈浩等[14]PPTA药物等应用,为保持充足药量的同时给予安全药量,予PPTA液(2 mg/mL)0.1 mL/次,3次/d听泡注射。听泡注射可较全身给药剂量减少,毒副作用小,药效确切。本研究结果中,在庆大霉素耳毒性造模过程中同时应用PPTA进行听力保护的效果明显优于先期造模后再予PPTA保护。但两个不同时期给予保护听力治疗过程中,细胞自噬、NKCC1mRNA、ET-1表达变化的趋势相同。这与临床一致认为的庆大霉素对听觉细胞产生不可逆的损伤相符合,但其后期过程中仍有保护听力作用,并且可能的作用机制仍存在,证明PPTA对发生后的感应神经性耳聋的治疗依然很有意义。另外,采用听泡置管注入给药对听力无明显影响,给药后药物作用明确,并与临床治疗过程中鼓室注射给药类似,是简单而确切有效的给药方法。
总之,PPTA对于以庆大霉素为代表因素造成的感音性耳聋具有保护作用,其通过抑制ET-1表达和NKCC的激活,同时抑制自噬程序的发生来保护耳蜗细胞损伤,进而减少听力损失,PPTA可作为临床治疗感音性耳聋的潜在药物。
| [1] |
付勇, 龚树生, 薛秋红, 等. 强噪声暴露后大鼠听觉电生理及形态学改变[J].
临床耳鼻咽喉头颈外科杂志,2008, 22 (11) : 509-12.
( 0) 0)
|
| [2] |
Sha SH, Taylor R, Forge A, et al. Differential vulnerability of basal and apical hair cells is based on intrinsic susceptibility to free radicals[J].
Hear Res,2001, 155 (1/2) : 1-8.
( 0) 0)
|
| [3] |
李兴启, 杨仕明, 张倩, 等. 基因突变与耳蜗微环境[J].
中华耳鼻咽喉头颈外科杂志,2009, 44 (2) : 167-71.
( 0) 0)
|
| [4] |
Moser T, Predoehl F, Starr A. Review of hair cell synapse defects in sensorineural hearing impairment[J].
Otol Neurotol,2013, 34 (6) : 995-1004.
DOI: 10.1097/MAO.0b013e3182814d4a. ( 0) 0)
|
| [5] |
Nakagawa T. Strategies for developing novel therapeutics for sensorineural hearing loss[J].
Front Pharmacol,2014, 5 (8) : 206.
( 0) 0)
|
| [6] |
Cruz RM, Lambert PR, Rubel EW. Light microscopic evidence of hair cell regeneration after gentamicin toxicity in chick cochlea[J].
Arch Otolaryngol Head Neck Surg,1987, 113 (10) : 1058-62.
DOI: 10.1001/archotol.1987.01860100036017. ( 0) 0)
|
| [7] |
Forge A, Li L, Corwin JT, et al. Ultrastructural evidence for hair cell regeneration in the mammalian inner ear[J].
Science,1993, 259 (5101) : 1616-9.
DOI: 10.1126/science.8456284. ( 0) 0)
|
| [8] |
Korver KD, Rybak LP, Whitworth C, et al. Round window application of D-methionine provides complete cisplatin otoprotection[J].
Otolaryngol Head Neck Surg,2002, 126 (6) : 683-9.
DOI: 10.1067/mhn.2002.125299. ( 0) 0)
|
| [9] |
Lynch ED, Kil J. Compounds for the prevention and treatment of noise-induced hearing loss[J].
Drug Discov Today,2005, 10 (19) : 1291-8.
DOI: 10.1016/S1359-6446(05)03561-0. ( 0) 0)
|
| [10] |
李胜利, 朱宏亮, 刘全征, 等.纯中药制剂复聪汤对感音性聋耳蜗毛细胞修复再生的实验研究[C]//首届全国方剂组成原理高峰论坛论文集, 黄山, 2012:12-4.
( 0) 0)
|
| [11] |
徐庆瑞, 石广蔚. 葛根素注射液加地塞米松预防鼻咽癌放化疗所致感音性听力损害临床观察[J].
国际中医中药杂志,2011, 33 (12) : 1115-6.
( 0) 0)
|
| [12] |
李永贺, 李威, 陈浩, 等. 盐酸椒苯酮胺对豚鼠耳蜗缺血再灌注损伤的听力保护作用[J].
听力学及言语疾病杂志,2013 (6) : 603-7.
( 0) 0)
|
| [13] |
李永贺, 吴剑, 李威, 等. 盐酸椒苯酮胺对耳蜗缺血再灌注后白介素-1β、肿瘤坏死因子-αmRNA及Fas蛋白表达的影响[J].
南方医科大学学报,2013, 33 (11) : 1669-72.
( 0) 0)
|
| [14] |
陈浩, 谢民强, 吴剑, 等. 盐酸椒苯酮胺通过降低caspase-3表达减轻庆大霉素豚鼠耳蜗损伤[J].
南方医科大学学报,2014, 34 (3) : 329-34.
( 0) 0)
|
| [15] |
Jinnouchi K. Mechanism of endothelin 1 production in the cochlea of rats[J].
ORL J Otorhinolaryngol Relat Spec,2001, 63 (1) : 6-11.
DOI: 10.1159/000055699. ( 0) 0)
|
| [16] |
Luft FC. Proinflammatory effects of angiotensin Ⅱ and endothelin:targets for progression of cardiovascular and renal diseases[J].
Curr Opin Nephrol Hypertens,2002, 11 (1) : 59-66.
DOI: 10.1097/00041552-200201000-00009. ( 0) 0)
|
| [17] |
程虹, 谌贻璞. 内皮素-1与肾素-血管紧张素-醛固酮系统的相互作用[J].
肾脏病与透析肾移植杂志,2003, 12 (4) : 371-4.
( 0) 0)
|
| [18] |
张莹雯, 涂晋文. 内皮素在大鼠药物性肾损害尿液中的变化及意义[J].
武汉大学学报:医学版,2004, 25 (6) : 714-5.
( 0) 0)
|
| [19] |
Xu JC, Lytle C, Zhu TT, et al. Molecular cloning and functional expression of the bumetanide-sensitive Na-K-Cl cotransporter[J].
Proc Natl Acad Sci USA,1994, 91 (6) : 2201-5.
DOI: 10.1073/pnas.91.6.2201. ( 0) 0)
|
| [20] |
D'andrea L, Lytle C, Matthews JB, et al. Na:K:2Cl cotransporter (NKCC) of intestinal epithelial cells. Surface expression in response to cAMP[J].
J Biol Chem,1996, 271 (46) : 28969-76.
DOI: 10.1074/jbc.271.46.28969. ( 0) 0)
|
| [21] |
Zhao H, Hyde R, Hundal HS. Signalling mechanisms underlying the rapid and additive stimulation of NKCC activity by insulin and hypertonicity in rat L6 skeletal muscle cells[J].
J Physiol,2004, 560 (Pt 1) : 123-36.
( 0) 0)
|
| [22] |
孙勍, 李兴启, 单希征. 耳蜗内毛细胞及传入神经突触损伤后的修复[J].
国外医学:耳鼻咽喉科学分册,2005, 29 (4) : 208-10.
( 0) 0)
|
| [23] |
吴龙军, 黄益灯, 李兴启. 耳蜗毛细胞凋亡及其基因调控的保护作用[J].
国际耳鼻咽喉头颈外科杂志,2014 (3) : 125-8.
( 0) 0)
|
| [24] |
王静, 施建蓉. 氨基糖甙类抗生素与内耳毛细胞凋亡[J].
中国中西医结合耳鼻咽喉科杂志,2007, 15 (5) : 395-8.
( 0) 0)
|
| [25] |
于红, 祝威, 李兴启. 活性氧与内耳毛细胞凋亡相关的信号转导及基因调控[J].
国际耳鼻咽喉头颈外科杂志,2006, 30 (2) : 134-7.
( 0) 0)
|
| [26] |
李红园, 魏丽娟, 魏占勇, 等. 细胞自噬的研究进展[J].
畜牧与兽医,2015, 47 (5) : 143-6.
( 0) 0)
|
| [27] |
Alonso S, Pethe K, Russell DG, et al. Lysosomal killing of Mycobacterium mediated by ubiquitin-derived peptides is enhanced by autophagy[J].
Proc Natl Acad Sci U S A,2007, 104 (14) : 6031-6.
DOI: 10.1073/pnas.0700036104. ( 0) 0)
|
| [28] |
Oishi N, Kendall A, Schacht J. Metformin protects against gentamicin-induced hair cell death in vitro but not ototoxicity in vivo[J].
Neurosci Lett,2014, 583 (7) : 65-9.
( 0) 0)
|
| [29] |
Wang J, Wang Y, Chen X, et al. Histone deacetylase inhibitor Sodium butyrate attenuates gentamicin-induced hearing loss in vivo[J].
Am J Otolaryngol,2015, 36 (2) : 242-8.
DOI: 10.1016/j.amjoto.2014.11.003. ( 0) 0)
|
| [30] |
薛薇, 史爱欣, 李茹冰, 等. 盐酸椒苯酮胺在中国健康人体连续给药的耐受性研究[J].
中国临床药理学杂志,2014, 32 (6) : 511-3.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
