吴茱萸碱(EVO)是植物吴茱萸的主要活性成分之一[1],研究表明,EVO具有抗炎、抗肿瘤、降血压、减肥、镇痛、免疫抑制等药理作用[2-4],其中,抗肿瘤作用是最受人们关注的药理作用。但EVO难溶于水,口服难吸收,半衰期短,生物利用度低,在临床应用中受到很大的限制[5-6]。羟丙基-β-环糊精(HP-β-CD)是应用最广泛的环糊精衍生物,能显著提高药物的水溶性,增加难溶性药物的溶解度,提高药物生物利用度,使药物的疗效增强或服用剂量减少,能调节或控制药物的释放速度,降低药物毒副作用[7-9]。本研究将EVO制备成吴茱萸碱羟丙基-β-环糊精分子包合物(EHD),以提高其水溶性以及生物利用度。近年来,对EVO理化性质和药理活性研究报道较多,但对其制剂及其药动学的研究报道却很少,本实验首次将EVO与HP-β-CD相结合,制备了EHD,考察了EHD在水中的溶解性以及体外释放等体外动力学,并通过大鼠尾静脉注射给药,采用HPLC法测定大鼠体内的血药浓度,对其药代动力学以及生物等效性等体内动力学进行了研究。
1 材料和方法 1.1 材料与试剂吴茱萸碱(EVO,纯度>99%,武汉远城科技发展有限公司);和厚朴酚(纯度>99%,西安小草植物科技有限公司);羟丙基-β-环糊精(HP-β-CD,>99%,江苏泰兴新鑫医药辅料有限公司);甲醇(色谱纯,上海国药集团化学试剂有限公司);超纯水由Milli-Q超纯水系统制备;其它试剂均为分析纯。
1.2 仪器设备1100型高效液相色谱仪(美国Agilent);Milli-Q超纯水系统(美国Millipore);DF-101S型集热式磁力搅拌器(巩义市予华仪器有限责任公司);TGL-16B高速台式离心机(上海安亭科学仪器厂);AB 204 S电子分析天平(瑞士Mett ler Toledo仪器公司);KQ-2200B型超声波清洗器(民山市超声仪器有限公司);RE 52 AA旋转蒸发器(上海亚荣生化仪器厂);QL-901涡旋仪(海门市其林贝尔仪器制造有限公司);DZF-1型真空干燥箱(上海跃进医疗器械厂);BCD-649WE冰箱(青岛海尔股份有限公司)。
1.3 实验动物清洁级SD大鼠(重庆医科大学实验动物中心提供,许可证号:SCXK-(渝)2012-0001),体质量250±20 g。
1.4 EHD的制备按处方量称取HP-β-CD和EVO于洁净的玻璃研钵中,加入蒸馏水,湿研1 h,40 ℃真空干燥2 h后用丙酮洗涤,干燥,即得EHD [10]。
1.5 EHD水中溶解度测定称取过量的EHD和EVO于磨口锥形瓶内,分别加入5 mL超纯水,室温20 ℃搅拌24 h。分别取1 mL各样品,6000 r/min离心10 min,上清液用流动相稀释后,进样10 μL测定[11]。
1.6 EHD的相溶解度试验精密称取0、0.2、0.4、0.6、0.8、1.0 mmoL HP-β-CD溶于5 mL蒸馏水中,加入过量EVO,超声后于恒温振荡器中25±2 ℃,振荡48 h使溶解达到平衡状态。吸取溶液离心,吸取上清液进样分析[9, 12]。
1.7 EHD的体外释放采用动态膜透析法测定EHD及EVO的体外释药性。释放介质为pH 7.4磷酸缓冲溶液,温度为37±0.5 ℃,转速为100 r/min。取EHD、EVO混悬液(相当于EVO约1 mg),置于透析袋中,将含药透析袋置于有25 mL释放介质的锥形瓶中,分别于0.25、0.5、1、2、3、4、5、6、8、12、24、48、72 h取出1 mL,补加等量同质同温释放介质,用0.45 μm微孔滤膜滤过,取滤液12 000 r/min离心10 min,取上清液10 μL进样检测,计算累积释放百分率(%)。
1.8 药代动力学实验 1.8.1 色谱条件1100型高效液相色谱仪(美国Agilent公司);固定相:Lichrospher C18柱(4.6 mm×250 mm,5 µm);保护柱:大连依利特公司“佳杰” C18(4.0 mm×3.0 mm),流动相:甲醇:水(75:25),柱温:35 ℃,流速:1.0 mL/min,检测波长:225 nm,内标:和厚朴酚,进样量:40 µL。
1.8.2 给药剂量及方法将体质量为250±20 g的SD大鼠随机分为两组,对照组给予EVO游离原料药(用0.5%的CMC-Na混悬,100 mg/kg, i.v.),实验组给予EHD(相当于EVO100 mg/kg, i.v.)。给药前禁食12 h,不禁水。1.8.3血浆样品采集给药前采空白血,分别于给药后0.083、0.25、0.5、1、2、4、6、8、10、12、24 h乙醚麻醉大鼠后,眼底取血采集血样0.5 mL,至肝素浸润过的离心管中,3000 r/min离心10 min后分离上层血浆,于-4 ℃保存待测。
1.8.4 血浆样品处理吸取150 μL血浆样品,加入20 μg/mL内标工作液10 μL,涡旋30 s,再加入75 μL氨水,涡旋30 s后,加入750 μL乙醚,涡旋3 min(涡旋1 min后静置30 s,重复3次,共计3 min),4000 r/min离心5 min,小心吸取上清液于EP管中,于40 ℃水浴挥干乙醚,加入100 μL甲醇,涡旋1 min,于12 000 r/min离心10 min,取上清液40 μL进样检测。
1.8.5 药动学参数研究根据测得结果,绘制血药浓度-时间曲线。用DAS 2.1.1软件计算药代动力学参数。
1.9 生物等效性研究使用DAS2.1.1软件将AUC0-∞、Cmax经对数转化后,进行方差分析及双单侧t检验,以P < 0.05认为差异有统计学意义。
2 结果 2.1 EHD在水中溶解度测得EVO在水中溶解度为0.41±0.15 μg/mL,而将EVO制备成EHD后在水中溶解度为18.46±0.36 μg/mL,表明制备成EHD后溶解度提高了约45倍。
2.2 EHD的相溶解度以HP-β-CD的浓度为横坐标,EVO的溶解度为纵坐标作图,绘制得相溶解度图(图 1)。由图 1可知EVO溶解度随HP-β-CD浓度增加而增加,二者具有线性关系。直线方程为[EVO]=0.1515 [HP-β-CD]+0.2123,R2=0.9957>0.990,为典型的AL型,说明当HP-β-CD为0~1.0 mmoL时,EVO与HP-β-CD能形成摩尔比为1:1的包合物。
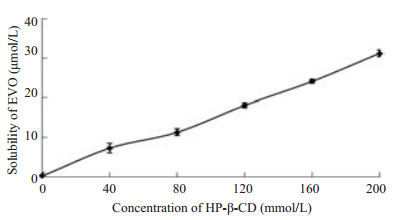
|
图 1 EVO在HP-β-CD中的相溶解图 Figure 1 Phase solubility diagram of EVO in HP-β-CD. |
以时间为横坐标,累计释放百分率为纵坐标,建立EHD和EVO的释药曲线见图 2。
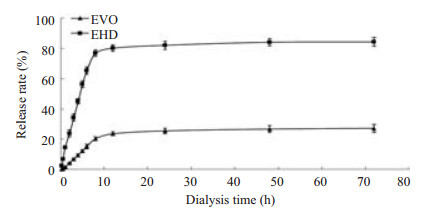
|
图 2 EVO和EHD的累计释放百分率 Figure 2 Cumulative release percentage of EVO from EHD in PBS (pH 7.4). |
结果表明EHD的体外累计释放百分率为(76.8±4.9)%,EVO的体外累计释放百分率为(25.7±2.1)%,两者相比,EHD比EVO提高了3倍。由图 2可知将EVO制成EHD后,明显的改善了EVO在pH 7.4磷酸缓冲溶液的体外释放。
2.4 方法特异性取空白血浆、含一定浓度的标准液和内标的空白血浆、血浆样品溶液,分别按“1.8.4”项下操作。在该色谱条件下,EVO及内标分离良好,EVO与和厚朴酚的保留时间分别为5.7 min和8.2 min,峰形良好且血浆中的内源性物质不干扰其测定。
2.5 线性关系空白血浆中精密加入内标工作液,涡旋30 s,再加入不同浓度的EVO标准液,配制成浓度为0.01、0.05、0.075、0.1、0.5、1.5、2.0 μg/mL的系列标准血浆样品,按“1.8.4”方法处理,分别记录EVO峰面积(As)和内标峰面积(Ai)以峰面积之比Y(Y=As/Ai)对EVO的质量浓度X(μg·mL-1)进行线性回归,得标准曲线方程。结果表明EVO的浓度在0.01~2.0 μg/mL范围内线性良好。标准曲线回归方程:Y=1.1295X+0.0709,r=0.9999。
2.6 精密度取空白血浆和EVO标准液,配制低、中、高3个浓度的血浆溶液(EVO浓度分别为0.1、0.5、1.5 μg/mL),各浓度平行配制3份,按“1.8.4”方法处理,1 d内连续进样检测5次考察其日内精密度,连续5 d进样检测考察其日间精密度。结果表明,高、中、低3个浓度的血浆样品溶液的日内精密度RSD分别为2.35%、4.07%和1.42%;日间精密度RSD分别为1.69%、3.50%和2.92%,日内和日间精密度均良好,符合方法学要求。
2.7 绝对回收率取空白血浆和EVO标准液,配制低、中、高3个浓度的血浆溶液(EVO浓度分别为0.1、0.5、1.5 μg/mL),平行配制3份,按“1.8.4”方法进行处理,进样测定EVO和内标的峰面积Sd、Sr。另配制低、中、高3个浓度的EVO溶液,各浓度平行配制3份,加入内标使其浓度为0.1 μg/mL,9份溶液用流动相稀释至与上述血浆样品处理后的浓度相同,测定EVO和内标的峰面积Sd1、Sr1。Sd/Sd1、Sr/Sr1即分别为EVO和内标的绝对回收率。计算得高、中、低3个浓度的溶液中EVO的绝对回收率分别为103.47%、108.53%和102.73%,内标的绝对回收率为102.15%、107.27%和104.97%。
2.8 方法回收率取空白血浆,加入不同浓度的EVO标准液,配制低、中、高3个浓度的血浆溶液(EVO浓度分别为0.1、0.5、1.5 μg/mL),各浓度分别平行配制3份,按“1.8.4”方法处理,进样测定EVO和内标的峰面积,计算方法回收率。计算得高、中、低3个浓度的血浆样品的方法回收率分别为103.57%、97.18%和98.48%。
2.9 药时曲线和药动学参数SD大鼠尾静脉注射给药给予EHD及游离EVO后,分别以EHD及游离EVO中的EVO血药浓度为纵坐标,时间为横坐标作图,血药浓度-时间曲线见图 3。以DAS 2.1.1对血药浓度数据进行拟合分析,得到EHD与EVO均符合二室模型,药代动力学参数见表 1。
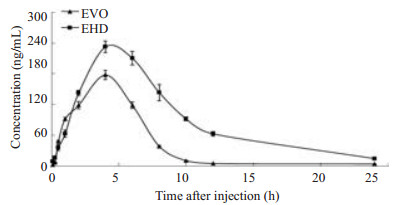
|
图 3 EVO和EHD血药浓度-时间曲线 Figure 3 Concentration-time curves of EVO and EHD (Mean±SD). |
| 表 1 EVO和EHD在大鼠体内的药动学参数 Table 1 Pharmacokinetic parameters after a single dose of free EVO and EHD in rats (Mean±SD) |
根据公式,相对生物利用度(F0-∞)=AUC受试组/AUC参比组×100%计算出EHD的生物利用度。由表 1可知,EHD与EVO的AUC0-∞分别为2359.76±31.58 µg·L-1·h-1和919.16±9.73 µg·L-1·h-1,计算得到EHD的相对生物利用度为EVO的256.73%。EHD的Cmax为252.5±12.43 μg/L约为EVO的1.57倍;两者的Tmax无较大差异;EHD的MRT0-∞为8.46±0.91 h,约为EVO的1.9倍。
2.10 生物等效性评价使用DAS2.1.1软件将AUC0-∞、Cmax经对数转化后,进行方差分析及双单侧t检验,结果见表 2。
由表 2可知,EHD和EVO的AUC0-t和AUC0-∞的[1-2α] 90%可置信区间分别为136.10%~137.0%和136.7%~138.2,不在标准区间80%~125%的范围内;Cmax的[1-2α] 90%可置信区间为146.6%~148.9%,不在标准区间70%~143%的范围内,因此EHD与游离EVO生物不等效。另对Tmax进行非参数法检验,结果显示EHD和游离EVO的Tmax具有显著性差异(P < 0.05)。认定制剂EHD和游离药物EVO生物不等效。
| 表 2 大鼠静注注射(100 mg/kg,i.v.) EHD和游离EVO后,生物等效性的比较 Table 2 Bioequivalence of EHD and free EVO in rats after intravenous injection at the dose of 100 mg/kg of EHD |
本实验采用HPLC法测定EVO的血浆浓度,操作简单,方法可靠,且灵敏度好,选用和厚朴酚作为内标检测其血药浓度,且内标和血浆样品中内源性杂质均对EVO的测定无影响。
Tan等[13]将吴茱萸碱与磷脂制备成吴茱萸碱磷脂复合物后,水溶性约提高了3.4倍,生物利用度约提高了2倍,而本研究将EVO与HP-β-CD结合制备EHD,水溶性约提高了45倍,相对生物利用度为256.73%,比游离EVO约提高了2.6倍,药物和磷脂之间的结合力弱,且pH、酶、温度等对磷脂复合物的稳定性均有较大影响,可能会导致药物的解离,从而对溶解度以及生物利用度产生一定影响[14-15]。万坤等[16]制备了吴茱萸碱聚乙烯吡咯烷酮固体分散体建立了EVO在制剂中的测定方法,该文中仅在前言中泛泛提到吴茱萸碱聚乙烯吡咯烷酮固体分散体可能改善EVO的溶出度,可能会提高其生物利用度,但并未对吴茱萸碱聚乙烯吡咯烷酮固体分散体的体内外的动力学性质进行任何研究,也无生物利用度的具体数据,且制备成聚乙烯吡咯烷酮分散体后,药物处于高分散状态,使得药物稳定性不高,可能会使药物的生物利用度降低[17]。而本研究制备的EHD,由HP-β-CD将EVO包裹在其中,与吴茱萸碱聚乙烯吡咯烷酮固体分散体相比,药物的稳定性有一定的提高。
本课题选用羟丙基-β-环糊精,首次制备了EVO分子包合物,且对其溶解度和体外释放以及大鼠体内的药代动力学和生物等效性进行了研究,为其在临床的应用提供依据。
| [1] |
Xiao BY, Mao SJ, Li XD. Variations in the composition of Fructus Evodiae after processing with Radix Glycyrrhizae extract[J].
Chin J Integr Med,2012, 18 (10) : 782-7.
DOI: 10.1007/s11655-012-1178-8. ( 0) 0)
|
| [2] |
Xu S, Peng J, Li Y, et al. Pharmacokinetic comparisons of rutaecarpine and evodiamine after oral administration of Wu-Chu-Yu extracts with different purities to rats[J].
J Ethnopharmacol,2012, 139 (2) : 395-400.
DOI: 10.1016/j.jep.2011.11.023. ( 0) 0)
|
| [3] |
Hu J, Chen D, Jiang R, et al. Improved absorption and in vivo kinetic characteristics of nanoemulsions containing evodiaminephospholipid nanocomplex[J].
Int J Nanomed,2014, 9 : 4411-20.
( 0) 0)
|
| [4] |
刘利琼, 任伟, 谢丽, 等. 吴茱萸碱诱导肿瘤细胞凋亡的分子机制研究进展[J].
现代肿瘤医学,2015, 23 (10) : 1471-4.
( 0) 0)
|
| [5] |
Chen F, Li S, Li D, et al. Transdermal behaviors comparisons among Evodia rutaecarpa extracts with different purity of evodiamine and rutaecarpine and the effect of topical formulation in vivo[J].
Fitoterapia,2012, 83 (5) : 954-60.
DOI: 10.1016/j.fitote.2012.04.021. ( 0) 0)
|
| [6] |
Jiang J, Hu C. Evodiamine:a novel anti-cancer alkaloid from Evodia rutaecarpa[J].
Molecules,2009, 14 (5) : 1852-9.
DOI: 10.3390/molecules14051852. ( 0) 0)
|
| [7] |
曾倩, 纪晖, 唐慧慧, 等. 白杨素-羟丙基-β-环糊精包合物的制备与表征[J].
药学实践杂志,2014, 32 (6) : 456-9.
( 0) 0)
|
| [8] |
罗见春, 胡雪原, 吴建勇, 等. 姜黄素羟丙基-β-环糊精磷脂复合物在大鼠体内药代动力学研究[J].
中药材,2015, 38 (3) : 572-5.
( 0) 0)
|
| [9] |
高振珅, 王兰. 姜黄素羟丙基-β-环糊精包合物的制备及其性质研究[J].
中草药,2012, 43 (10) : 1951-6.
( 0) 0)
|
| [10] |
刘宏明, 谭群友, 柳珊, 等. 紫外分光光度法测定吴茱萸碱-β-环糊精的包合率[J].
光谱实验室,2012, 29 (3) : 1334-7.
( 0) 0)
|
| [11] |
罗见春, 何丹, 尹华峰, 等. 姜黄素磷脂复合物的药代动力学评价[J].
第二军医大学学报,2014, 35 (7) : 754-7.
( 0) 0)
|
| [12] |
Yano H, Kleinebudde P. Improvement of dissolution behavior for poorly water-soluble drug by application of cyclodextrin in extrusionprocess:comparison between melt extrusion and wet extrusion[J].
AAPS Pharm Sci Tech,2010, 11 (2) : 885-93.
DOI: 10.1208/s12249-010-9448-2. ( 0) 0)
|
| [13] |
Tan Q, Liu S, Chen X, et al. Design and evaluation of a novel evodiamine-phospholipid complex for improved oral bioavailability[J].
AAPS Pharm Sci Tech,2012, 13 (2) : 534-47.
DOI: 10.1208/s12249-012-9772-9. ( 0) 0)
|
| [14] |
吴先闯, 郝海军, 张永州, 等. 姜黄素磷脂复合物不同制剂对SD大鼠口服生物利用度的影响[J].
中成药,2015, 37 (10) : 2163-6.
( 0) 0)
|
| [15] |
郝海军, 张红芹, 贾幼智, 等. 采用制剂新技术提高中药磷脂复合物的溶出度和生物利用度研究进展[J].
中草药,2013, 44 (17) : 2474-9.
( 0) 0)
|
| [16] |
万坤, 孙立力, 黄开顺, 等. 吴茱萸碱-聚乙烯吡咯烷酮固体分散体中吴茱萸碱的含量测定[J].
光谱实验室,2013, 30 (4) : 1885-8.
( 0) 0)
|
| [17] |
姜文雅, 刘怡. 共聚维酮在药物制剂中应用的研究进展[J].
中国医药工业杂志,2015, 46 (8) : 898-903.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
