胃癌在中国是最常见的恶性肿瘤之一,由于早期症状比较隐匿,就诊时大多数患者已经是中晚期,尽管近年来关于胃癌的各种新的治疗方法和手段层出不穷,但患者总的生存时间并没有显著提高。转移和复发是主要原因。癌的转移是指癌细胞要经过彼此之间的黏附力降低、脱离母体肿瘤、降解基底膜以及最后通过阿米巴运动方式穿过降解的基底膜等一系列步骤。转移的过程与上皮间充质转化(epithelial-mesenchymaltransition, EMT)过程十分相似。所谓EMT就是指上皮细胞在某些特定生理或病理情况下向间充质细胞转化的过程,在这个过程中有上皮细胞的极性和黏附性丧失、细胞骨架重组、细胞外基质重塑以及变成运动能力更强的梭形,使肿瘤细胞易于浸润和转移。Slug是EMT过程中的一个关键调节因子,属于Snail超家族(又称Snail2)成员之一,其家族成员均是具有锌指结构的转录因子。Slug通过直接抑制E-cadherin的表达,使上皮细胞之间的黏附力降低而导致肿瘤的侵袭及预后不良[1-2]。ZEB1是另一个EMT的关键调节因子,其通过下调E-cadherin等上皮相关的标记物的表达,且能够诱导间充质标记物vimentin等的表达,使细胞的迁移能力增强[3-4]。ZEB1表达异常增高往往意味着肿瘤进展和预后不良[5-6]。肿瘤转移抑制基因表达降低或缺失也会进一步促进肿瘤的浸润及转移,KISS-1属于肿瘤转移抑制基因,最先是在黑色素瘤中发现,位于染色体的1q32区。KISS-1编码的是含有54个氨基酸的蛋白肽metastin,它可以在不抑制原发肿瘤生长的同时抑制转移瘤的形成[7-8]。本研究通过免疫组化ElivisionTM plus法检测261例原发性胃腺癌(gastric adenocarcinoma,GAC)组织中Slug、ZEB1和KISS-1蛋白的表达,并分析它们之间的相互关系以及与GAC浸润、转移及预后的关系。
1 资料和方法 1.1 一般资料回顾性收集蚌埠医学院第一附属医院临床病理科2004年1月~2005年12月存档石蜡包埋GAC组织261例和正常胃黏膜组织80例(术前未行任何抗肿瘤治疗)。所有病例均有完整的临床病理及随访资料,随访至患者死亡或者截止至2013年4月,时间最短为8月,最长为110月。胃腺癌的诊断均经本院病理科证实。GAC患者的临床病理资料参见表 1。
| 表 1 GAC中Slug、ZEB1和KISS-1的表达以及它们与临床各因素之间的关系 Table 1 Correlation of Slug, ZEB1, and KISS-1 expressions with clinicopathological characteristics of patients with GAC |
对照组80例正常胃黏膜组织均取自远离GAC肿块>5.0 cm,且在病理科经H & E.染色证实为正常胃黏膜组织。
1.2 试剂兔抗人Slug多克隆抗体购自美国Cell Signaling公司;兔抗人ZEB1多克隆抗体和兔抗人KISS-1多克隆抗体购自美国Santa Cruz公司;ElivisionTM plus试剂盒和DAB显色试剂盒均购自福州迈新生物公司。
1.3 实验方法所有标本均给以10%福尔马林溶液固定,石蜡包埋,4 μm厚连续切片,烤片,于相应的溶液中脱蜡至水洗。免疫组化操作步骤根据试剂盒说明书进行。采用已知阳性片作对照,PBS液替代一抗作空白对照。
1.4 结果判定Slug蛋白主要是以细胞核和浆出现黄色或棕黄色颗粒为阳性;ZEB1蛋白是以细胞核内出现黄色或棕黄色颗粒为阳性;KISS-1蛋白是以细胞浆和膜出现黄色或棕黄色颗粒为阳性。免疫组化标记结果采用二次计分法,见参考文献[9]。最后若积分≥3分为阳性, < 3分为阴性。免疫组化染色结果由两位病理医生通过独立双盲法判定。
1.5 统计分析采用SPSS20.0统计软件包进行统计分析。Slug、ZEB1和KISS-1蛋白表达阳性组与阴性组的生存分析采用Kaplan-Meier法,组间比较采用log-rank检验;多因素分析用COX多因素回归模型进行分析。在GAC肿瘤组织中,Slug、ZEB1和KISS-1蛋白的表达与正常胃黏膜组织、各临床病理参数的相关性采用χ2、Spearman等级相关检验,P < 0.05为差异有统计学意义。
2 结果 2.1 Slug蛋白在GAC组织中的阳性表达及其与临床病理参数的关系对照组中Slug蛋白的阳性表达率为2.5%(2/80),GAC组中其阳性表达率为62.1%(162/261,图 1A),两组之间差异有统计学意义(P < 0.05)。在GAC组中,随着Slug蛋白阳性表达率的升高,肿瘤组织的浸润越深、临床分期越高及越易于发生淋巴结转移(P < 0.05);Slug蛋白的阳性表达与GAC患者的性别、年龄、肿瘤大小、肿瘤位置及分化程度等均无关(P>0.05,表 1)。
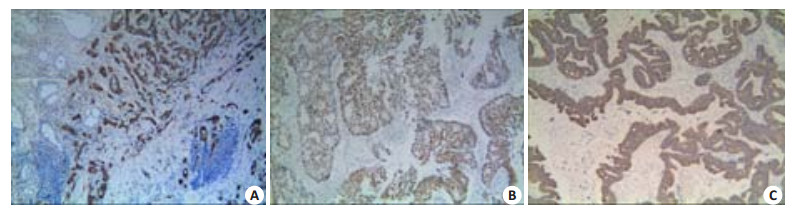
|
图 1 Slug、ZEB1和KISS-1在GAC中的阳性表达 Figure 1 Positive staining of Slug, ZEB1 and KISS-1 in GAC tissues (Elivision, original magnification: ×100). A: Positive staining of Slug in the nuclei and cytoplasm of GAC; B: Positive staining of ZEB1 in the nuclei of GAC; C: Positive staining of KISS-1 in the cytoplasm and on the membrane of GAC. |
ZEB1蛋白在对照组和GAC组中的阳性表达率分别为1.3%(1/80)和29.1%(76/261)(图 1B),两组之间差异有统计学意义(P < 0.05)。随着GAC的分化越差、浸润越深,ZEB1的阳性表达率越高,差异有统计学意义(P < 0.05);ZEB1的阳性表达率与淋巴结转移有关(P < 0.01);在Ⅰ~Ⅱ期GAC患者中ZEB1的阳性表达率为10.7%(13/122),Ⅲ~Ⅳ期患者中其阳性表达率为45.3%(63/139)(表 1),两组之间差异有统计学意义。
2.3 KISS-1蛋白在GAC组织中的阳性表达及其与临床病理参数的关系在GAC组中,KISS-1蛋白的阳性表达率为45.2%(118/261)(图 1C),较对照组中的阳性表达率显著降低,差异有统计学意义(P < 0.05)。KISS-1蛋白的阳性表达与GAC患者的性别、年龄、肿瘤大小、肿瘤位置、分化程度及大体类型等均无关(P>0.05)。随着KISS-1蛋白的阳性表达率降低,GAC肿瘤组织的浸润越深、pTNM分期越高,越易于发生淋巴结转移(P < 0.05,表 1)。
2.4 GAC中Slug、ZEB1和KISS-1蛋白表达之间的相互关系Spearman相关分析显示Slug蛋白与ZEB1蛋白的表达之间呈正相关关系(r=0.153,P=0.013);Slug蛋白与KISS-1蛋白的表达之间呈负相关关系(r=-0.194,P=0.002);ZEB1蛋白与KISS-1蛋白的表达之间呈负相关关系(r=-0.294,P < 0.001,表 2)。
| 表 2 GAC中Slug、ZEB1和KISS-1之间的相互关系 Table 2 Relationship of Slug, ZZEB1 and KISS-1 expressions in GAC |
将GAC组织的分化程度(分为高分化组、中分化组及低分化组)、年龄(分为≥60岁组与 < 60岁组)、肿瘤大小(分为 < 4.0 cm组、4.0 cm≤D < 8.0 cm组及≥8.0 cm组)、肿瘤位置(分为胃窦组、贲门组及幽门组)、性别(分为男性组和女性组)、肿瘤类型(分为息肉组、溃疡组及浸润组)、淋巴结转移(分为转移组与无转移组)、临床病理分期(分为Ⅰ+Ⅱ组和Ⅲ+Ⅳ组)、浸润深度(分为黏膜下组、浆膜下组、浆膜外组及累犯邻近组织组)、Slug表达组(分为阳性组与阴性组)、ZEB1表达组(分为阳性组与阴性组)、KISS-1表达组(分为阳性组与阴性组)等参数引入COX多因素模型进行分析,结果表明Slug、ZEB1和KISS-1蛋白的阳性表达和临床病理分期是影响GAC患者生存的独立预后因素(表 3)。
| 表 3 261例GAC患者的多因素分析 Table 3 Multivariate survival analysis of 261 patients with GAC |
本组病例总的5年生存率为34.9%(91/261)。Kaplan-Meier生存分析显示Slug蛋白阳性表达组的患者总体生存时间明显低于其阴性组患者,差异有统计学意义(P < 0.05,图 2A);ZEB1蛋白阳性表达组的患者总体生存时间明显短于其阴性组患者,差异有统计学意义(P < 0.05,图 2B);KISS-1蛋白阳性表达组的患者总体生存时间明显高于其阴性组患者(P < 0.05,图 2C)。
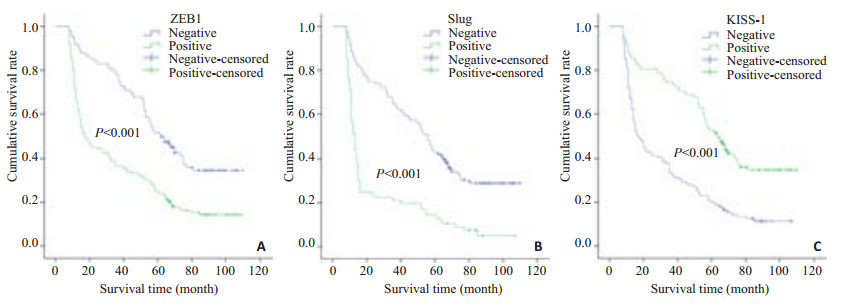
|
图 2 Slug、ZEB1和KISS-1阳性表达组与阴性表达组GAC患者生存曲线 Figure 2 Survival curves of GAC patients with positive or negative expression of Slug (A), ZEB1 (B), and KISS-1 (C). |
EMT是指涉及细胞粘附能力降低和迁徙及间质特征获得的一个复杂的分子和细胞过程。EMT在胚胎发育和创伤恢复等正常生理过程中起着关键作用,同时也被认为与癌症的发生有关系。在癌症发生过程,EMT不仅负责间充质特性(如侵袭和抗凋亡)的获取和维护,同时也赋予部分肿瘤细胞获得干细胞样特性[10]。EMT过程往往意味着肿瘤易于发生局部浸润和远处转移,这已在很多研究中被证实[11-13];且在上皮性恶性肿瘤中发生EMT现象提示患者预后不良。Snail家族成员,如Snail1(即Snail)和Snail2(即Slug)均是EMT过程中的关键调节因子,并且被证实在促进肿瘤细胞转移和癌细胞存活中有显著的作用[14]。Slug可以通过抑制p53介导的细胞凋亡和肿瘤细胞获得干细胞特性而使肿瘤细胞产生抵抗放化疗特性[15]。本研究通过免疫组织化学ElivisionTM plus法检测261例GAC组织中Slug蛋白的表达,发现其阳性表达率为62.1%,显著高于其正常对照组中的阳性表达率(2.5%),说明Slug的表达异常增高可能参与了GAC的发生。进一步的分析发现随着GAC肿瘤组织的浸润越深、pTNM分期越高,Slug的阳性表达率明显增高,淋巴结转移组中Slug的阳性表达率显著高于其在淋巴结未发生转移的病例中的表达率。Kaplan-Meier生存分析Slug蛋白阳性表达组患者总的生存时间明显短于其阴性组患者。上述结果说明Slug的表达异常增高参与了GAC的进展、浸润及转移,且意味着患者预后不良,与文献报道一致[1-2, 6]。
锌指E盒同源结合蛋白1(Zinc finger E-box binding homeobox protein 1, ZEB1)是ZEB转录因子家族成员之一,其位于人类10号染色体短臂上。ZEB1在肿瘤的作用一方面可以通过下调E-cadherin的表达而增强肿瘤细胞的运动能力,影响EMT的发生和维持[17],另一方面可以通过对miR 200的抑制作用而使肿瘤细胞获得干细胞样特性[18-19]。在本研究中,我们发现ZEB1蛋白在GAC组中的阳性表达率(29.1%)显著高于其在正常对照组中的阳性表达率(1.3%);且随着ZEB1的表达越高,GAC的分化越差、浸润越深、pTNM分期越高及越易于发生淋巴结转移。上述结果说明表达异常增高的ZEB1蛋白可能参与了GAC的发生、发展、浸润及转移等过程;随后的生存分析也显示ZEB1蛋白阳性表达组的患者生存时间短,与其他学者的研究结果相一致[5-6, 20]。
肿瘤转移抑制因子KISS-1基因编码是一个含有54个氨基酸的转移抑素(metastin)的亲水性蛋白,该产物可以抑制肿瘤细胞的增生和分化,并促进凋亡。KISS-1可以抑制多种人体实体肿瘤的转移,但其抑制转移的机制仍然不清楚,可能与其可以抑制肿瘤细胞的运动、减少肿瘤集落的形成以及其它细胞功能的改变有关[7-8, 21]。本实验发现KISS-1蛋白在正常对照组中的阳性表达率为87.5%,而在GAC组中其阳性表达率为45.2%,两组之间差异有统计学意义(P < 0.05)。进一步分析发现随着KISS-1蛋白表达率的降低,GAC肿瘤组织的浸润越深、pTNM分期越高及淋巴结越易于发生转移;生存分析也显示KISS-1蛋白阳性表达组患者的生存时间明显高于其阴性组患者,这些说明KISS-1蛋白的表达降低或缺失可能参与了GAC的发生、发展、浸润及转移,且其表达降低或缺失可能意味着患者预后不良[8, 22-23]。
本实验Spearman相关分析发现在GAC组织中Slug和ZEB1的表达呈正相关关系;KISS-1与Slug和ZEB1的表达均呈负相关关系。Slug和ZEB1均可以通过抑制E-cadherin的表达而促进EMT的发生和维持[1-4],并且EMT的形成可以参与GAC的发生[24]。随着Slug和ZEB1表达的进一步增高,发生EMT的细胞越来越多,GAC细胞之间的黏附力进一步降低甚至消失,而运动能力增强,导致GAC细胞易于侵袭和转移。此时KISS-1蛋白表达的降低或缺失导致其抑制细胞运动能力的降低更进一步促进GAC细胞的侵袭和运动,最终导致GAC细胞的浸润和转移。多因素分析结果表明Slug、ZEB1和KISS-1蛋白的阳性表达以及pTNM分期是影响GAC患者术后生存的独立预后因素。
综上所述,Slug和ZEB1的表达异常增高促进了EMT的发生和维持,并进一步促进了GAC的发生;EMT的发生可能是GAC浸润转移的早期事件,而KISS-1的表达降低或缺失更进一步促进了GAC的浸润和转移,且EMT的形成和KISS-1的表达降低均意味着GAC患者预后不良。因此,早期联合检测Slug、ZEB1和KISS-1蛋白的表达可以作为评价GAC患者浸润、转移及预后的指标之一。
| [1] |
Tuhkanen H, Soini Y, Kosma VM, et al. Nuclear expression of snail in borderline and malignant epithelial ovarian tumors is associated with tumor progression[J].
BMC Cancer,2009, 9 : 289.
DOI: 10.1186/1471-2407-9-289. ( 0) 0)
|
| [2] |
Kim MK, Kim M, Kim H, et al. Expression profiles of epithelialmesenchymal transition-associated proteins in epithelial ovarian carcinoma[J].
Bio Med Res Inter,2014 : 495754.
( 0) 0)
|
| [3] |
Chua HL, Bhat-Nakshatri P, Clare SE, et al. NF-kappa B represses E-cadherin expression and enhances epithelial to mesenchymal transition of mammary epithelial cells:potential involvement of ZEB-1 and ZEB-2[J].
Oncogene,2007, 26 (5) : 711-24.
DOI: 10.1038/sj.onc.1209808. ( 0) 0)
|
| [4] |
Schmalhofer O, Brabletz S, Brabletz T. E-cadherin, beta-catenin, and ZEB1 in malignant progression of cancer[J].
Cancer Metastasis Rev,2009, 28 (1/2) : 151-66.
( 0) 0)
|
| [5] |
Winter JM, Ting AH, Vilardell FA, et al. Absence of E-cadherin expression distinguishes noncohesive from cohesive pancreatic cancer[J].
Clin Cancer Res,2008, 14 (2) : 412-8.
DOI: 10.1158/1078-0432.CCR-07-0487. ( 0) 0)
|
| [6] |
Hashiguchi M, Ueno S, et al. Clinical implication of ZEB-1 and E-cadherin expression in hepatocellular carcinoma(HCC)[J].
BMC Cancer,2013 : 572.
( 0) 0)
|
| [7] |
Jiang Y, Berk M, Singh LS, et al. KiSS1 suppresses metastasis in human ovarian cancer via inhibition of protein kinase C alpha[J].
Clin Exp Metastasis,2005, 22 (5) : 369-76.
DOI: 10.1007/s10585-005-8186-4. ( 0) 0)
|
| [8] |
Chen SQ, Chen ZH, Lin SY, et al. KISS1 methylation and expression as predictors of disease progression in colorectal cancer patients[J].
World J Gastroenterol,2014, 20 (29) : 10071-81.
DOI: 10.3748/wjg.v20.i29.10071. ( 0) 0)
|
| [9] |
Wu S, Yu L, Wang D, et al. Aberrant expression of CD133 in nonsmall cell lung cancer and its relationship to vasculogenic mimicry[J].
BMC Cancer,2012, 12 : 535.
DOI: 10.1186/1471-2407-12-535. ( 0) 0)
|
| [10] |
Mani SA, Guo W, Liao MJ, et al. The epithelial-msenchymal transition generates cells with properties of stem cells[J].
Cell,2008, 133 (4) : 704-15.
DOI: 10.1016/j.cell.2008.03.027. ( 0) 0)
|
| [11] |
Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition[J].
J Clin Invest,2009, 119 (6) : 1420-8.
DOI: 10.1172/JCI39104. ( 0) 0)
|
| [12] |
Acloque H, Adams MS, Fishwick K, et al. Epithelial-mesenchymal transitions:the importance of changing cell state in development and disease[J].
J Clin Invest,2009, 119 (6) : 1438-49.
DOI: 10.1172/JCI38019. ( 0) 0)
|
| [13] |
Thiery JP, Acloque H, Huang RY, et al. Epithelial-Mesenchymal transitions in development and disease[J].
Cell,2009, 139 (5) : 871-90.
DOI: 10.1016/j.cell.2009.11.007. ( 0) 0)
|
| [14] |
Vergara D, Merlot B, Lucot JP, et al. Epithelial-mesenchymal transition in ovarian cancer[J].
Cancer Lett,2010, 291 (1) : 59-66.
DOI: 10.1016/j.canlet.2009.09.017. ( 0) 0)
|
| [15] |
Kurrey NK, Jalgaonkar SP, Joglekar AV, et al. Snail and slug mediate radioresistance and chemoresistance by antagonizing p53-mediated apoptosis and acquiring a stem-like phenotype in ovarian cancer cells[J].
Stem Cells,2009, 27 (9) : 2059-68.
DOI: 10.1002/stem.v27:9. ( 0) 0)
|
| [16] |
Tomizawa Y, Wu TT, Wang KK. Epithelial mesenchymal transition and cancer stem cells in esophageal adenocarcinoma originating from Barrett's esophagus[J].
Oncol Lett,2012, 3 (5) : 1059-63.
( 0) 0)
|
| [17] |
Vandewalle C, Van Roy F, Berx G. The role of the ZEB family of transcription factors in development and disease.Cell Mol[J].
Life Sci,2009, 66 (5) : 773-87.
( 0) 0)
|
| [18] |
Brabletz S, Brabletz T. The ZEB/miR-200 feedback loop-a motor of cellular plasticity in development and cancer?[J].
EMBO Rep,2010, 11 (9) : 670-7.
DOI: 10.1038/embor.2010.117. ( 0) 0)
|
| [19] |
Radisky DC. miR-200c at the nexus of epithelial-mesenchymal transition, resistance to apoptosis, and the breast cancer stem cell phenotype[J].
Breast Cancer Res,2011, 13 (3) : 110.
DOI: 10.1186/bcr2885. ( 0) 0)
|
| [20] |
Peinado H, Olmeda D, Snail CA. Zeb and bHLH factors in tumor progression:an alliance against the epithelial phenotype?[J].
Nat Rev Cancer,2007, 7 (6) : 415-28.
DOI: 10.1038/nrc2131. ( 0) 0)
|
| [21] |
Navenot JM, Fujii N, Peiper SC. KiSS1 metastasis suppressor gene product induces suppression of tyrosine kinase receptor signaling to Akt, tumor necrosis factor family ligand expression, and apoptosis[J].
Mol Pharmacol,2009, 75 (5) : 1074-83.
DOI: 10.1124/mol.108.054270. ( 0) 0)
|
| [22] |
Wang HH, Jones J, Turner T, et al. Clinical and biological significance of KISS1 expression in prostate cancer[J].
Am J Pathol,2012, 180 (3) : 1170-8.
DOI: 10.1016/j.ajpath.2011.11.020. ( 0) 0)
|
| [23] |
Ulasov IV, Kaverina NV, Pytel P, et al. Clinical significance of KISS1 protein expression for brain invasion and metastasis[J].
Cancer,2012, 118 (8) : 2096-105.
DOI: 10.1002/cncr.v118.8. ( 0) 0)
|
| [24] |
Sato M, Shames DS, Hasegawa Y. Emerging evidence of epithelialto-mesenchymal transition in lung carcinogenesis[J].
Respirology,2012, 17 (7) : 1048-59.
DOI: 10.1111/res.2012.17.issue-7. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
