2. 南方医科大学 口腔医学院, 广东 广州 510515
2. College of Stomatology, Southern Medical University, Guangzhou 510515, China
牙周病是造成成人牙齿缺失的主要病因。大量的实验研究、流行病学资料和临床观察证明,牙周病是菌斑微生物引起的感染性疾病。菌斑微生物是引发牙周病的始动因子,是造成牙周组织破坏的必需因素。牙龈卟啉单胞菌(Porphyromonas gingivalis, P. gingivalis)是最常见的,且目前公认的牙周致病菌之一[1-6]。
研究表明[7-12],P. gingivalis可以附着在颊粘膜、牙周袋上皮细胞以及通过细菌的共聚作用附着于菌斑中其他细菌的表面;可以产生牙龈素、胶原酶、脂多糖(LPS)等毒力因子对牙周组织产生破坏作用,使附着丧失、牙槽骨吸收增加,最终造成牙齿松动脱落;此外P. gingivalis还可以侵入到宿主细胞内,使得其自身可以逃避宿主的先天性免疫防御。侵入宿主细胞内的P. gingivalis不但可以在细胞内长期生存,还能通过细胞间桥扩散感染临近细胞[13]。目前关于牙龈卟啉单胞菌对牙周炎发生发展的作用机制尚未完全阐明。以往的研究[14-17]主要针对牙龈卟啉单胞菌的某一致病因子对牙周组织或细胞的作用来探讨其致病机制,但由于寄居在宿主体内的细菌多是以活体状态存在,而细菌的某些毒力因子,如脂多糖只有当细菌死亡溶解或用人工方法破坏菌细胞后才释放出来,因此对于细菌单一组分在疾病中作用的研究并不能反应疾病的真实状态,而且也有相关研究表明,活体P. gingivalis与其毒力因子组分在宿主细胞中所引发的反应并不完全一致[18-19]。
本研究通过探讨寄居在人牙周膜细胞内的活体P. gingivalis对细胞的增殖、成骨分化等生物学性能的影响,为牙周炎发病机制的研究提供相关实验依据。
1 材料和方法 1.1 实验细菌P. gingivalis ATCC 33277菌株(Microbiologics公司,美国)
1.2 主要试剂及仪器脑心浸液肉汤培养基(Brain Heart Infusion Broth,BHI,山东,海博),氯化血红素(Sigma,美国),维生素K(Sigma,美国),无菌脱纤维绵羊血(广州蕊特生物科技有限公司),CFDA-SE细胞增殖与示踪检测试剂盒(碧云天,上海),胎牛血清(FBS)(Corning,美国)、DMEM培养基(Corning,美国),RNAiso Plus(TaKaRa公司,日本),逆转录试剂盒(TaKaRa公司,日本),荧光定量PCR试剂盒(Roche,瑞士),三氯甲烷(华大,广东),无水乙醇(华大,广东),异丙醇(华大,广东),地塞米松(Sigma,美国),维生素C(Sigma,美国),β-甘油磷酸钠(Sigma,美国),SYTO9(Invitrogen,美国),牛血清白蛋白(BSA)(sigma,美国),Triton(Takara,日本),Alexa Fluor ®594 Phalloidin(Invitrogen,美国)。
Anoxomat MarkII厌氧微需氧培养系统(MART,荷兰),电子天平(Sartorius, 德国),倒置相差显微镜及照相系统(Olympus,日本),生物安全柜(上海振阳设备有限公司),离心机(Thermo,美国),流式细胞仪(BD FACSCalibur,美国),罗氏L480实时荧光定量PCR仪(Roche,瑞士)。
1.3 人牙周膜细胞体外培养取南方医科大学南方医院口腔科12~25岁因正畸减数治疗需要,拔除的牙周组织健康患者的前磨牙,牙齿拔出后立即放置于100 U/mL青霉素、100 μg/mL链霉素的DMEM培养基中,冰上放置转移至实验室,无菌PBS缓冲液冲洗3遍,无菌湿润条件下刮取根中1/3的牙周膜组织,利用组织块酶消化法原代培养hPDLCs [20]。一般原代培养1周左右,可见细胞从组织块周围游出。待细胞生长汇合达70%~80%时,进行传代、鉴定之后用于后续的实验研究。
1.4 牙龈卟啉单胞菌培养将P. gingivalis ATCC33277复苏后接种于BHI羊血琼脂培养基(含50 mL/L脱纤维羊血、5 mg/L氯化血红素和1 mg/L维生素K3),37 ℃厌氧培养(80%N2、10% CO2、10%H2)。
1.5 牙龈卟啉单胞菌对人牙周膜细胞侵袭效能的比较研究使用SYTO9按照产品说明标记牙龈卟啉单胞菌,加入到人牙周膜细胞中共培养24 h后,细胞用PBS清洗2次,4%多聚甲醛固定10 min,PBS洗涤2~3次,每次10 min,0.1%Triton透化处理10 min,PBS洗涤2~3次,每次10 min,加入1 mL 1%BSA孵育20~30 min,滴加适宜浓度的Alexa Fluor®594 Phalloidin对细胞骨架中的F-actin进行染色,避光,室温孵育20 min,PBS洗涤3次,每次5 min,使用DAPI对细胞核进行复染,PBS洗涤3次,每次5 min,激光共聚焦显微镜下观察。
应用细胞侵袭实验检测P. gingivalis对hPDLCs的侵袭效能[21]。将4~10代人牙周膜细胞于实验前24 h以2× 105/孔的密度接种于24孔板中,24 h后,将P. gingivalis以MOI为10(2×106个)和100(2×107个)加入到人牙周膜细胞中,常规培养90 min、8、24 h后,PBS洗涤细胞并加入100 μg/mL甲硝唑和300 μg/mL庆大霉素联合作用60 min,杀死未侵入细胞内的细菌;加入1 mL/孔无菌蒸馏水继续培养30 min,使细胞溶解破坏,5 000 r/min,离心15 min,将获得的沉淀物用少量BHI培养基重悬,涂布于含有5 mg/L氯化血红素、1 mg/L维生素K3和50 mL/L脱纤维羊血的BHI羊血琼脂培养板上,37 ℃厌氧培养14 d。设立对照组,对照组中没有细胞,每孔仅含有2×108个细菌,加入100 μg/mL甲硝唑和300 μg/mL庆大霉素联合作用60 min后,将菌液涂板,厌氧培养14 d。
取第4~10代人牙周膜细胞,用SYTO9标记P. gingivalis,以MOI为10加入人牙周膜细胞中共培养24 h,使用流式细胞术进行检测。
1.6 牙龈卟啉单胞菌对人牙周膜细胞增殖能力的影响取第4~10代人牙周膜细胞,用CFDA-SE标记后接种与培养皿中,24 h后对照组更换培养基,实验组加入含有MOI为10的牙龈卟啉单胞菌的培养基,共培养0、8、24、48、72 h后,流式细胞仪检测细胞增殖性能的改变。
1.7 牙龈卟啉单胞菌对人牙周膜细胞成骨分化作用的影响取第4~10代人牙周膜细胞,用SYTO9标记P. gingivalis,以MOI为10加入人牙周膜细胞中共培养24 h,使用FACS分选出被感染的牙周膜细胞,常规培养。将分选出的P. gingivalis感染细胞和正常牙周膜细胞,用RNAiso Plus裂解,按照Takara产品说明提取总RNA,分光光度计测定RNA浓度和纯度。以总RNA为模板,使用PrimerScript RT reagent Kit试剂盒进行逆转录。qRT-PCR检测Runx2基因在对照组与P. gingivalis感染组人牙周膜细胞中的表达。所用引物序列如表 1所示。反应条件为:95 ℃ 5min(预变性);95 ℃ 10 s(变性);60 ℃ 20 s(退火);72 ℃ 20 s(延伸);变性、退火、延伸共45个循环。
| 表 1 Runx2及GAPDH引物序列及大小 Table 1 Primer sequence and product size of Runx2 and GAPDH |
将分选出的P. gingivalis感染细胞和正常牙周膜细胞分别以1×105/孔的密度接种于6孔板中,正常牙周膜细胞作为对照组;24 h后,将培养基更换为含有0.1 μmol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 μmol/L抗坏血酸和10%FBS的DMEM培养基,即矿化诱导培养基;矿化诱导7、14、21 d,茜素红染色法检测HPDLCs形成矿化结节的能力。
1.8 统计学分析SPSS16.0统计软件进行相关数据分析。两组间比较采用独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 牙龈卟啉单胞菌对人牙周膜细胞侵袭效能的比较激光共聚焦显微镜下观察结果显示:以MOI为10的P. gingivalis感染人牙周膜细胞24 h后,被SYTO9标记的呈现绿色荧光的P. gingivalis位于人牙周膜细胞的胞浆内,且主要分布在核周(图 1)。
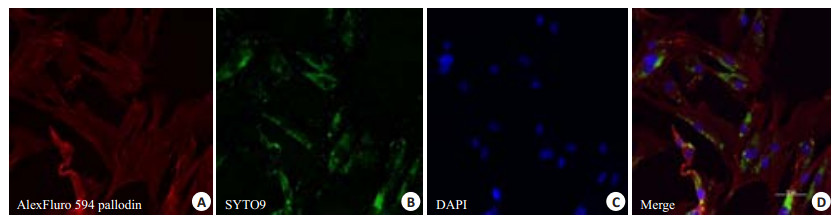
|
图 1 牙龈卟啉单胞菌侵入人牙周膜细胞内 Figure 1 P. gingivalis invaded human periodontal ligament cells after co-culture for 24 h. A: Alex Fluro594 polloidin-labeled F-actin (Red fluorescence); B: SYTO9-labeled P. gingivalis (green fluorescence); C: DAPI-labeled cell nucleus (blue fluorescence); D: Merged image. |
流式细胞仪检测被P. gingivalis感染的HPDLCs(图 2),结果显示,与P. gingivalis共培养24 h后,超过90%的牙周膜细胞都被P. gingivalis侵入。细胞裂解物涂板厌氧培养结果显示:对照组的培养皿上未见菌落形成,说明该浓度的抗生素可有效杀灭未侵入细胞内的细菌(图 3A)。P. gingivalis与HPDLCs共培养90 min后即可侵袭入细胞内(图 3B、C);共培养8 h(图 4)及24 h(图 5),进入细胞内的细菌明显增多,且24 h侵袭量达到最大。而MOI=10及100,进入细胞内的细菌数肉眼上观没有明显差别。
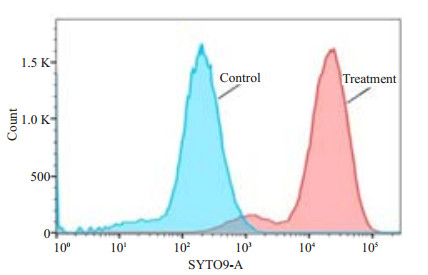
|
图 2 流式细胞检测被P. gingivalis感染的HPDLCs Figure 2 Analysis of invasion efficiency of P. gingivalis in HPDLCs by flow cytometry. The invasion efficiency of P. gingivalis was expressed as the percentage of fluorescent cells. |

|
图 3 P. gingivalis与HPDLCs共培养90 min形成的菌落数 Figure 3 Ability of P. gingivalis to invade HPDLCs tested with antibiotic protection assay at MOI of 10 and 100. P.gingivalis and HPDLCs were co-cultured for 90 min. The survival of internalized P. gingivalis cells was further analyzed by in vitro treatment with metronidazole and gentamicin and by anaerobic culture viability counts. A: Control Group; B: MOI 10; C: MOI 100. |
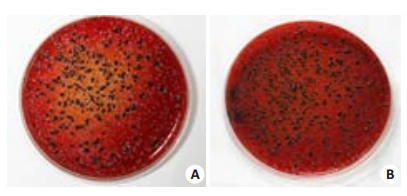
|
图 4 P. gingivalis与HPDLCs共培养8 h形成的菌落数 Figure 4 Ability of P. gingivalis to invade HPDLCs after co-culture for 8 h tested with antibiotic protection assay at MOI of 10 (A) and 100 (B). |

|
图 5 P. gingivalis与HPDLCs共培养24 h形成的菌落数 Figure 5 Ability of P. gingivalis to invade HPDLCs after co-culture for 24 h tested with antibiotic protection assay at MOI of 10 (A) and 100 (B). |
流式细胞仪检测结果显示:对照组和P. gingivalis感染组在培养8、24、48、72 h后,细胞CFSE荧光强度基本一致,除少量自增殖外,没有发生明显的增殖改变,表现为一个主要单峰(图 6),说明P. gingivalis入侵HPDLCs后,并未对细胞的增殖产生明显影响。
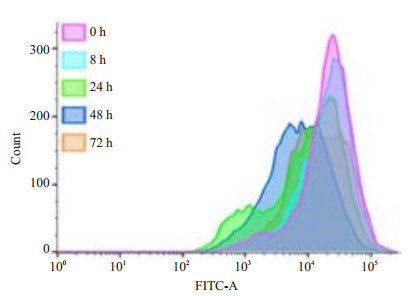
|
图 6 流式细胞仪检测对HPDLCs增殖性能的影响 Figure 6 Analysis of the cell proliferation of P. gingivalis-infected HPDLCs by flow cytometry. |
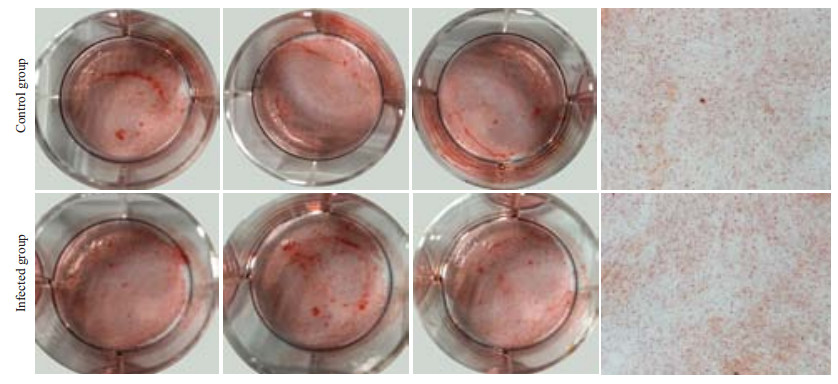
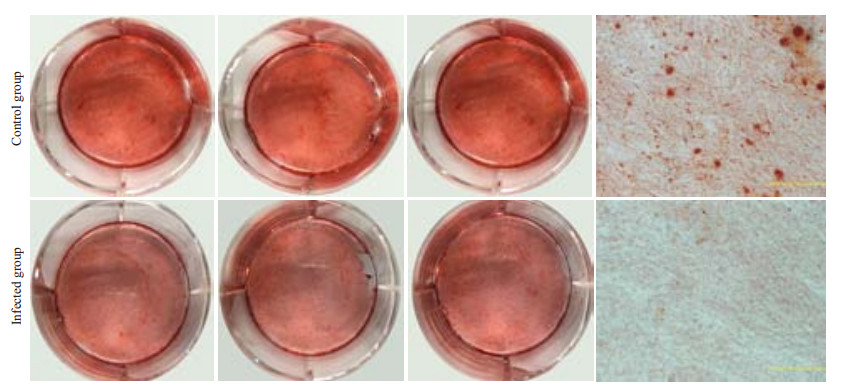
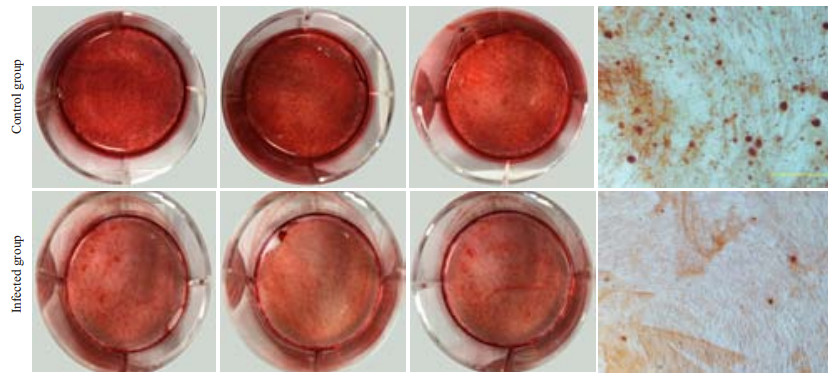
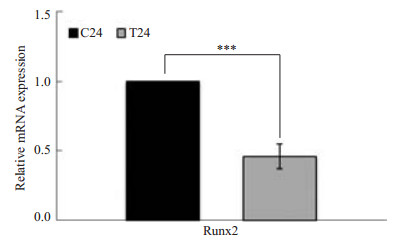
用流式活细胞分选将被感染的细胞分选出来后,进行矿化诱导实验。矿化诱导7、14、21 d,茜素红染色结果显示:对照组及实验组成骨诱导7 d后(图 7),均未形成明显的矿化结节;成骨诱导14 d后(图 8),对照组中形成少量矿化结节,实验组中未见明显的矿化结节;成骨诱导21 d后(图 9),对照组中出现较多的矿化结节,而实验组中仅可见少量结节形成。实时荧光定量PCR结果显示,实验组与矿化相关的Runx2基因明显下调(图 10),且结果差异具有统计学意义(P=0.0004)。
|
图 7 茜素红染色法检测hPDLCs矿化结果(7 d) Figure 7 Mineralized nodules in HPDLCs after 7 days of osteogenic induction (Alizarin red S staining). |
|
图 8 茜素红染色法检测hPDLCs矿化结果(14 d) Figure 8 Mineralized nodules in HPDLCs after 14 days of osteogenic induction (Alizarin red S staining). |
|
图 9 茜素红染色法检测hPDLCs矿化结果(21 d) Figure 9 Mineralized nodules in HPDLCs after 21 days of osteogenic induction (Alizarin red S staining). |
|
图 10 对照组及实验组中Runx2基因mRNA的表达 Figure 10 Runx2 mRNA expression in control and infected HPDLCs detected by quantitative reverse transcriptase PCR. ***P < 0.001. |
牙龈卟啉单胞菌在牙周炎的致病中起到了重要作用,例如其脂多糖和菌毛蛋白可促进炎症因子的生成[22],荚膜多糖有助于细菌逃逸先天免疫系统[23]等等。Pathirana等[18]学者认为,完整的活体P. gingivalis对宿主的作用与其释放的毒力因子不同,甚至激活的细胞内通路以及释放的细胞因子也不甚相同。
本研究中我们将活体的P. gingivalis与人牙周膜细胞共培养,90 min即可看到P. gingivalis侵入细胞。荧光染色的结果显示,侵入细胞的P. gingivalis位于胞浆中;细胞侵袭实验和流式分析的结果显示,共培养24 h后,P. gingivalis的侵袭效率超过了90%。但是P. gingivalis的入侵并未对细胞的增殖产生明显的影响。Zhang等[24]学者将牙龈卟啉单胞菌与人主动脉平滑肌细胞(AoSMCs)共培养,发现P. gingivalis可以通过激活Notch信号通路促进AoSMCs的增殖。这些结果都表明,P. gingivalis寄生在宿主细胞内,并不会抑制细胞的正常生长。
牙周膜细胞是牙周膜的主要成分之一,其中含有未分化的间充质细胞,其具有分化功能,能进一步分化为成纤维细胞、成骨细胞和成牙骨质细胞,在维持牙周组织稳定及牙周组织再生中发挥了重要的作用[25]。P. gingivalis感染牙周膜细胞后,明显抑制了牙周膜细胞的成骨分化能力,实验结果显示,被P. gingivalis侵入的牙周膜细胞矿化结节的形成明显减少。而且P. gingivalis感染组,其成骨细胞分化的主控基因(master gene)Runx2的表达明显低于对照组。已有实验广泛证明[26],P. gingivalis的脂多糖、菌毛蛋白等组分可通过TLR(Toll-like receptor)激活NF-κB等信号途径,促进成纤维细胞以及树突状细胞、巨噬细胞等免疫细胞释放IL-1β,TNF-α等前炎症因子,而这些前炎症因子可以促进破骨细胞的分化,从而造成牙槽骨的吸收增加[17, 27-30]。Runx2是成骨细胞分化的早期决定性转录因子及体内成骨的必需转录因子。Runx2基因敲除的小鼠将无法形成矿化的骨骼系统而发生围产期死亡现象[31]。本研究的结果显示,活体P. gingivalis侵入细胞后,不但可以在细胞内生存,而且可以通过下调Runx2抑制牙周膜细胞的成骨向分化。这可能是导致牙周病发病过程中成骨与破骨失衡的原因之一。Wang等[32]的研究显示,P. gingivalis的脂类可以下调成骨细胞中Runx2的表达,并且抑制成骨细胞的分化及功能;Uehara等[33]的研究发现脂多糖可以诱导Runx2 DNA的超甲基化,从而抑制Runx2的转录;Bandow等[34]的研究则表明,脂多糖所引起的成骨细胞功能抑制是MyD88依赖的。本研究中所显示出的P. gingivalis活体对Runx2基因的下调作用究竟是通过何种途径来实现的,其具体机制仍有待于进一步的研究。
本研究的结果显示,侵袭进入HPDLCs内的P. gingivalis可以在细胞内生存,并可抵御抗生素的杀灭作用;寄生在细胞内的活体P. gingivalis,未对细胞的增殖产生明显的影响,但可以明显抑制细胞的成骨分化作用,这可能是通过下调Runx2的表达来实现的。
| [1] |
Guentsch A, Puklo M, Preshaw PM, et al. Neutrophils in chronic and aggressive periodontitis in interaction with Porphyromonas gingivalis and Aggregatibacter actinomycetemcomitans[J].
J Periodontal Res,2009, 44 (3) : 368-77.
DOI: 10.1111/jre.2009.44.issue-3. ( 0) 0)
|
| [2] |
Benrachadi L, Bouziane A, Azziman Z, et al. Screening for periodontopathogenic bacteria in severe chronic periodontitis in a Moroccan population[J].
Med Mal Infect,2012, 42 (12) : 599-602.
DOI: 10.1016/j.medmal.2012.10.003. ( 0) 0)
|
| [3] |
Zhang W, Ju J, Rigney T, et al. Porphyromonas gingivalis infection increases osteoclastic bone resorption and osteoblastic bone formation in aperiodontitis mouse model[J].
BMC Oral Health,2014, 15 (14) : 89.
( 0) 0)
|
| [4] |
Kaman WE, Galassi F, De Soet JJ, et al. Highly specific ProteaseBased approach for detection of porphyromonas gingivalis in diagnosis of periodontitis[J].
J Clin Microbiol,2012, 50 (1) : 104-12.
DOI: 10.1128/JCM.05313-11. ( 0) 0)
|
| [5] |
Martande SS, Pradeep AR, Kumari MA, et al. Clinical and microbiological efficacy of systemic roxithromycin as an adjunct to non-surgical periodontal therapy in treatment of chronic periodontitis. A randomized, double-blinded, placebo-controlled clinical trial[J].
Am J Dent,2015, 28 (3) : 137-42.
( 0) 0)
|
| [6] |
Schmidt J, Jentsch H, Stingu CS, et al. General immune status and oral microbiology in patients with different forms of periodontitis and healthy control subjects[J].
PLoS One,2014, 9 (10) : e109187.
DOI: 10.1371/journal.pone.0109187. ( 0) 0)
|
| [7] |
Jain S, Darveau RP. Contribution of porphyromonas gingivalis lipopolysaccharide to periodontitis[J].
Periodontol 2000,2010, 54 (1) : 53-70.
DOI: 10.1111/j.1600-0757.2009.00333.x. ( 0) 0)
|
| [8] |
Shaddox LM, Goncalves PF, Vovk A, et al. LPS-induced inflammatory response after therapy of aggressive periodontitis[J].
J Dent Res,2013, 92 (8) : 702-8.
DOI: 10.1177/0022034513495242. ( 0) 0)
|
| [9] |
Goelz L, Memmert S, Rath-Deschner B, et al. LPS from P. gingivalis and hypoxia increases oxidative stress in periodontal ligament dibroblasts and xontributes to periodontitis[J].
Mediators Inflamm,2014 : 986264.
( 0) 0)
|
| [10] |
Fleetwood AJ, O'brien-Simpson NM, Veith PD, et al. Porphyromonas gingivalis-derived RgpA-Kgp complex activates the macrophage urokinase plasminogen activator system implications for periodontitis[J].
J Biol Chem,2015, 290 (26) : 16031-42.
DOI: 10.1074/jbc.M115.645572. ( 0) 0)
|
| [11] |
De Diego I, Veillard F, Sztukowska MN, et al. Structure and mechanism of cysteine peptidase gingipain K (Kgp), a major virulence factor of porphyromonas gingivalis in periodontitis[J].
J Biol Chem,2014, 289 (46) : 32291-302.
DOI: 10.1074/jbc.M114.602052. ( 0) 0)
|
| [12] |
Baek KJ, Ji S, Kim YC, et al. Association of the invasion ability of Porphyromonas gingivalis with the severity of periodontitis[J].
Virulence,2015, 6 (3, SI) : 274-81.
DOI: 10.1080/21505594.2014.1000764. ( 0) 0)
|
| [13] |
Yilmaz O, Verbeke P, Lamont RJ, et al. Intercellular spreading of Porphyromonas gingivalis infection in primary gingival epithelial cells[J].
Infect Immun,2006, 74 (1) : 703-10.
DOI: 10.1128/IAI.74.1.703-710.2006. ( 0) 0)
|
| [14] |
张瑞, 孙卫斌. 牙龈素在牙龈卟啉单胞菌生长及牙周致病过程中的作用[J].
口腔生物医学,2014, 5 (2) : 100-2.
( 0) 0)
|
| [15] |
方厂云, 苏征, 陈蕾, 等. 牙龈卟啉单胞菌脂多糖对人牙周膜成纤维细胞胶原吞噬作用的影响[J].
华西口腔医学杂志,2007, 25 (4) : 339-41.
( 0) 0)
|
| [16] |
罗丽, 张纲, 祝金香, 等. 牙龈卟啉单胞菌免疫逃避机制研究进展[J].
免疫学杂志,2012, 28 (4) : 359-62.
( 0) 0)
|
| [17] |
Goelz L, Memmert S, Rath-Deschner B, et al. LPS from P. gingivalis and hypoxia increases oxidative stress in periodontal ligament fibroblasts and contributes to periodontitis[J].
Mediators Inflamm,2014 : 986264.
( 0) 0)
|
| [18] |
Pathirana RD, O'Brien-Simpson NM, Reynolds EC. Host immune responses to Porphyromonas gingivalis antigens[J].
Periodontology,2010, 52 (1) : 218-37.
DOI: 10.1111/(ISSN)1600-0757. ( 0) 0)
|
| [19] |
Zhou Q, Desta T, Fenton M, et al. Cytokine profiling of macrophages exposed to Porphyromonas gingivalis, its lipopolysaccharide, or its FimA protein[J].
Infect Immun,2005, 73 (2) : 935-43.
DOI: 10.1128/IAI.73.2.935-943.2005. ( 0) 0)
|
| [20] |
麻丹丹, 高杰, 吴补领. 改良组织块酶消化法培养人龋损牙髓干细胞的实验研究[J].
牙体牙髓牙周病学杂志,2011 (7) : 371-4.
( 0) 0)
|
| [21] |
Irshad M, Van Der Reijden WA, Crielaard WA. In vitro invasion and survival of porphyromonas gingivalis in gingival fibroblasts; role of the capsule[J].
Arch Immunol Ther Exp (Warsz),2012, 60 (6) : 469-76.
DOI: 10.1007/s00005-012-0196-8. ( 0) 0)
|
| [22] |
Hamedi M, Belibasakis GN, Cruchley AT, et al. Porphyromonas gingivalis culture supernatants differentially regulate interleukin-1 beta and interleukin-18 in human monocytic cells[J].
Cytokine,2009, 45 (2) : 99-104.
DOI: 10.1016/j.cyto.2008.11.005. ( 0) 0)
|
| [23] |
Brunner J, Scheres N, El Idrissi NB, et al. The capsule of Porphyromonas gingivalis reduces the immune response of human gingival fibroblasts[J].
BMC Microbiol,2010, 10 (5) : 1-11.
( 0) 0)
|
| [24] |
Zhang BX, Elmabsout AA, Khalaf H, et al. The periodontal pathogen Porphyromonas gingivalis changes the gene expression in vascular smooth muscle cells involving the TGFbeta/Notch signalling pathway and increased cell proliferation[J].
BMC Genomics,2013, 14 : 770.
DOI: 10.1186/1471-2164-14-770. ( 0) 0)
|
| [25] |
谷子芽, 李颖, 张文元, 等. 几种胚胎干细胞标志在牙周膜细胞中的表达及意义[J].
口腔医学,2013, 33 (12) : 796-800.
( 0) 0)
|
| [26] |
Nanes MS. Tumor necrosis factor-alpha:molecular and cellular mechanisms in skeletal pathology[J].
Gene,2003, 321 : 1-15.
DOI: 10.1016/S0378-1119(03)00841-2. ( 0) 0)
|
| [27] |
Suffredini A F, Reda D, Banks S M, et al. Effects of recombinant dimeric TNF receptor on human inflammatory responses following intravenous endotoxin administration[J].
J Immunol,1995, 155 (10) : 5038-45.
( 0) 0)
|
| [28] |
Takahashi K, Takashiba S, Nagai A, et al. Assesement of interleukin-6 in the pathogenesis of periodontal disease[J].
Periodontol,1994, 65 (2) : 147-53.
DOI: 10.1902/jop.1994.65.2.147. ( 0) 0)
|
| [29] |
Montes AH, Asensi V, Alvarez V, et al. The toll-like receptor 4(asp299Gly) polymorphism is a risk factor for gram-negative and haematogenous osteomyelitis[J].
Clin Exp Immunol,2006, 143 (3) : 404-13.
DOI: 10.1111/cei.2006.143.issue-3. ( 0) 0)
|
| [30] |
Kanami I, Nobuyuki U, Kanichiro K, et al. Lipopolysaccharide promotes the survival of osteoclasts via Toll-like receptor 4, but cytokine production of osteoclasts in response to lipopolysaccharide is different from that of macrophages[J].
J Immunol,2003, 170 (7) : 3688-95.
DOI: 10.4049/jimmunol.170.7.3688. ( 0) 0)
|
| [31] |
Komori T, Yagi H, Nomura S, et al. Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts[J].
Cell,1997, 89 (5) : 755-64.
DOI: 10.1016/S0092-8674(00)80258-5. ( 0) 0)
|
| [32] |
Wang YH, Jiang J, Zhu Q, et al. Porphyromonas gingivalis lipids inhibit osteoblastic differentiation and function[J].
Infect Immun,2010, 78 (9) : 3726-35.
DOI: 10.1128/IAI.00225-10. ( 0) 0)
|
| [33] |
Uehara O, Abiko Y, Saitoh M, et al. Lipopolysaccharide extracted from Porphyromonas gingivalis induces DNA hypermethylation of runt-related transcription factor 2 in human periodontal fibroblasts[J].
J Microbiol Immunol Infec,2014, 47 (3) : 176-81.
DOI: 10.1016/j.jmii.2012.08.005. ( 0) 0)
|
| [34] |
Bandow K, Maeda A, Kakimoto K, et al. Molecular mechanisms of the inhibitory effect of lipopolysaccharide (LPS) on osteoblast differentiation[J].
Biochem Biophys Res Commun,2010, 402 (4) : 755-61.
DOI: 10.1016/j.bbrc.2010.10.103. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
