2. 佛山市顺德区龙江医院男科, 广东 佛山 528318
2. Department of Andrology, Shunde Longjiang Hospital, Southern Medical University, Foshan 528318, China
膀胱病理变化引起的下尿路症状是糖尿病在泌尿系统的常见并发症之一[1]。由于其发病机制尚不明确[2],临床上常以控制血糖和对症治疗为主,疗效因糖尿病血糖控制情况和膀胱病理变化程度存在差异[3]。因此,了解糖尿病对膀胱的影响机制至关重要[1]。膀胱平滑肌细胞可以发生表型转化[4-5]。有研究对膀胱出口梗阻的患者及兔模型取材检测,发现膀胱出口梗阻时膀胱平滑肌存在表型转化,提示膀胱平滑肌表型转化参与了膀胱出口梗阻后膀胱功能障碍发病的病理生理机制[6-7]。然而,糖尿病是否引起膀胱平滑肌表型转化,目前还未见相关报道。本研究拟通过构建糖尿病大鼠膀胱模型,利用HE染色和Masson's Trichrome染色来初步了解糖尿病膀胱平滑肌的形态结构变化以及平滑肌/纤维比率,同时利用WB和qPT-PCR来了解转录因子myocardin及收缩型表型标志物α-SMA和SMMHC的蛋白和mRNA表达水平,以初步了解糖尿病大鼠模型中膀胱逼尿肌表型转化的情况,并且了解糖尿病引起膀胱逼尿肌发生表型转化的重要分子机制,本研究的创新之处为首次研究糖尿病大鼠模型中膀胱平滑肌的表型转化情况,进一步了解糖尿病所致膀胱功能障碍的发病机制,为糖尿病所致膀胱功能障碍的治疗提供新的靶标。
1 材料和方法 1.1 材料和试剂32只SPF级8周龄体质量200~220 g雄性SD大鼠购自南方医科大学实验动物中心(许可证号:SCXK(粤)2011-0015),饲养在南方医科大学南方医院动物中心SPF级动物房。实验用药和主要试剂:链脲佐菌素(Sigma)60 mg/kg,TRIzol、逆转录试剂盒及SYBR Premix Ex Taq(Takara),Myocardin一抗(Abcam),α-SMA一抗、SMMHC一抗(Santa Cruz)。
1.2 研究方法 1.2.1 链脲佐菌素诱导Ⅰ型糖尿病大鼠模型的建立和取材Ⅰ型糖尿病大鼠模型的建立:按照我们已报道的方法[8],32只SPF级8周龄体质量200~220 g雄性SD大鼠适应性喂养1周后平均随机分成糖尿病组和非糖尿病组。禁食12 h后,糖尿病组大鼠按60 mg/kg体质量一次性腹腔注射链脲佐菌素(streptozotocin, STZ)(60 mg/kg,溶于pH4.5,0.1 mmol/L的柠檬酸-柠檬酸钠缓冲液)建立糖尿病模型。正常组大鼠腹腔注射等量柠檬酸-柠檬酸钠缓冲液作为对照。72 h后取尾静脉血,测定大鼠随机血糖,以大鼠明显消瘦,多饮、多尿,随机血糖水平> 16.6 mmol/L为糖尿病动物建模成功标准[9]。所有的SD大鼠在温度恒定25±1 ℃和光线12 h循环中喂养,定期更换洁净垫料。
SD大鼠膀胱组织的取材:糖尿病组和对照组大鼠在喂养9周后戊巴比妥40 mg/kg腹腔注射麻醉,仰卧固定,耻骨上作约2.0 cm的纵切口显露膀胱,去除输尿管及膀胱浆膜层后取出膀胱,排空尿液并反复用PBS液清洗,剔除膀胱黏膜层,将膀胱组织分成3份,编号,1份放入4%多聚甲醛溶液固定,2份液氮速冻后置于-80 ℃超低温冰箱保存备用。
1.2.2 膀胱组织HE染色和Masson's Trichrome染色 1.2.3 qRT-PCR检测大鼠膀胱中myocardin、α-SMA和SMMHC mRNA表达使用TRIzol提取糖尿病组和正常对照组膀胱组织的总RNA,以各组总RNA为模板,用Takara逆转录试剂盒按照说明行逆转录反应分别合成cDNA第一链,利用SYBR Premix Ex TaqTM II试剂盒在反应体系(20 μL)下进行荧光定量PCR,其反应体系为:SYBR Premix Ex Taq(2×)10.0 μL,正向及反向引物(10 mol/L)各0.8 μL,模板cDNA 2.0 μL,ddH2O补足总体积至20 μL,按以下PCR反应程序进行40个循环:95 ℃变性10 s,57 ℃退火20 s,72 ℃延伸15 s,PCR反应后,仪器自动进行熔解曲线分析。每个样品以GAPDH基因的mRNA表达作为内参照,通过相对定量(2-ΔΔCT)法计算目的基因在各样品中相对mRNA的表达水平。靶基因和内参基因扩增的上下游引物序列(引物均由上海生物工程公司合成)(表 1)。
| 表 1 荧光定量PCR引物序列 Table 1 Primer sequence for real-time PCR |
分别称取糖尿病组和正常对照组膀胱组织,放入装有适量裂解液的匀浆管中,提取全蛋白,按照BCA法测定蛋白浓度,分装,-80 ℃保存。根据目的蛋白分子量配置SDS-PAGE分离胶,每孔上样5~10 μL的蛋白样品进行SDS-PAGE电泳,电转至PVDF膜。5%脱脂奶粉室温封闭1 h,加入抗myocardin(1:400),α-SMA(1:250),SMMHC(1:250),β-actin(1:8000)一抗4 ℃中孵育过夜,TBST漂洗3次后室温孵育二抗1 h,TBST再次漂洗3次后ECL法显色。使用Image J图像分析软件分析条带灰度值,用目的蛋白灰度值/β-actin灰度值代表目的蛋白的相对表达量。
1.2.5 统计学分析采用SPSS 20.0软件进行统计学分析,数据均以均数±标准差表示,两组间差异的比较用两个独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 成功建立链脲佐菌素诱导的Ⅰ型糖尿病大鼠模型初始体质量比较,糖尿病组与正常对照组无明显差异(P>0.05);造模后,糖尿病大鼠较正常组明显消瘦,多饮(P=0.001)、多尿(P=0.001,表 2),造模9周时,糖尿病组体质量比正常对照组明显下降,P=0.001,糖尿病组大鼠出现2只死亡,正常组大鼠无死亡(表 3)。
| 表 2 造模1周后,DM组和NDM组大鼠的日常饮水量与尿量 Table 2 Daily water intake and urine volume in diabetic and control rats at 1 week after modeling |
| 表 3 DM组和NDM组大鼠的初始体质量、造模9周体质量结果 Table 3 Body weight of the rats before and at 9 weeks after modeling |
HE染色,观察糖尿病组与正常对照组的膀胱组织形态结构变化,结果发现(图 1):糖尿病组(A)膀胱平滑肌细胞排列紊乱、细胞外基质沉积,结构松散,而正常对照组(B)膀胱组织平滑肌细胞排列整齐紧密,细胞外充满结缔组织。
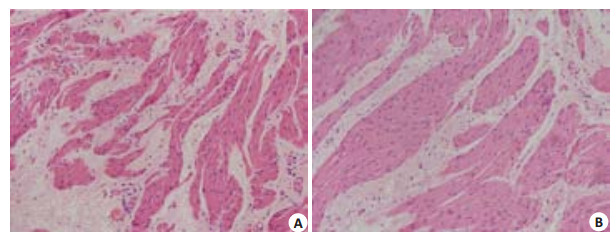
|
图 1 膀胱组织HE染色 Figure 1 HE staining of the bladder tissue of diabetic (A) and control (B) rats (Original magnification, × 200). |
Masson染色,通过分析红/蓝比率间接反映平滑肌肌纤维/胶原纤维比率,从而比较糖尿病性大鼠膀胱平滑肌组织中平滑肌的量与正常对照组大鼠膀胱平滑肌组织中平滑肌的量。结果显示(图 2),与正常对照组(B)比较,糖尿病性大鼠(A)膀胱平滑肌组织中平滑肌肌纤维数量显著减少,细胞外纤维化增多(P < 0.001)。
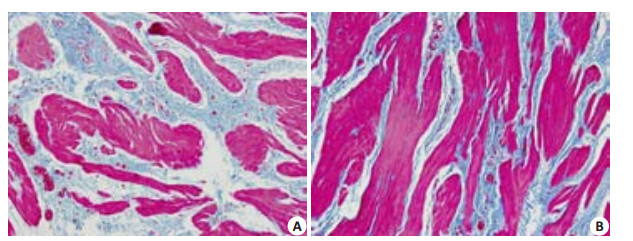
|
图 2 Masson's Trichrome染色 Figure 2 Masson's Trichrome staining of the bladder tissue of diabetic (A) and control (B) rats (Original magnification, ×200). |
造模9周时,DM组膀胱中的myocardin、α-SMA、SMMHC mRNA的表达均较NDM组明显下降,差异均有统计学意义(P < 0.05,表 4)。
| 表 4 DM组和NDM组大鼠膀胱中myocardin、α-SMA和SMMHC mRNA的表达 Table 4 Expression levels of myocardin, α-SMA and SMMHC mRNA in the bladder tissue of diabetic and control rats |
造模9周时,DM组膀胱中的myocardin蛋白的表达(0.131±0.022)比NDM组(0.292±0.10)明显下降,P=0.013。DM组膀胱中的α-SMA(0.637±0.150)比NDM组(1.030±0.152)明显下降,P=0.003。DM组膀胱中的SMMHC蛋白(0.315±0.134)比NDM组(1.844±1.03)明显下降(P=0.019,图 3)。
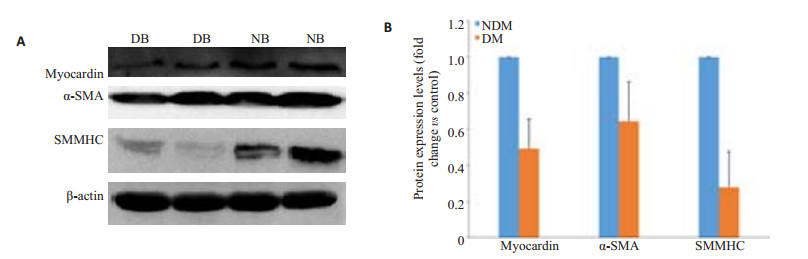
|
图 3 DM组和NDM组大鼠膀胱中myocardin、α-SMA和SMMHC蛋白的表达 Figure 3 Western blotting (A) and expression levels (B) of myocardin, α-SMA and SMMHC proteins in the bladder tissue of diabetic and control rats. DM: Diabetic group; NDM: Control group. |
糖尿病可导致膀胱组织病理结构改变,从而引起膀胱功能紊乱,表现为从膀胱过度活动症至膀胱收缩功能减退的渐进性发病过程,同时伴随着一系列临床症状,如尿频、尿急、膀胱残余尿量增加[10]。目前,糖尿病并发膀胱功能改变的诊断以尿动力学检查结果为基础,治疗目标为缓解症状、预防与治疗泌尿系感染及提高膀胱排空效率,治疗方法包括行为治疗、药物与手术治疗[11]。然而糖尿病对膀胱的影响因素为多方面的,包括膀胱逼尿肌的病理生理改变、调控膀胱功能的神经元损伤、泌尿系上皮功能障碍,因此糖尿病对膀胱的病因影响与病理生理改变尚未明确,故目前对症治疗效果欠佳,需进一步研究糖尿病对膀胱的影响机制[10]。
膀胱内含有丰富的平滑肌组织,正常的平滑肌对维持储尿期的膀胱舒张和排尿期的膀胱收缩至关重要[4-5]。众所周知,血管平滑肌细胞(VSMCs)根据其结构和功能的不同分为收缩型(分化型)和合成型(去分化型或增殖型)两种表型,收缩型VSMCs主要通过表达系列特异的收缩蛋白和骨架蛋白来维持其收缩及调节血管张力的功能,而合成型VSMCs有着细胞增殖、迁移及合成和分泌大量细胞外基质的能力。与骨骼肌细胞和心肌细胞不同,平滑肌细胞具有双向分化功能,在一定条件下收缩型和合成型可以互相转化,其中由收缩型向合成型的转化称为表型转化,其特征是收缩型标记物基因的表达减少同时伴有细胞迁移、增殖的加速以及胞外基质合成的增加[12]。研究证实,在动脉粥样硬化、血管成形术后再狭窄、糖尿病血管并发症、移植肾动脉病变及肿瘤血管发生等增殖性心血管疾病中,VSMCs发生表型转化是这些疾病发生的一个重要的共同病理基础和关键性作用[13]。膀胱平滑肌与血管平滑肌在结构和功能上类似,早在2001年即有文献报道在膀胱出口梗阻的兔动物模型中膀胱平滑肌收缩型表面标志蛋白表达减少,即膀胱平滑肌发生表型转化;解除梗阻后这些标志物表达水平上升,提示收缩型平滑肌的数量是维持和恢复膀胱功能的重要因素[6-7]。随后,众多学者也分别在人膀胱平滑肌细胞(hBSMC)和大鼠膀胱平滑肌细胞上证实BSMC存在表型转化,以及在膀胱出口梗阻动物模型中证实表型转化是膀胱功能障碍的重要病理基础[4-5, 7, 13],而糖尿病是否可以引起膀胱平滑肌发生表型转化,目前还未见报道。
我们课题组长期进行糖尿病泌尿生殖系统并发症的研究,为了明确糖尿病对膀胱组织病理改变的影响及其病理生理机制,我们构建了链脲佐菌素诱导的糖尿病大鼠模型,并根据以往文献报道,选择糖尿病对膀胱组织开始造成损害的9周糖尿病大鼠模型取材[14-15]。HE染色发现糖尿病大鼠膀胱平滑肌细胞排列紊乱、细胞外基质沉积,于是进一步行Masson三色染色,可见糖尿病大鼠膀胱组织内胶原沉积、肌纤维/胶原纤维比值下降,提示糖尿病可以导致膀胱平滑肌细胞功能改变及膀胱组织纤维化。平滑肌细胞发生表型转化时,会从肌束排列整齐、舒缩功能良好的功能状态转变为细胞排列紊乱、舒缩功能差并伴随细胞外基质沉积、组织纤维化的增殖状态[5, 12],糖尿病大鼠的病理变化符合表型转化的特征。
为了进一步从分子水平证实表型转化的存在,我们利用PCR和Western技术检测膀胱组织收缩型平滑肌表面标志物平滑肌肌动蛋白α-SMA和平滑肌肌球蛋白重链SMMHC。肌动蛋白和肌球蛋白是正常收缩型平滑肌的基本结构,α-SMA和SMMHC下降可以反映收缩型平滑肌细胞减少,通常作为平滑肌细胞发生表型转化的特征[16]。在我们的实验中,糖尿病大鼠膀胱平滑肌组织中的α-SMA和SMMHC水平在mRNA和蛋白水平都显著下降,即糖尿病大鼠膀胱平滑肌发生了表型转化。
在众多调控平滑肌细胞表型转化的因素中,myocardin一直是研究热点。myocardin定位于核内,是平滑肌细胞相关基因转录有力的激动子,可与与血清应答因子(SRF)及CArG反应元件形成三元复合物,激活一系列受SRF调控、可编码细胞支架蛋白和收缩相关蛋白的基因转录,从而调控平滑肌细胞表型转化[17-18]。myocardin表达在心脏、胃肠道、膀胱、血管等富含平滑肌的组织[19]。近期有研究myocardin在维持出生后小鼠的血管和内脏平滑肌细胞的增生、转化、细胞内稳态中起重要作用,作者条件敲除myocardin基因可以引起膀胱肌层收缩表型蛋白表达下降,黏膜肌层的破裂和萎缩,膀胱体积扩张,说明myocardin在维持正常平滑肌细胞、富含平滑肌的组织和器官结构及功能中起重要作用[19]。但目前为止尚未见糖尿病性膀胱组织中myocardin变化的报道。我们知道平滑肌细胞发生表型转化时,通常伴随着myocardin的表达下降[18-19]。于是进一步对比了糖尿病组和非糖尿病组大鼠膀胱组织中的myocardin,在基因和蛋白质水平证实了myocardin在糖尿病膀胱平滑肌组织中表达下调。
综上,本研究揭示了糖尿病大鼠膀胱组织的结构和病理改变,证实了糖尿病大鼠膀胱平滑肌发生了表型转化,同时伴随收缩型平滑肌关键调控基因myocardin表达水平下降。本研究存在一些不足之处,例如,糖尿病对膀胱的损害是一个逐渐变化的过程,实验尚需要在更长的时间点动态观察膀胱的病理和分子变化;另外本研究仅在结构和分子水平证实糖尿病膀胱的病理改变和平滑肌表型转化,尚缺乏客观评价膀胱功能的仪器或方法,如小动物尿动力学检测仪;再者,myocardin下降和表型转化是相互作用的,本研究暂未明确二者的因果关系,因此糖尿病性大鼠膀胱平滑肌发生表型转化的具体机制还需要进一步的实验研究。
| [1] |
Brown JS, Wessells H, Chancellor MB, et al. Urologic complications of diabetes[J].
Diabetes Care,2005, 28 (1) : 177-85.
DOI: 10.2337/diacare.28.1.177. ( 0) 0)
|
| [2] |
Yuan Z, Tang Z, He C, et al. Diabetic cystopathy:A review[J].
J Diabetes,2015, 7 (4) : 442-7.
DOI: 10.1111/1753-0407.12272. ( 0) 0)
|
| [3] |
Forbes JM, Cooper ME. Basic mechanisms of diabetic complications[J].
Diabetes Res Clin Pract,1988, 5 (Suppl 1) : S31-4.
( 0) 0)
|
| [4] |
Luo DY, Wazir R, Du C, et al. Magnitude-dependent proliferation and contractility modμLation of human bladder smooth muscle cells under physiological stretch[J].
World J Urol,2015, 33 (11) : 1881-7.
DOI: 10.1007/s00345-015-1509-4. ( 0) 0)
|
| [5] |
Kanematsu A, Ramachandran A, Adam RM. GATA-6 mediates human bladder smooth muscle differentiation:involvement of a novel enhancer element in regμLating alpha-smooth muscle actin gene expression[J].
Am J Physiol Cell Physiol,2007, 293 (3) : C1093-102.
DOI: 10.1152/ajpcell.00225.2007. ( 0) 0)
|
| [6] |
Burkhard FC, Lemack GE, Zimmern PE, et al. Contractile protein expression in bladder smooth muscle is a marker of phenotypic modμLation after outlet obstruction in the rabbit model[J].
J Urol,2001, 165 (3) : 963-7.
DOI: 10.1016/S0022-5347(05)66585-8. ( 0) 0)
|
| [7] |
Yu G, Bo S, Xiyu J, et al. Effect of bladder outlet obstruction on detrusor smooth muscle cell:an in vitro study[J].
J Surg Res,2003, 114 (2) : 202-9.
DOI: 10.1016/S0022-4804(03)00333-0. ( 0) 0)
|
| [8] |
He S, Zhang T, Liu Y, et al. Myocardin restores erectile function in diabetic rats:phenotypic modμLation of corpus cavernosum smooth muscle cells[J].
Andrologia,2015, 47 (3) : 303-9.
DOI: 10.1111/and.2015.47.issue-3. ( 0) 0)
|
| [9] |
Yang R, Wang J, Chen Y, et al. Effect of caffeine on erectile function via up-regμLating cavernous cyclic guanosine monophosphate in diabetic rats[J].
J Androl,2008, 29 (5) : 586-91.
DOI: 10.2164/jandrol.107.004721. ( 0) 0)
|
| [10] |
Daneshgari F, Moore C. Diabetic uropathy[J].
Semin Nephrol,2006, 26 (2) : 182-5.
DOI: 10.1016/j.semnephrol.2005.09.009. ( 0) 0)
|
| [11] |
Golbidi S, Laher I. Bladder dysfunction in diabetes mellitus[J].
Front Pharmacol,2010, 1 (7) : 136.
( 0) 0)
|
| [12] |
Owens GK, Kumar MS, Wamhoff BR. MolecμLar regμLation of vascμLar smooth muscle cell differentiation in development and disease[J].
Physiol Rev,2004, 84 (3) : 767-801.
DOI: 10.1152/physrev.00041.2003. ( 0) 0)
|
| [13] |
Parekh A, Long RA, Iannone EC, et al. Assessing the effects of transforming growth factor-beta1 on bladder smooth muscle cell phenotype. I. Modulation of in vitro contractility[J].
J Urol,209, 182 (3) : 1210-5.
( 0) 0)
|
| [14] |
Daneshgari F, Liu G, Imrey PB. Time dependent changes in diabetic cystopathy in rats include compensated and decompensated bladder function[J].
J Urol,2006, 176 (1) : 380-6.
DOI: 10.1016/S0022-5347(06)00582-9. ( 0) 0)
|
| [15] |
Daneshgari F, Huang X, Liu G, et al. Temporal differences in bladder dysfunction caused by diabetes, diuresis, and treated diabetes in mice[J].
Am J Physiol Regul Integr Comp Physiol,2006, 290 (6) : R1728-35.
DOI: 10.1152/ajpregu.00654.2005. ( 0) 0)
|
| [16] |
陈逢志, 何书华, 单海涛, 等. 血小板源性生长因子-BB对大鼠阴茎海绵体平滑肌细胞增殖、迁移及表型转化的影响[J].
南方医科大学学报,2015, 35 (7) : 971-6.
( 0) 0)
|
| [17] |
Chen J, Kitchen CM, Streb JW, et al. Myocardin:a component of a molecμLar Switch for smooth muscle differentiation[J].
J Mol Cell Cardiol,2002, 34 (10) : 1345-56.
DOI: 10.1006/jmcc.2002.2086. ( 0) 0)
|
| [18] |
Du KL, Ip HS, Li J, et al. Myocardin is a critical serum response factor cofactor in the transcriptional program regμLating smooth muscle cell differentiation[J].
Mol Cell Biol,2003, 23 (7) : 2425-37.
DOI: 10.1128/MCB.23.7.2425-2437.2003. ( 0) 0)
|
| [19] |
Huang J, Wang T, Wright AC, et al. Myocardin is required for maintenance of vascμLar and visceral smooth muscle homeostasis during postnatal development[J].
Proc Natl Acad Sci USA,2015, 112 (14) : 4447-52.
DOI: 10.1073/pnas.1420363112. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
