食管癌是人类常见的恶性肿瘤,在我国其发病率在各类恶性肿瘤中排第5位,死亡率居第4位,严重威胁着人们的生命和健康[1-2]。真核细胞体内的蛋白质降解主要通过自噬和泛素化蛋白酶体系统这两条途径,前者主要降解长寿命蛋白和受损的细胞器,而后者主要降解短寿命蛋白[3]。自噬对于维持蛋白质代谢及细胞环境稳定起重要作用,在生物体生长发育、细胞分化及对环境应激的应答方面极为关键,且在肿瘤的发生发展及耐药中也发挥着重要作用。自噬可通过清除受损的细胞器,抑制生长因子和降低染色质稳定性,从而抑制肿瘤生长;同时肿瘤细胞会通过自噬产生利于生长增殖的营养物质[4]。Obatoclax是Bcl-2家族抗凋亡蛋白的抑制剂,其作用机制与BH3-only蛋白类似,可以竞争性地与抗凋亡蛋白疏水区域结合,诱导凋亡[5]。同时obatoclax通过在溶酶体中蓄积并减少溶酶体组织蛋白酶CTSB、CTSD及CTSL的表达影响溶酶体的功能,抑制自噬而导致细胞增殖受到抑制[6]。文献报道的临床前试验结果表明,obatoclax对各种的血液性恶性肿瘤[7]和实体瘤[8]都有很好的效果。三肽基乙醛(MG-132)通过阻止26S蛋白酶体对泛素化靶蛋白的降解及抑制20S蛋白酶体中类糜蛋白的活性阻断泛素化蛋白酶体系统。而泛素化蛋白酶体系统介导的蛋白质降解途径参与细胞周期、转录、DNA修复、细胞粘附、血管生成及细胞凋亡等生命过程,与肿瘤的发生发展也有密切的关系[9]。目前,MG-132因为体内活性不稳定尚未进入临床应用,常用作一种临床研究工具药[10]。体内降解蛋白质两大途径溶酶体自噬及泛素化蛋白酶体以互补的方式进行调节,抑制自噬会激活泛素化蛋白酶体的功能,而抑制蛋白酶体又会诱导自噬[11]。自噬的激活会削弱蛋白酶体抑制剂的临床治疗效果且与耐药相关[12]。我们在前期研究中发现,obatoclax作用于食管癌细胞时,即使浓度增大至1 μmol/L(8 IC50)时,细胞抑制率仍只能到60%左右。此外,obatoclax作用食管癌细胞48 h时,药物导致的细胞凋亡率量效关系不明显[13]。为此,本课题将obatoclax与蛋白酶体抑制剂MG-132联用,就是希望同时阻断自噬和蛋白酶体降解两大细胞内蛋白质降解的途径,能够增加obatoclax对肿瘤细胞的抑制率,产生协同抗肿瘤作用,为这两类药物将来在临床上联合应用提供一个概念性的验证。本研究通过检测药物对人食管癌细胞CaES-17的细胞毒作用,计算药物的联用指数,研究药物对CaES-17细胞ubiquitin表达、PARP及Caspase-9剪切以及phospho-Histone H3蛋白及phospho-Aurora A/B/C蛋白的影响、早期凋亡及细胞周期的影响,探讨obatoclax与MG-132联合作用于食管癌细胞CaES-17是否具有协同作用,并对其机制做初步研究。
1 材料和方法 1.1 材料Obatoclax购买于Selleck Chemicals(Houston,TX),MEM培养基、胎牛血清、胰酶、青霉素、链霉素购买于美国Gibco。检测ubiquitin、PARP、Caspase-9、phospho-Histone H3、phospho-Aurora A/B/C及β-actin的一抗、二抗、ECL发光液购买于美国Cell Signaling technology,检测凋亡的试剂盒购买于美国BD。其他试剂均购买于美国Sigma。
1.2 细胞培养人食管癌细胞株CaES-17购买于中国典型培养物保藏中心(CCTCC)。CaES-17细胞培养于MEM培养基(含体积分数为10%胎牛血清,100 U/mL青霉素和100 U/mL链霉素),置于湿度饱和,含5% CO2,37 ℃培养箱中培养,贴壁生长,0.25%胰酶消化传代。
1.3 MTT法检测药物对细胞活力的影响及药物联用指数的计算将对数生长期的CaES-17细胞以3000/孔的密度接种于96孔板中。细胞贴壁生长24 h后更换含药物的培养基,药物作用48 h后吸弃含药培养基。加入MTT(终浓度为0.5 mg/L)继续孵育4 h后吸弃上清,加入DMSO使MTT还原产物甲臜(Formazan)完全溶解,酶联免疫检测仪检测570 nm波长的光密度(OD)值。使用Graph Pad Prism 5.0计算药物IC50,确定药物联用的摩尔比。以同样的细胞密度接种96孔板,以培养基为对照组,以单用obatoclax(1/8 IC50、1/4 IC50、1/2 IC50、IC50、2 IC50、4 IC50)、单用MG-132(1/8 IC50、1/4 IC50、1/2 IC50、IC50、2 IC50、4 IC50)及其联用组为实验组。后续操作同上所述,应用CompuSyn软件计算两药的联用指数(CI),CI < 1为协同作用,CI=1为相加作用,CI>1为拮抗作用[14]。同时使用CompuSyn软件计算两个药物对细胞抑制率为50%、75%、90%及95%时单独及联用后相对应的浓度,浓度减少的程度用单独用药的浓度与联合用药后浓度的比值表征。
1.4 Western blot检测ubiquitin、凋亡及周期相关蛋白的表达情况将对数生长期的CaES-17细胞以2×105/孔的密度接种于6孔板中。细胞贴壁生长24 h后更换含药物的培养基。以培养基为对照组,以单用obatoclax 0.125 μmol/L、MG-132 0.300 μmol/L及其联用组为实验组。药物作用48 h后,用含有蛋白酶及磷酸酶抑制剂的RIPA缓冲液裂解细胞提取总蛋白,然后4 ℃、12 000 g离心15 min。吸取上清进行蛋白定量,以25 μg上样,SDS-PAGE电泳,用湿转法将蛋白转至醋酸纤维素膜,5%脱脂牛奶室温封闭1 h,4 ℃孵育一抗过夜,洗膜,室温孵育二抗1 h,洗膜,ECL发光液覆盖,最后暗室显影、定影。使用ImageJ软件测量分析蛋白条带,用β-actin作为蛋白质水平参照。
1.5 流式细胞技术检测细胞凋亡及细胞周期分布将对数生长期的CaES-17细胞以2×105/孔的密度接种于6孔板中。细胞贴壁生长24 h后更换含药物的培养基。以培养基为阴性对照组,以单用obatoclax 0.125 μmol/L、MG-132 0.300 μmol/L及其联用组为实验组,以可诱导凋亡的PKC抑制剂Staurosporine 50 nmol/L为阳性对照组。药物作用48 h后,用不含EDTA的胰酶消化细胞,然后细胞用预冷的PBS洗1次,再用1× Binding Buffer洗1次,用100 μL的1×Binding Buffer重悬细胞中并转移至流式管,避光加入3 μL FITC-Annexin V,室温避光孵育反应15 min,最后再加入400 μL 1× Binding Buffer,于1 h内用流式细胞仪检测细胞凋亡。
在细胞周期分布的检测时,将对数生长期的CaES-17细胞以2×105/孔的密度接种于6孔板中。细胞贴壁生长24 h后更换含药物的培养基。在CaES-17细胞上,以培养基为阴性对照组,以单用obatoclax 0.125 μmol/L、MG-132 0.300 μmol/L及其联用组为实验组。药物作用48 h后,用胰酶消化细胞,然后细胞用预冷的PBS洗2次,再用预冷的75%乙醇固定,4 ℃过夜。1200 r/min离心5 min,然后用PBS洗1次,再用500 μL PBS重悬细胞并转移至流式管中,避光加入10 μL的PI(终浓度为50 μg/mL)及1.250 μL的RNA酶(终浓度为10 μg/mL),37 ℃孵箱避光孵育反应30 min,流式细胞仪检测细胞周期。
1.6 统计学处理数据以均数±标准差表示,应用Prism 5.0软件进行统计学分析,两组间比较采用t检验,多组间比较采用单因素方差分析及Turkey's t检验,以P < 0.05认为差异有统计学意义。
2 结果 2.1 Obatoclax与MG-132联用对人食管癌细胞CaES-17具有协同抗肿瘤作用为了研究obatoclax及MG-132单用及联用对人食管癌细胞CaES-17细胞活力的影响,通过MTT方法检测药物对细胞的毒性作用,使用Graph Pad Prism 5.0计算得到obatoclax的IC50为0.125±0.050 μmol/L(图 1A),MG-132的IC50为0.300±0.080 μmol/L(图 1B)。参照药物的IC50确定两药联用的摩尔比为1 : 2.4,分别将两个药物的作用浓度进行倍比稀释,obatoclax及MG-132的浓度范围为1/8 IC50-4 IC50。通过MTT法测定药物联用对细胞活力的影响,应用CompuSyn软件计算两药的联用指数及药物联用前后浓度的变化。结果显示obatoclax与MG-132联用时,对人食管癌细胞CaES-17抑制率达到50%、75%、90%及95%时,对应的CI值分别为0.296、0.200、0.136及0.104。其中,当抑制率为50%时,obatoclax单用时的浓度是联用的6倍,MG-132单用时的浓度是联用的8倍;当抑制率为95%时,obatoclax单用时的浓度是联用的15倍,MG-132单用时的浓度是联用的28倍。以上结果说明两个药物联用后产生协同抗肿瘤作用,可协同地抑制食管癌细胞CaES-17的增殖,降低细胞存活率。
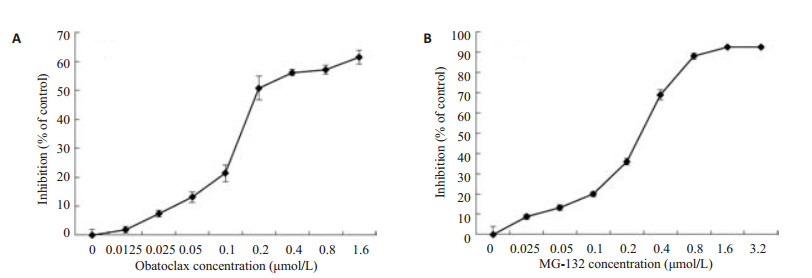
|
图 1 Obatoclax(A)及MG-132(B)对食管癌细胞CaES-17的细胞毒性作用 Figure 1 Cytotoxicity of obatoclax (A) and MG-132 (B) in CaES-17 cells. |
Ubiquitin是溶酶体自噬和泛素化蛋白酶体系统共同的降解底物,同时抑制溶酶体自噬和泛素化蛋白酶体系统会引起ubiquitin积累的增多[3]。Ubiquitin在蛋白降解中发挥标记作用,而泛素化修饰通过调控核转录因子及肿瘤坏死因子相关凋亡诱导配体等途径在凋亡过程中起着重要作用。我们采用Western blot检测obatoclax与MG-132单用及联用所引起的ubiquitin表达变化。结果发现在CaES-17细胞中,obatoclax及MG-132单用均会引起ubiquitin的表达增加(图 2A),同时联用组ubiquitin的表达较两药单用组明显增加(图 2A),且差异有统计学意义(P < 0.05,图 2B)。这在说明obatoclax与MG-132联用后对ubiquitin的表达具有协同促进作用的同时,也说明溶酶体自噬与泛素化蛋白酶体系统相互调节与影响,这也与文献报道的结果相互印证[3]。
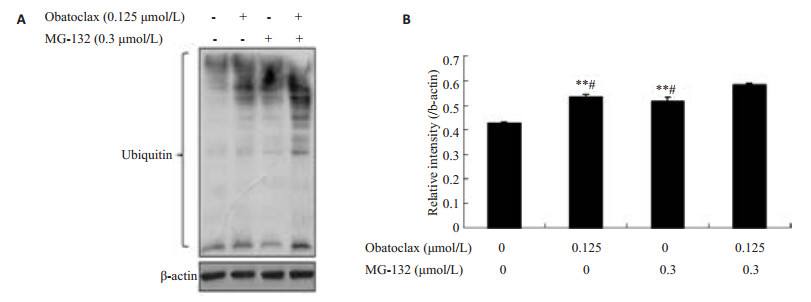
|
图 2 药物联合作用48 h后细胞ubiquitin的表达较药物单用组明显增加 Figure 2 Increased expression of ubiquitin in cells treated with obatoclax plus MG-132 for 48 h were increased compared with that in cells treated with obatoclax or MG-132 alone. A: Ubiquitin protein bands in Western blotting; B: Quantitative analysis of ubiquitin protein expression. **P < 0.01 vs control; #P < 0.05 vs obatoclax+MG-132. |
正常情况下磷酯酰丝氨酸(PS)位于细胞膜内侧,在细胞凋亡早期,PS从细胞膜内侧翻转到细胞膜表面。Annexin-V是一种Ca2+依赖性磷脂结合蛋白,以高亲和力特异性的与PS结合,用荧光素FITC标记Annexin V,并以此为探针,利用流式细胞仪检测细胞凋亡的发生[15]。碘化丙啶(PI)是一种核酸染料,在凋亡晚期可以穿透细胞膜使细胞核红染。由于本研究用到的药物obatoclax本身会发红色荧光,会占用PI的荧光检测通道,因此本研究只用Annexin-V进行单染研究药物作用对细胞凋亡的影响。为了研究Obatocalx与MG-132联用能否促进细胞凋亡,我们采用流式细胞术检测obatoclax与MG-132单用及联用所引起的细胞凋亡的变化(图 3)。结果表明,CaES-17细胞经obatoclax及MG-132单用及联用作用48 h后,阴性对照组、obatoclax和MG-132单用组、obatoclax+MG-132联用组及阳性对照组细胞Annexin V阳性率分别为(6.5±0.8)%、(14.5±0.8)%、(37.0±0.8)%、(53.6±0.8)%和(25.3±1.3)%。联用组细胞Annexin V阳性率与obatoclax单用组相比增加了(39.2±0.1)%,与MG-132单用组相比增加了(16.7±0.1)%,其差异具有统计学意义(P < 0.05)。上述结果说明,obatoclax和MG-132联用诱导CaES-17细胞凋亡增加。
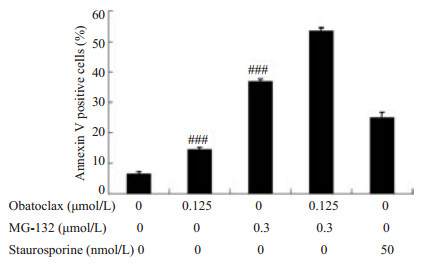
|
图 3 药物作用48 h后对细胞早期凋亡的影响 Figure 3 Effects of treatment for 48 h with obatoclax and MG-132, alone or in combination, on cell apoptosis of CaES-17 cells. Staurosporine (50 nmol/L) was used as the positive control. ###P < 0.001 vs obatoclax+MG-132. |
为了进一步研究两药联用后产生的协同抗肿瘤作用是否与凋亡相关,我们采用Western blot检测obatoclax与MG-132单用及联用所引起的凋亡相关蛋白PARP及Caspase-9剪切的变化。结果发现在CaES-17细胞中,联用组PARP蛋白及Caspase-9蛋白的剪切较obatoclax及MG-132单用组明显增加(图 4A),且PARP及Caspase-9剪切的增加均有统计学意义(P < 0.05)(图 4B-C)。这进一步说明obatoclax与MG-132联用可产生协同作用与凋亡有关,且两药联用会引起凋亡的增加,这也与之前流式细胞术检测细胞凋亡的结果一致。
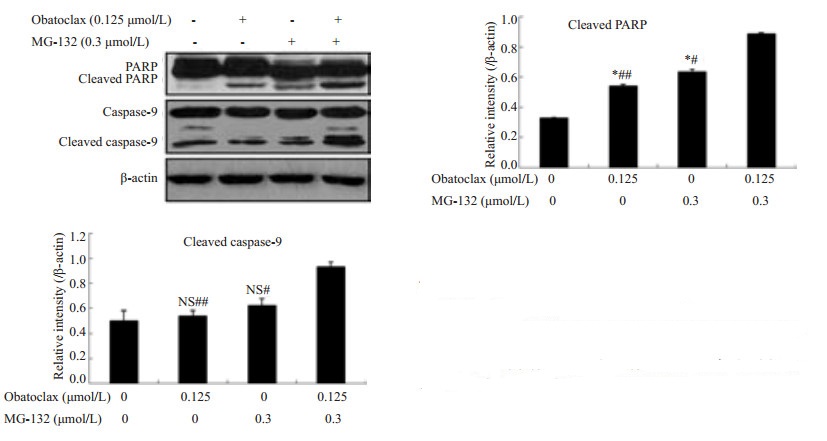
|
图 4 药物联合作用48 h后细胞PARP及caspase-9蛋白的剪切较药物单用组明显增加 Figure 4 Cleavage of PARP and caspase-9 in cells treated for 48 h with obatoclax and MG-132, alone or in combination. NS: No significant difference compared to control(P>0.05). *P < 0.05 vs control; #P < 0.05, ##P < 0.01 vs obatoclax+MG-132. |
鉴于obatoclax及MG-132对细胞周期都会有影响[16-17],我们采用流式细胞术检测obatoclax与MG-132单用及联用所引起的细胞周期的变化(图 5)。结果表明,CaES-17细胞经obatoclax及MG-132单用及联用作用48 h后,对照组、obatoclax和MG-132单用组、obatoclax+MG-132联用组sub-G1期细胞百分比分别为(1.2±0.2)%、(2.7±0.8)%、(4.5±0.6)%和(14.9±0.5)%。联用组sub-G1期细胞百分比与obatoclax单用组相比增加了(12.1±0.3)%,与MG-132单用组相比增加了(10.3±1.0)%,其差异具有统计学意义(P < 0.05)。而对照组、obatoclax和MG-132单用组、obatoclax+MG-132联用组G2/M期细胞百分比分别为(14.0±1.8)%、(16.2±1.7)%、(16.4±0.6)%、(25.0±2.0)%。联用组G2/M期细胞百分比与obatoclax单用组相比增加了(8.8±0.3)%,与MG-132单用组相比增加了(8.6±2.5)%,其差异也均具有统计学意义(P < 0.05)。因此,obatoclax和MG-132联用可引起CaES-17细胞sub-G1期及G2/M期细胞百分比增加,说明两药联用可促进CaES-17细胞凋亡增加,并诱导细胞发生G2/M期阻滞。
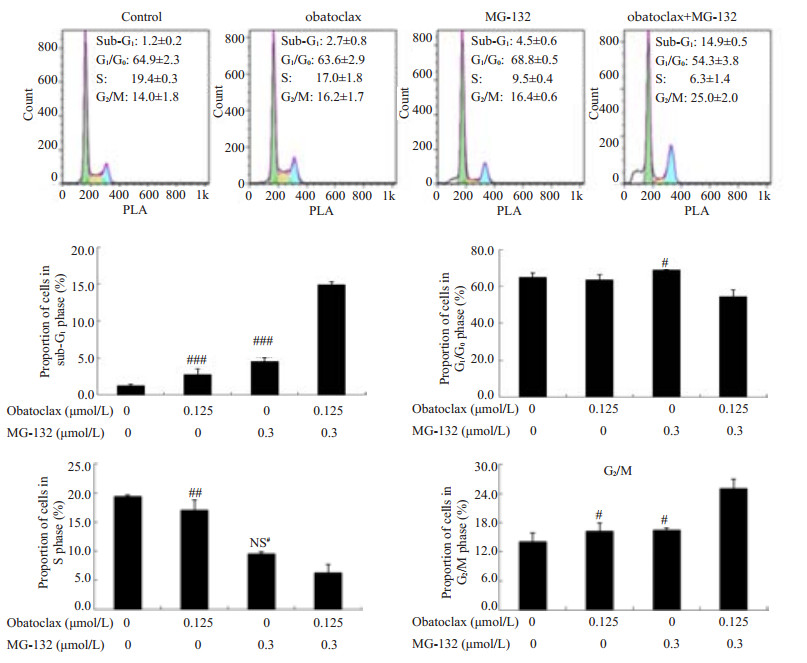
|
图 5 药物作用48 h后对细胞周期sub-G1期(A)、 G1/G0期(B)、 S期(C)及G2/M(D)期的影响 Figure 5 Effects of treatment for 48 h with obatoclax and MG-132, alone or in combination, on percentages of cells in sub-G1 (A), G1/G0 (B), S (C) and G2/M (D) phases. NS#: No significant difference compared to obatoclax+MG-132 (P>0.05); #P < 0.05, ##P < 0.01, ###P < 0.001 vs obatoclax+MG-132. |
为进一步研究两药联用对细胞G2/M期的影响,我们采用Western blot检测obatoclax与MG-132单用及联用对细胞G2/M期关键蛋白phospho-Histone H3蛋白及phospho-Aurora A/B/C蛋白表达的影响(图 6)。结果发现,在CaES-17细胞中,与单用药组(MG-132或obatoclax)相比,联用组phospho-Histone H3的表达显著增加(P < 0.05),且与单用obatoclax相比,联用组phospho-Aurora A/B/C的表达显著增加(P < 0.05),但是与单用MG-132相比无统计学差异(P>0.05)。以上结果说明obatoclax与MG-132联用可能通过促进phospho-Histone H3蛋白及phospho-Aurora A/B/C蛋白表达,产生G2/M期阻滞作用,而且这种促进作用具有协同性。这也与之前流式细胞术检测细胞周期的结果一致。
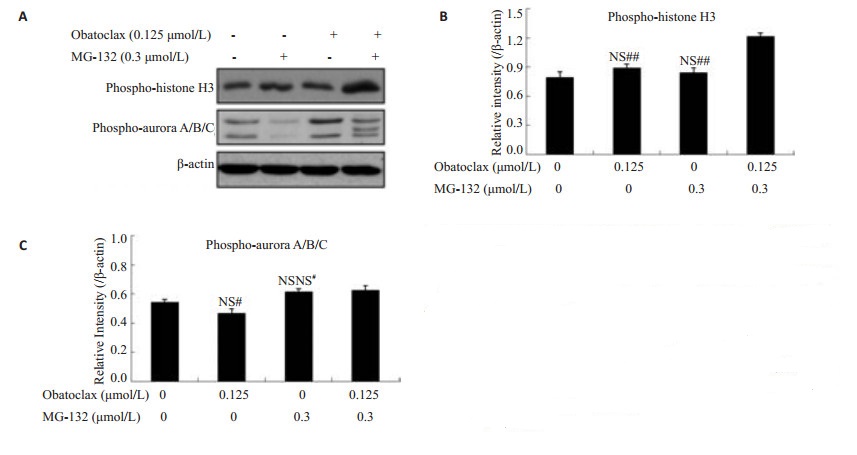
|
图 6 药物联合作用48 h后细胞对细胞phospho-Histone H3蛋白及phospho-Aurora A/B/C蛋白的影响 Figure 6 Expression of phospho-histone H3 and phospho-AuroraA/B/C in cells treated for 48 h with obatoclax and MG-132 alone or in combination. A: Protein bands of phospho-histone H3 and phospho-Aurora A/B/C in Western blotting; B, C: Quantitative analysis of the expression of phospho-HistoneH3 and phospho-Aurora A/B/C, respectively. NS: No significant difference compared to control (P>0.05); NS#: No significant difference compared to obatoclax + MG-132 (P>0.05); #P < 0.05, ##P < 0.01 vs obatoclax+MG-132. |
溶酶体自噬和泛素化蛋白酶体系统在肿瘤的发生发展、治疗及耐药中均起着重要的作用[18-19]。细胞通过溶酶体自噬可以实现生物合成原料及能量的再循环,而肿瘤细胞可以通过调节自噬,克服细胞因不停地分裂生长造成的饥饿状态而规避死亡,通过外界药物干扰肿瘤细胞的自噬调节是近来抗肿瘤药物研究的热点[20]。泛素化蛋白酶体系统作为另一类重要的细胞内蛋白降解途径,可以降解80%~90%的胞内蛋白,从而调节细胞内稳态,抑制肿瘤细胞凋亡的发生,加速肿瘤细胞增殖[21]。本研究使用obatoclax抑制溶酶体自噬,用蛋白酶体抑制剂MG-132抑制蛋白酶体系统,研究Obatoxlax联用MG-132对人食管癌细胞是否具有协同抗肿瘤作用。我们的研究表明,obatoclax与MG-132联用具有协同抗食管癌细胞CaES-17的作用,可诱导食管癌细胞凋亡增加并且诱导食管癌细胞出现G2/M期阻滞,为食管癌的治疗提供了新的策略和靶点,也为临床研究中解决药物活性低、容易耐药及相同类型药物的联合应用提供参考。
我们的结果显示,obatoclax与MG-132对CaES-17均有明显的细胞毒性作用(图 1),且通过CompuSyn软件计算得到obatoclax与MG-132联用时,对CaES-17抑制率达到50%、75%、90%及95%时,对应的CI值分别为0.296、0.200、0.136及0.104。这可以初步说明两药联用有协同抗肿瘤作用[14]。在本研究中,单用obatoclax或者单用MG-132均会增加ubiquitin表达,且联用后显著增加ubiquitin的表达(图 2)。研究表明obatoclax通过在溶酶体中蓄积同时减少溶酶体组织蛋白酶CTSB、CTSD及CTSL的表达影响溶酶体的功能,进而抑制自噬[6]。而在自噬发生的过程中,p62/SQSTM1通过与Atg8/LC3的结合促进泛素的降解。当抑制自噬时,p62/SQSTM1与Atg8/LC3的结合受阻,引起ubiquitin的增加[22]。以上结果进一步说明同时抑制溶酶体自噬和蛋白酶体系统会产生协同作用。
细胞凋亡是维持机体发育和组织自身稳定的重要生命活动,与细胞增殖、分化、衰老及清除等生命过程息息相关。肿瘤细胞会逃避凋亡,这与肿瘤的发展形成及耐药性有着密不可分的关系[23]。Obatoclax可同时抑制Bcl-2与Bax、Mcl-1与Bak的结合,使促凋亡蛋白Bim发生磷酸化,诱导凋亡[16]。而MG-132可通过抑制蛋白酶体阻断该系统降解与凋亡信号转导相关的蛋白,还可以通过影响内质网应激和活性氧生成诱导凋亡[10]。我们检测了两药联用后早期凋亡(图 3)及凋亡相关蛋白PARP及Caspase-9剪切(图 4)的变化,结果发现,obatoclax与MG-132均可诱导食管癌细胞发生凋亡,且两药联用后细胞凋亡明显增加,与单用组相比有统计学差异(P < 0.05)。这说明两个药物产生协同抗肿瘤作用与诱导凋亡有关。蛋白酶体抑制剂MG-132抑制蛋白酶体后会引起Bcl-2的剪切[24],而obatoclax会拮抗Bcl-2抗凋亡作用[16]。两药联用后凋亡增加可能是因为药物通过不同机制影响了ubiquitin的功能,也可能是因为MG-132诱导的Bcl-2抗凋亡作用被obatoclax所拮抗。
细胞周期是机体完成自我复制和更新的重要途径,与细胞的增殖、分化、凋亡及衰老密切相关,而肿瘤的发生发展主要是因为细胞周期的紊乱和失调。抑制自噬会减少PoLo样蛋白激酶PLK4 mRNA的表达,诱导细胞出现G2/M期阻滞[25],而当细胞出现周期阻滞时会进行受损DNA的修复,若修复失败则会发生凋亡。obatoclax除了抑制Bcl-2家族蛋白,会通过p38/p21waf1/Cip1信号诱导G1/G0阻滞[5],也会通过非经典途径诱导胰腺癌细胞产生S期及G2/M期阻滞,也可以诱导急性白血病细胞产生S期阻滞[16]。与此同时,MG-132会通过调节p21的表达诱导肿瘤细胞产生G2/M期的阻滞[10]。在本研究中,obatoclax与MG-132单用时,sub-G1期细胞增多,对细胞周期其他阶段均未出现明显的周期抑制,但两药联用后明显增加了sub-G1期及G2/M期细胞百分比,与单用组相比有统计学差异(P < 0.05)(图 5)。前者结果与Annexin V阳性率检测结果及Western blot结果相一致,说明两药联用产生协同作用与凋亡相关,且两药联用会诱导细胞凋亡增加;后者结果说明两个药物联用后会诱导食管癌细胞产生G2/M阻滞。同时检测了两药联用对G2/M期蛋白phospho-Histone H3蛋白及phospho-Aurora A/B/C蛋白的影响,结果表明两药联用会诱导phospho-Histone H3蛋白及phospho-Aurora A/ B/C蛋白表达增加(图 6)。这进一步表明obatoclax与MG-132联用是通过促进phospho-Histone H3蛋白及phospho-Aurora A/B/C蛋白表达产生G2/M期阻滞作用,而且这种促进作用具有协同性。细胞周期阻滞与凋亡之间存在共同的调节基因。p53/p21信号通路介导细胞周期阻滞是一个发生较慢的过程,应激条件会激活并稳定p53,使其通过激活其下游多种基因的转录而引起细胞周期阻滞、凋亡或衰老。
ABT-737、ABT-263、棉酚及obatoclax等Bcl-2蛋白的小分子抑制剂是近年来抗肿瘤药物的研发热点,临床试验表明该类药物单用对某些肿瘤有很好的抗肿瘤效果,与放化疗药物联用有明显的协同作用。但是同时也发现了其临床用药的不足,ABT-737对Mcl-1亲和力不高,导致高表达Mcl-1的肿瘤会对其产生耐受;ABT-263会抑制Bcl-xl,引起血小板减少。而obatoclax与Bcl-2、Bcl-xl、Bcl-w及Mcl-1均有较高的亲和力,在临床实验中对实体瘤和淋巴细胞瘤都有良好的效果。根据目前的研究来看,obatoclax与其他抗肿瘤药物联用会产生协同抗肿瘤作用,与ABT-737联合作用于人急性髓系白血病细胞可协同地诱导细胞凋亡,与阿糖胞苷联合作用于白血病细胞株也可协同地诱导凋亡[16]。MG-132因其体内活性低并尚未进入临床应用,目前常用作科研工具药,但该类蛋白酶体抑制剂已有3个药物被批准用于临床治疗多发性骨髓瘤患者,其中硼替佐米已于2003年批准上市,ixazomib则于2015年被批准上市,为首款口服蛋白酶体抑制剂。同时,MG-132与三氧化二砷联用在淋巴瘤细胞上有协同抗肿瘤作用[26],与顺铂联用能增加顺铂对细胞的杀伤作用[27]。肿瘤被认为是一种综合性病变,且为非匀一性,因此药物联用在肿瘤的治疗中举足轻重,在增加抗肿瘤效果的同时还可减少不良反应。本研究结果表明,obatoclax与MG-132联用在食管癌细胞上有协同抗肿瘤作用,肿瘤细胞凋亡增加,同时出现明显的G2/M期阻滞,为这两类药物将来在临床上联合应用提供一个概念性的验证。
| [1] |
钟钏, 谭家驹, 徐致祥. 食管癌流行病学病因学研究进展[J].
河南预防医学杂志,2011, 22 (1) : 1-11.
( 0) 0)
|
| [2] |
赫捷, 邵康. 中国食管癌流行病学现状、诊疗现状及未来对策[J].
中国癌症杂志,2011, 21 (7) : 501-3.
( 0) 0)
|
| [3] |
Wang XJ, Yu J, Wong SH, et al. A novel crosstalk between two major protein degradation systems Regulation of proteasomal activity by autophagy[J].
Autophagy,2013, 9 (10) : 1500-8.
DOI: 10.4161/auto.25573. ( 0) 0)
|
| [4] |
古春萍.自噬介导人食管癌细胞对顺铂耐药的作用及其机制研究[D].南方医科大学, 2014.
( 0) 0)
|
| [5] |
Zhong D, Gu C, Shi L, et al. Obatoclax induces G1/G0-phase arrest via p38/p21(waf1/Cip1) signaling pathway in human esophageal cancer cells[J].
J Cell Biochem,2014, 115 (9) : 1624-35.
DOI: 10.1002/jcb.24829. ( 0) 0)
|
| [6] |
Yu L, Wu WK, Gu C, et al. Obatoclax impairs lysosomal function to block autophagy in cisplatin-sensitive and -resistant esophageal cancer cells[J].
Oncotarget,2016, 19 .
DOI: 10.18632/oncotarget.7492. ( 0) 0)
|
| [7] |
Goard CA, Schimmer AD. An evidence-based review of obatoclax mesylate in the treatment of hematological malignancies[J].
Core Evid,2013, 8 (4) : 15-26.
( 0) 0)
|
| [8] |
Oltersdorf T, Elmore SW, Shoemaker AR, et al. An inhibitor of Bcl-2 family proteins induces regression of solid tumours[J].
Nature,2005, 435 (7042) : 677-81.
DOI: 10.1038/nature03579. ( 0) 0)
|
| [9] |
Chen FZ, Zhao XK. Ubiquitin-Proteasome pathway and prostate cancer[J].
Onkologie,2013, 36 (10) : 592-6.
DOI: 10.1159/000355166. ( 0) 0)
|
| [10] |
Guo N, Peng ZL. MG132, a proteasome inhibitor, induces apoptosis in tumor cells[J].
Asia Pac J Clin Oncol,2013, 9 (1) : 6-11.
DOI: 10.1111/ajco.2013.9.issue-1. ( 0) 0)
|
| [11] |
Wu WK, Sakamoto KM, Milani M, et al. Macroautophagy modulates cellular response to proteasome inhibitors in cancer therapy[J].
Drug Resist Updat,2010, 13 (3) : 87-92.
DOI: 10.1016/j.drup.2010.04.003. ( 0) 0)
|
| [12] |
Liu DL, Gao M, Yang Y, et al. Inhibition of autophagy promotes cell apoptosis induced by the proteasome inhibitor MG-132 in human esophageal squamous cell carcinoma EC9706 cells[J].
Oncol Lett,2015, 9 (5) : 2278-82.
( 0) 0)
|
| [13] |
钟德胜. Obatoclax通过p38/p21waf1/Cip1信号通路诱导人食管癌细胞G1/G0期细胞阻滞[D].南方医科大学, 2014.
( 0) 0)
|
| [14] |
Chou TC. Drug combination studies and their synergy quantification using the Chou-Talalay method[J].
Cancer Res,2010, 70 (2) : 440-6.
DOI: 10.1158/0008-5472.CAN-09-1947. ( 0) 0)
|
| [15] |
Van Engeland M, Nieland LJ, Ramaekers FC, et al. Annexin V-affinity assay:A review on an apoptosis detection system based on phosphatidylserine exposure[J].
Cytometry,1998, 31 (1) : 1-9.
DOI: 10.1002/(ISSN)1097-0320. ( 0) 0)
|
| [16] |
Konopleva M, Watt J, Contractor R, et al. Mechanisms of antileukemic activity of the novel Bcl-2 homology domain-3 mimetic GX15-070(obatoclax)[J].
Cancer Res,2008, 68 (9) : 3413-20.
DOI: 10.1158/0008-5472.CAN-07-1919. ( 0) 0)
|
| [17] |
Zanotto-Filho A, Braganhol E, Battastini AM, et al. Proteasome inhibitor MG132 induces selective apoptosis in glioblastoma cells through inhibition of PI3K/Akt and NFkappaB pathways, mitochondrial dysfunction, and activation of p38-JNK1/2 signaling[J].
Invest New Drugs,2012, 30 (6) : 2252-62.
DOI: 10.1007/s10637-012-9804-z. ( 0) 0)
|
| [18] |
Ding FB, Xiao HB, Wang MS, et al. The role of the ubiquitinproteasome pathway in cancer development and treatment[J].
Front Biosci,2014, 19 (8) : 886-95.
( 0) 0)
|
| [19] |
Chan WY, Cheung KK, Schorge JO, et al. Bcl-2 and p53 protein expression, apoptosis, and p53 mutation in human epithelial ovarian cancers[J].
Am J Pathol,2000, 156 (2) : 409-17.
DOI: 10.1016/S0002-9440(10)64744-X. ( 0) 0)
|
| [20] |
Ojha R, Bhattacharyya S, Singh SK. Autophagy in cancer stem cells:a potential Link between chemoresistance, recurrence, and metastasis[J].
Biores Open Access,2015, 4 (1) : 97-108.
DOI: 10.1089/biores.2014.0035. ( 0) 0)
|
| [21] |
Shen M, Schmitt S, Buac D, et al. Targeting the ubiquitinproteasome system for cancer therapy[J].
Expert Opin Ther Targets,2013, 17 (9) : 1091-108.
DOI: 10.1517/14728222.2013.815728. ( 0) 0)
|
| [22] |
Pankiv S, Clausen TH, Lamark T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J].
J Biol Chem,2007, 282 (33) : 24131-45.
DOI: 10.1074/jbc.M702824200. ( 0) 0)
|
| [23] |
Hanahan D, Weinberg RA. Hallmarks of cancer:the next Generation[J].
Cell,2011, 144 (5) : 646-74.
DOI: 10.1016/j.cell.2011.02.013. ( 0) 0)
|
| [24] |
Zhang XM, Lin H, Chen C, et al. Inhibition of ubiquitinproteasome pathway activates a caspase-3-like protease and induces Bcl-2 cleavage in human M-07e leukaemic cells[J].
Biochem J,1999, 340 (1) : 127-33.
DOI: 10.1042/bj3400127. ( 0) 0)
|
| [25] |
黄宝珊.细胞自噬在细胞周期调控中的作用及机制研究[D].浙江大学, 2014.
( 0) 0)
|
| [26] |
Cavaliere V, Lombardo T, Costantino SN, et al. Synergism of Arsenic trioxide and MG132 in Raji cells attained by targeting BNIP3, autophagy, and mitochondria with low doses of valproic acid and vincristine[J].
Eur J Cancer,2014, 50 (18) : 3243-61.
DOI: 10.1016/j.ejca.2014.09.012. ( 0) 0)
|
| [27] |
杨洋, 樊玉霞, 刘东雷, 等. 蛋白酶体抑制剂MG132增加顺铂对食管鳞癌细胞的杀伤作用[J].
中华实验外科杂志,2014, 31 (5) : 1042-4.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
