糖尿病脑病是糖尿病慢性并发症,1965年由Nielon首次提出[1],它以学习能力下降、记忆功能减退等认知功能障碍为主要特征,涵盖了神经电生理、神经心理、病理学、影像学和行为学等多方面改变。随着中国步入老龄化社会,糖尿病患者人数不断增加,糖尿病作为认知功能障碍的独立危险因素,它所引发的认知功能障碍的患病率为25%~36%[2],其发生痴呆的风险是非糖尿病患者的1.8倍[3],严重影响了糖尿病患者的生活质量,给其家庭及社会造成极大的经济负担。糖尿病脑病已经是一个不容忽视的医学和社会问题,成为神经病学、内分泌学等学科的研究热点。在中枢神经系统中,WNT信号通路对神经发生,神经元分化、迁移,突触发生以及轴突生长具有重要的调控作用[4-6],是神经退行性疾病发病过程中的关键因素。有研究报道糖尿病患者血浆Ghrelin的表达水平下降[7]。本课题组前期工作也证实糖尿病大鼠海马部位的Ghrelin受体GHSR-1a的表达下降[8],同时发现Ghrelin可以抑制大鼠海马神经元的凋亡改善糖尿病大鼠认知功能障碍[9],以上结果提示Ghrelin及其受体的差异性表达参与了糖尿病认知功能障碍的发生发展过程。然而,WNT信号通路是否参与糖尿病认知功能障碍的发生发展过程,Ghrelin是否通过调控WNT信号通路调节糖尿病大鼠认知功能,目前鲜有报道。本实验通过建立糖尿病动物模型、侧脑室注射Ghrelin及其受体拮抗剂D-Lys-3-GHRP-6,观察Ghrelin对糖尿病大鼠海马超微结构的变化和血清DKK-1以及海马组织中WNT信号通路相关蛋白表达的影响,对糖尿病脑病的发病机制提供佐证。
1 材料和方法 1.1 实验试剂及仪器链脲佐菌素(Streptozotocin, STZ)、Ghrelin和D-Lys-3-GHRP-6(美国Sigma公司);DKK-1elisa试剂盒(基尔顿);兔抗大鼠单克隆抗体DKK-1、兔抗大鼠单克隆抗体β-catenin(美国Abcam公司);引物合成(上海生工生物有限公司);SYBR Green I(ABI公司, 美国);血糖仪(德国罗氏);脑立体定位仪(美国Stoelting公司);Morris水迷宫及水迷宫记录分析系统(中国科学院技术研究院);透射电子显微镜(H-600, 日本Hitachi公司)。
1.2 实验动物SPF级雄性SD大鼠60只(8~10周、体质量180~200 g。重庆医科大学动物实验中心),适应性喂养1周后禁食12 h,随机选取45只大鼠单次腹腔注射链脲佐菌素streptozotocin, STZ)(60 mg/kg,溶入PH4.5,0.1 mmol/L的柠檬酸-柠檬酸钠缓冲液)建立糖尿病模型[10],余15只大鼠腹腔注射等量柠檬酸-柠檬酸钠缓冲液作为对照组。3 d后取尾静脉血,随机血糖值≥16.7 mmol/L则糖尿病大鼠建模成功,随机分成3组。实验过程中,大鼠在SPF级恒温(22~24 ℃)、恒湿(60%~75%)饲养环境下,分笼饲养,自由采食、饮水,12 h光照周期,定期更换洁净垫料,监测血糖。
1.3 Morris水迷宫(Morris water maze, MWM)测试建模后第12周,所有大鼠在Morris水迷宫系统中进行3 d训练,第4天进行隐藏平台获得实验,分析逃避潜伏期考察大鼠学习能力。第5天撤去平台,系统自动记录120 s内各组大鼠在目标象限穿越站台区域次数,测试大鼠空间记忆能力。测试完毕,进行侧脑室定位注射Ghrelin及Ghrelin+D-Lys-3-GHRP-6,1次/d,持续1周,重复该实验。
1.4 通过侧脑室进行药物干预首次Morris水迷宫测试后对大鼠侧脑室置管进行药物干预。大鼠行腹腔注射水合氯醛(10%,1 mL/kg)麻醉后,固定于脑立体定位仪,充分暴露颅骨,在大鼠右侧脑室穿刺坐标钻孔[11]。将不锈钢套管(带内芯)垂直置入侧脑室,牙脱粉固定;术后大鼠分笼饲养并予青霉素抗炎。置管4 d后后经套管注射药物:(1)NC组和DM组用微量注射器通过PE管将等量生理盐水(0.9%,2 µL)缓慢注入侧脑室,3 min内注射完毕,留针1 min;(2)DM1组用同样方法将Ghrelin(100 ng/µL, 2 µL)缓慢注入侧脑室;(3)DM2组用同样方法将Ghrelin(100 ng/µL,2 µL)+ D-Lys-3-GHRP-6(30 g/L,2 µL)缓慢注入侧脑室,避开Ghrelin的生理分泌节律,每天11:00之后给药1次,持续1周。
1.5 海马组织标本采集及ELISA法检测大鼠血清中DKK-1的表达行为学实验结束后,水合氯醛麻醉大鼠,打开胸腔,右心室内取血,分离血清保存,待检备用。取血后立即经升主动脉快速灌注生理盐水,直至右心房流出液清亮为止。然后用4%多聚甲醛灌注固定,断头取海马组织。将分离的血清取出,严格按照DKK-1 ELISA检测试剂盒说明书进行操作。
1.6 大鼠海马组织CA1区透射电镜大鼠心脏灌流固定后,取出包含海马结构的脑组织切片(6~8片)。运用透明的等距测点框随机地抽取海马CA1区组织块(1 mm3),每只动物抽取5块标本,保证海马CA1区内各个部位的组织有相同的概率被抽取[12]。按常规电镜包埋方法包埋小球。每个组织块上随机切取1张60 nm厚的超薄切片,在透射电子显微镜下,每张超薄切片放大25 000倍后随机选取15个视野进行拍照(第1个视野在左上部随机选择,随后“之”形等距移动视野)。
1.7 HE染色石蜡包埋海马组织,并冠状连续切片,片厚5 µm,制备石蜡切片。取一套切片行苏木精伊红染色,方法如下:(1)石蜡切片按常规用二甲苯脱蜡,经各级乙醇至水:二甲苯(Ⅰ)5 min→二甲苯(Ⅱ)5 min→100%乙醇5 min→ 90%乙醇3 min→80%乙醇3 min→70%乙醇3 min→蒸馏水洗1 min;(2)苏木精染色3 min,自来水冲洗;(3)盐酸乙醇分化10 s;(4)自来水冲洗;(5)伊红染色3 min,自来水冲洗;(6)常规脱水,透明,封固:70%乙醇30 s→80%乙醇30 s→90%乙醇1 min→95%乙醇(Ⅰ)3 min→ 95%乙醇(Ⅱ)5 min→100%乙醇(Ⅰ)5 min→100%乙醇(Ⅱ)5 min→二甲苯(Ⅰ)5 min→二甲苯(Ⅱ)5 min→中性树脂封固。观察海马CA1区形态结构改变。
1.8 定量PCR检测大鼠海马中DKK-1和β-catenin的mRNA表达新鲜海马组织称重后遵照TRIzol® Reagent(Life technologies, 美国)试剂盒说明书提取总RNA,Nanodrop核酸蛋白分析仪测定吸光度值(A),A260nm/A280nm比值限制在1.80~2.00范围。1%的琼脂糖凝胶电泳实验判断RNA完整性,28 s条带亮度为18 s将近两倍为合格。cDNA合成:遵照反转录试剂(Prime ScriptTM RT reagent Kit,大连宝生物)说明冰上操作,合成的cDNA于-20 ℃保存备用。荧光定量PCR实验:引物设计与合成引物序列检索自Primer-Bank,引物序列(表 1)。按照荧光定量PCR试剂盒(SYBR® Premix Ex TaqTM Ⅱ,大连宝生物)说明冰上操作,基因的扩增效率E值在91%~107%、R2值 > 0.98和溶解曲线为单峰,可认为定量PCR结果可靠。在各组实验样本中,定量各基因的表达,并设置无cDNA模板对照组,PCR实验独立重复3次以确保结果可靠性。
| 表 1 引物序列表 Table 1 Primer sequences used for real-time PCR |
新鲜海马称重,加入装有适量裂解液的匀浆管中,组织经匀浆、超声破碎后,用BCA法进行蛋白定量、-80 ℃冰箱保存。根据目的蛋白分子量配置SDS-PAGE分离胶,蛋白上样后电泳,恒流湿转,免疫印迹,Western blotting条带经凝胶成像分析系统扫描处理, 用FUSION软件(版本号Fusion FX7)比较各组与对照(B-actin)光密度值(D280 nm)分析条带灰度值,计算相对表达量。
1.10 统计学方法采用SPSS 17. 0软件包进行统计学处理,计量资料用均数±标准差表示,多组样本间采用单因素方差分析,P < 0.05表明差异有统计学意义。
2 结果 2.1 Morris水迷宫测试结果 2.1.1 隐藏平台获得实验与NC组进行比较,DM组潜伏期延长,存在着显著性的差异(P < 0.05);与DM组进行比较,DM1组潜伏期明显缩短(P < 0.05),较对照组稍延长,但无统计学意义(P < 0.05);DM2组潜伏期延长,与DM1组比较有显著性差异(P < 0.05),与DM组比较未出现显著性的差异(P > 0.05,表 2)。
| 表 2 各组大鼠Morris水迷宫测试结果 Table 2 Comparison of Morris water maze test results among the 4 groups (Mean±SD, n=15) |
DM组与对照组进行比较,DM组穿越原平台位置次数明显下降(P < 0.05);DM1组较DM组穿越原平台位置次数明显增加(P < 0.05),与对照组进行比较未发现明显差异(P > 0.05);DM2组与DM1组相比穿越平台次数明显下降(P < 0.05),但与DM组无显著差异(表 2)。
2.2 透射电镜超微结构变化NC组及DM1组海马CA1区超微结构:神经元细胞核形态规则,细胞器丰富;线粒体发达且其外表面的双层膜和内部的嵴清晰可见;突触结构清晰,突触前膜、突触间隙和突触后膜特化带清晰,突触前成分中可见有排列紧密且数量较多的圆形突触小泡及结构完整的线粒体。DM组及DM2组海马CA1区超微结构:神经元细胞肿胀明显,呈空泡变性;线粒体主要表现为肿胀、空泡变及嵴消失;突触结构模糊,突触前后膜轴浆溶解,突触小泡明显减少,突触后膜肿胀、变薄(图 1)。
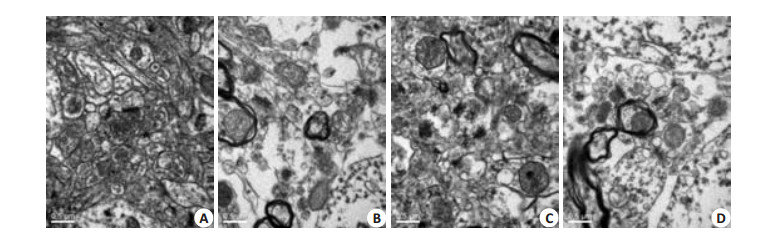
|
图 1 各组大鼠海马CA1区电镜超微结构 Figure 1 Ultrastructure of the hippocampal CA1 region in different groups of rats (Transmission electron microscopy, original magnification: ×25 000). A: Control group; B: DM group; C: DM1 group; D: DM2 group. |
NC海马神经元排列紧密整齐,层次清楚,CA1区结构正常,细胞核呈圆形,大而规则;DM组神经元细胞排列紊乱明显,部分出现细胞核固缩、深染;DM1组神经元细胞排列整齐、细胞层数清晰;DM2组细胞排列紊乱、疏松,丢失严重,海马CA1区神经元弥漫性空泡变性,较多细胞核固缩、深染(图 2)。
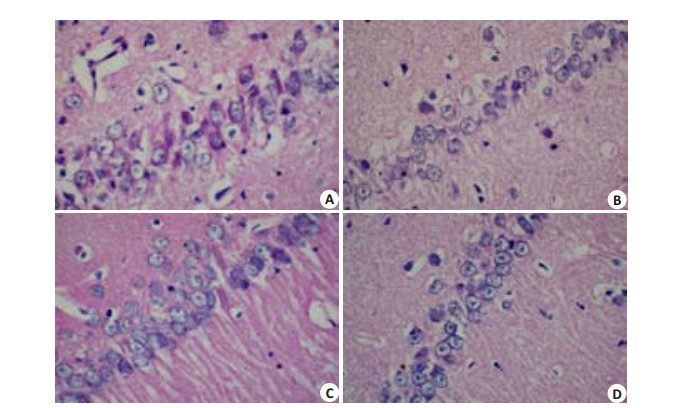
|
图 2 各组大鼠海马CA1区HE染色 Figure 2 HE staining of the hippocampal CA1 region in different groups (Original magnification: × 400). A: Control group; B: DM group; C: DM1 group D: DM2 group. |
与对照组相比,DM组大鼠血清DKK-1蛋白的表达水平明显上升(P < 0.05);与DM组相比,DM1组大鼠海马DKK-1水平下降(P < 0.05);与DM1组相比较,DM2组大鼠海马DKK-1蛋白的表达明显增多(P < 0.05,表 3)。
| 表 3 各组样本血清DKK-1的表达 Table 3 Serum levels of DKK-1 indifferent groups (Mean±SD, μg/L, n=15) |
与对照组组相比,DM组大鼠海马DKK-1mRNA表达显著升高(P < 0.05),而β-catenin mRNA水平明显降低(P < 0.05);与DM组相比,DM1组大鼠海马DKK-1mRNA降低(P < 0.05),β-catenin mRNA水平表达增加(P < 0.05);与DM1组相比,DM2组大鼠海马DKK-1mRNA水平升高(P < 0.05),而β-catenin mRNA水平明显降低(P < 0.05,图 3)。
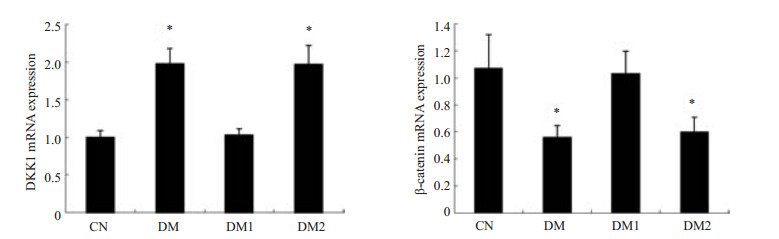
|
图 3 各组大鼠海马DKK-1,β-catenin mRNA表达 Figure 3 Changes in DKK-1 and β-catenin mRNA expressions in the hippocampus of rats in different groups. *P < 0.05. |
与对照组相比,DM组大鼠海马DKK-1蛋白表达显著升高(P < 0.05),而β-catenin的蛋白表达水平明显降低(P < 0.05);与DM组相比,DM1组大鼠海马DKK-1的蛋白水平降低(P < 0.05),β-catenin蛋白水平表达增加(P < 0.05);与DM1组相比,DM2组大鼠海马DKK-1蛋白表达水平升高(P < 0.05),而β-catenin蛋白表达水平明显降低(P < 0.05,图 4)。
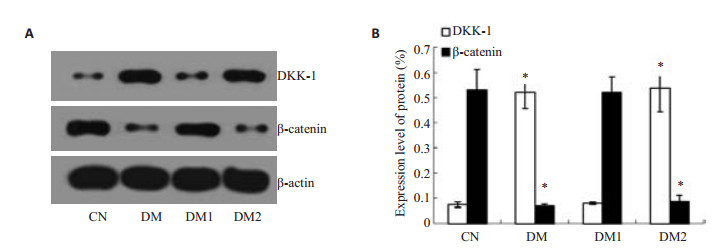
|
图 4 各组大鼠海马DKK-1, β-catenin蛋白表达 Figure 4 Changes in DKK-1 and β-catenin protein expressions in the hippocampus of rats in different groups. A: Western blotting; B: Quantitative analysis of the protein expressions. *P < 0.05. |
临床病例对照实验以及大规模流行病研究证实,糖尿病脑病主要表现为慢性进行性加重的不同程度的认知功能障碍,尤其是学习和记忆能力的降低[13]。本研究采用经典的STZ诱导的糖尿病大鼠模型[14],造模后大鼠呈现持续高血糖状态,12周后出现学习和记忆功能障碍,同时海马区神经元及其细胞器出现损伤。这些指标均证实了糖尿病大鼠并发认知功能障碍,为我们下一步的研究奠定了良好的基础。
WNT/β-catenin信号通路是广泛存在于多细胞真核生物中高度保守的信号通路,在脑发育过程中调控海马区突触和树突棘的形成以及神经发生[15-16]。大量研究表明WNT/β-catenin信号通路通过调控神经元的凋亡参与多种神经退行性疾病如阿尔茨海默病、帕金森病以及脑中风、脑外伤等的发病过程[17-20]。本研究发现糖尿病大鼠海马组织中WNT信号通路抑制剂DKK-1表达显著增高、关键蛋白β-catenin的表达下降。DKK1(Dikkopf-1)是WNT/β-catenin信号通路的经典抑制剂,它通过与跨膜受体结合, 诱导LRP5的内吞,抑制WNT/ β-catenin信号通路的传导[21],β-catenin发生核转位,整体表达水平下降,神经元细胞增殖减少、变性凋亡增多[22-23],提示WNT信号通路的抑制与认知功能障碍发生有关。同时我们还发现糖尿病大鼠组与正常组相比,血清DKK-1表达显著增高,与Lattanzio等[24]在糖尿病患者血清中的发现DKK-1水平呈上升状态的研究是一致的,可以认为DKK-1的表达可能与糖尿病的发生有关。以上研究提示WNT/β-catenin信号通路可能参与了糖尿病大鼠认知功能障碍的发生发展过程。
Ghrelin是一种特异性的促生长激素分泌素,Ghrelin及其功能性受体GHSR1a在下丘脑、海马和垂体都有丰富的表达[25]。我们前期研究发现Ghrelin通过抑制大鼠海马神经元的凋亡起到改善糖尿病大鼠认知功能障碍的作用[9]。本实验中运用Ghrelin干预后,糖尿病大鼠海马、血清中DKK-1的表达下调,WNT信号通路处于激活状态,β-catenin的表达上调,大鼠认知功能得到改善;Ghrelin的作用被其受体拮抗剂阻断后DKK-1保持高表达,WNT信号通路处于抑制状态,β-catenin的表达下调,改善大鼠认知功能作用消失;表明Ghrelin可能通过调控dkk-1的表达改善糖尿病大鼠认知功能,其机制可能是激活WNT/β-catenin信号通路,减少了神经元细胞及其细胞器损伤。
综上所述,Ghrelin结合受体GHSR-1a后,通过调控糖尿病大鼠海马组织及血清中DKK-1的表达,激活了WNT/β-catenin信号通路,从而改善糖尿病大鼠的认知功能障碍。本实验阐明了Ghrelin改善糖尿病大鼠认知功能障碍的部分作用机制。然而,糖尿病脑病的发病机制极其复杂,目前对WNT/β-catenin信号通路的研究也主要集中在阿尔茨海默病、帕金森病等其他神经退行性病变,它与糖尿病脑病的相关研究还处于探索阶段,继续深入研究二者之间的联系对于阐明糖尿病脑病的发病机制以及指导其临床诊断与防治都有重要意义。
| [1] |
Liu YW, Zhu X, Zhang L, et al. Cerebroprotective effects of ibuprofen on diabetic encephalopathy in rats[J].
Pharmacol Biochem Behav,2014, 117 (1) : 128-36.
( 0) 0)
|
| [2] |
Alagiakrishnan K, Sankaralingam S, Ghosh M, et al. Antidiabetic drugs and their potential role in treating mild cognitive impairment and Alzheimer's disease[J].
Discov Med,2013, 16 (90) : 277-86.
( 0) 0)
|
| [3] |
卢正红, 方小正, 陈敏, 等. 2型糖尿病患者胰岛素抵抗与认知功能的关系[J].
中国老年学杂志,2010 (17) : 2412-4.
( 0) 0)
|
| [4] |
Tiwari SK, Seth B, Agarwal S, et al. Ethosuximide induces hippocampal neurogenesis and reverses cognitive deficits in an amyloid-β toxin-induced alzheimer rat model via the phosphatidylinositol 3-Kinase (PI3K)/Akt/Wnt/β-Catenin pathway[J].
J Biol Chem,2015, 290 (47) : 28540-58.
DOI: 10.1074/jbc.M115.652586. ( 0) 0)
|
| [5] |
Takata N, Sakakura E, Sasai Y. Activation of Wnt/ß-catenin signaling in ESC promotes rostral forebrain differentiation in vitro[J].
In Vitro Cell Dev Biol Anim,2015, 1 (1) : 1-9.
( 0) 0)
|
| [6] |
Yang Z, Wu Y, Zheng L, et al. Conditioned medium of Wnt/β-catenin signaling-activated olfactory ensheathing cells promotes synaptogenesis and neurite growth in vitro[J].
Cell Mol Neurobiol,2013, 33 (7) : 983-90.
DOI: 10.1007/s10571-013-9966-z. ( 0) 0)
|
| [7] |
Pöykkö SM, Kellokoski E, Hörkkö S, et al. Low plasma ghrelin is associated with insulin resistance, hypertension, and the prevalence of type 2 diabetes[J].
Diabetes,2003, 52 (10) : 2546-53.
DOI: 10.2337/diabetes.52.10.2546. ( 0) 0)
|
| [8] |
张海娜, 高原, 吴绮楠, 等. 替米沙坦对糖尿病大鼠认知功能及大脑皮质Ghrelin受体表达的影响[J].
第三军医大学学报,2008, 30 (14) : 1342-5.
( 0) 0)
|
| [9] |
Ma LY, Zhang DM, Tang Y, et al. Ghrelin-attenuated cognitive dysfunction in streptozotocin-induced diabetic rats[J].
Alzheimer Dis Assoc Disord,2011, 25 (4) : 352-63.
DOI: 10.1097/WAD.0b013e31820ce536. ( 0) 0)
|
| [10] |
Biessels GJ, Kamal A, Ramakers GM, et al. Place learning and hippocampal synaptic plasticity in streptozotocin-induced diabetic rats[J].
Diabetes,1996, 45 (9) : 1259-66.
DOI: 10.2337/diab.45.9.1259. ( 0) 0)
|
| [11] |
包新明, 舒斯云.
大鼠脑立体定向图谱[M]. 北京: 人民卫生出版社, 1991 : 10 -63.
( 0) 0)
|
| [12] |
Tang Y, Nyengaard JR. A stereological method for estimating the total length and size of myelin fibers in human brain white matter[J].
J Neurosci Methods,1997, 73 (2) : 193-200.
DOI: 10.1016/S0165-0270(97)02228-0. ( 0) 0)
|
| [13] |
Whitmer RA. Type 2 diabetes and risk of cognitive impairment and dementia[J].
Curr Neurol Neurosci Rep,2007, 7 (5) : 373-80.
DOI: 10.1007/s11910-007-0058-7. ( 0) 0)
|
| [14] |
Alvarez EO, Ruarte MB. Histaminergic neurons of the ventral hippocampus and the baso-lateral amygdala of the rat:functional interaction on memory and learning mechanisms[J].
Behav Brain Res,2002, 128 (1) : 81-90.
DOI: 10.1016/S0166-4328(01)00272-8. ( 0) 0)
|
| [15] |
刘志华, 汪惠丽, 吴圣, 等. 发育期双酚A暴露通过Wnt信号通路影响海马齿状回区突触形成[J].
中国药理学与毒理学杂志,2014, 28 (2) : 161-7.
( 0) 0)
|
| [16] |
王艳飞, 徐向平. Wnt信号通路与颞叶癫痫海马神经发生[J].
中国实用儿科杂志,2011, 26 (11) : 859-61.
( 0) 0)
|
| [17] |
Caraci F, Busceti C, Biagioni F, et al. The Wnt antagonist, Dickkopf-1, as a target for the treatment of neurodegenerative disorders[J].
Neurochem Res,2008, 33 (12) : 2401-6.
DOI: 10.1007/s11064-008-9710-0. ( 0) 0)
|
| [18] |
Inestrosa NC, Toledo EM. The role of Wnt signaling in neuronal dysfunction in Alzheimer's Disease[J].
Mol Neurodegener,2008, 3 (1) : 1-9.
DOI: 10.1186/1750-1326-3-1. ( 0) 0)
|
| [19] |
Clevers H, Nusse R. Wnt/β-Catenin signaling and disease[J].
Cell,2012, 149 (6) : 1192-205.
DOI: 10.1016/j.cell.2012.05.012. ( 0) 0)
|
| [20] |
Wan W, Xia S, Kalionis B, et al. The role of Wnt signaling in the development of Alzheimer's disease:a potential therapeutic target?[J].
Biomed Res Int,2014 (1) : 301575-9.
( 0) 0)
|
| [21] |
Endo Y, Beauchamp E, Woods D, et al. Wnt-3a and dickkopf-1 stimulate neurite outgrowth in ewing tumor cells via a frizzled3-and c-Jun n-terminal kinase-dependent mechanism[J].
Mol Cell Biol,2008, 28 (7) : 2368-79.
DOI: 10.1128/MCB.01780-07. ( 0) 0)
|
| [22] |
Rawal N, Corti O, Sacchetti P, et al. Parkin protects dopaminergic neurons from excessive Wnt/beta-catenin signaling[J].
Biochem Biophys Res Commun,2009, 388 (3) : 473-8.
DOI: 10.1016/j.bbrc.2009.07.014. ( 0) 0)
|
| [23] |
Caricasole A, Copani A, Caraci F, et al. Induction of dickkopf-1, a negative modulator of the Wnt pathway, is associated with neuronal degeneration in alzheimer's brain[J].
J Neurosci,2004, 24 (26) : 6021-7.
DOI: 10.1523/JNEUROSCI.1381-04.2004. ( 0) 0)
|
| [24] |
Lattanzio S, Santilli F, Liani R, et al. Circulating dickkopf-1 in diabetes mellitus:association with platelet activation and effects of improved metabolic control and low-dose aspirin[J].
J Am Heart Assoc,2014, 3 (4) : e001000-11.
DOI: 10.1161/JAHA.114.001000. ( 0) 0)
|
| [25] |
Cowley MA, Smith RG, Diano S, et al. The distribution and mechanism of action of ghrelin in the CNS demonstrates a novel hypothalamic circuit regulating energy homeostasis[J].
Neuron,2003, 37 (4) : 649-61.
DOI: 10.1016/S0896-6273(03)00063-1. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
