2. 四川省肿瘤医院研究所, 四川 成都 610041
2. Cancer Institute, Sichuan Cancer Hospital, Chengdu 610041, China
乳腺癌是女性最常见的恶性肿瘤之一,己位居妇女恶性肿瘤死因的首位[1]。由于乳腺癌起病隐匿,部分乳腺癌患者检出或确诊时已属中晚期,治疗效果不甚理想。因此,及时的诊断和治疗是降低死亡率的关键措施。目前,乳腺癌血清学筛查和临床监控主要基于糖类抗原CA153、CA27.29以及癌胚抗原(CEA),然而这些肿瘤标志物由于缺乏足够高的诊断灵敏度和特异性因而限制了其对原发性乳腺癌诊断价值的应用[2]。因而,寻找一种高灵敏度和特异性的新型肿瘤标志物对乳腺癌的诊断和监控尤为重要。
HOX转录反义RNA(HOX transcript antisense RNA, HOTAIR)是一个长度为2200 bp长链非编码RNA,其能够募集多梳蛋白复合物2(PRC2)并使其定位到HOXD基因位点,促进乳腺癌的发生发展进程[3]。前期研究发现,无论在原发性还是转移性乳腺癌组织中HOTAIR均表达增高,高表达的HOTAIR能够促进乳腺癌的侵袭转移且患者预后较差[4]。HOTAIR还能与miR-568和miR-148a等相互作用,上调钙结合蛋白S100A4和G蛋白偶联雌激素受体1(GPER1),从而促进乳腺癌的转移进程[5-6]。最近,Zhang等[7]研究发现,HOTAIR在乳腺癌血清中表达增高,可作为乳腺癌诊断的新型标志物。然而,外周血中过表达HOTAIR较传统标记物CA153、CEA对乳腺癌的诊断价值及其对患者体内肿瘤动态监控价值却未见报道。
我们拟通过实时定量PCR(RT-PCR)的方法,观察HOTAIR在乳腺癌组织和血浆中相对于其对照组之间的表达差异,分析血浆HOTAIR与各临床病理特征的相关性以及对乳腺癌的诊断价值,同时进一步分析血浆中的HOTAIR对患者体内肿瘤动态监测情况,旨在为乳腺癌的诊断和监控提供新的依据。
1 资料和方法 1.1 乳腺癌组织和血浆标本收集采集2014年10月~2015年9月西南医科大学附属医院乳腺癌初诊患者病理组织标本24例,癌旁对照组织标本24例;术前乳腺癌血浆标本70例,健康对照血浆标本86例;进一步收集24位乳腺癌患者术前和术后10 d血浆样本分别24例(此24位乳腺癌患者与所募集的24例组织标本患者为相对应的同一人)。本实验所有标本均新鲜采集,且标本收集前均未做过任何治疗。此外,各病例组均为术前诊断为乳腺癌,术后病理确诊为乳腺癌患者,且病例组和对照组年龄差异无统计学意义,均已签署知情同意书。
1.2 主要试剂与设备 1.2.1 主要试剂组织RNA提取试剂TRIZOL(TaKaRa,大连宝生物),血浆RNA提取试剂盒(bioteke,北京百泰克),PrimeScriptTMRTⅡ逆转录试剂盒(TaKaRa,大连宝生物),SYBR® Premix Ex TaqⅡ扩增试剂盒(TaKaRa,大连宝生物),PCR引物(上海生工生物工程有限公司),血浆CA153和CEA检测试剂盒(Roche,瑞士)。
1.2.2 主要设备ABI 7500 Fast荧光定量PCR仪器(ABI,美国),UV-2450紫外分光光度计(日本岛津),Gel Doc XR+凝胶成像仪(Bio-Rad,美国),XH600电泳仪(上海昕慧),罗氏cobas e 601电化学发光免疫分析仪器(Roche,瑞士)。
1.3 实验方法 1.3.1 标本处理所有组织标本切下后迅速放入液氮中冷冻,并置于-80 ℃冰箱备用;术前或治疗前取每位乳腺癌患者及对照组血浆标本一式两份分别置于5 mL EDTA-2K(BD,美国)真空管中,迅速以1500 r/min离心30 min分离血浆。将分离后的血浆标本一份用于CA153和CEA的检测;一份吸取250 μL置于RNA保存液(bioteke)中放入-80 ℃冰箱保存备用,以防止RNA的降解和污染。
1.3.2 总RNA的提取及逆转录按照试剂说明书要求,分别使用TRIZOL和bioteke试剂提取组织和血浆中的总RNA,用gDNA Eraser去除基因组DNA,将提取后的RNA进行纯度(A260/A280)和完整性检测,剔除不合格标本不参与后续实验。采用宝生物试剂盒(PrimeScriptTM RTⅡ)进行逆转录反应,将得到的cDNA保存于-80 ℃备用。
1.3.3 内参选择及HOTAIR mRNA表达水平的检测查阅参考文献[8]并进行相关性实验,最终选择组织和血清中稳定表达的β-actin作为内参。内参β-actin及HOTAIR引物由Primer5软件进行设计,经BLAST比对后由上海生工生物工程有限公司合成。引物序列: β-actin上游5'-TCCTCTCCCAAGTCCACACA-3',下游5'-GCACGAAGGCTCATCATTCA-3';HOTAIR上游5'-GGTAGAAAAAGCAACCACGAAGC-3',下游: 5'-ACAT-AAACCTCTGTCTGTGAGTGCC-3。采用SYBR® Premix Ex TaqⅡ试剂盒,应用实时定量PCR扩增仪(ABI 7500)检测每个扩增循环后SYBR® Green荧光信号水平,20 μL反应体系,反应条件:预变性95 ℃ 30 s后,进行40个循环反应: 95 ℃ 5 s,60 ℃ 34 s,运用溶解曲线检测扩增产物纯度。采用相对定量2-ΔΔCt的方法对获得的CT值进行统计分析。
1.3.4 血浆中CEA和CA153表达水平的检测采用罗氏cobas e 601电化学发光免疫分析仪器检测血浆中CEA和CA153表达水平,仪器使用方法和操作进程按照cobas e 601操作规范进行。
1.4 统计分析使用SPSS22.0统计软件对数据进行处理分析。对连续变量指标进行数据分布检验,正态分布且方差齐性,数据以均数±标准差表示,组间比较采用独立样本t检验;否则,数据以中位数(M)及四分位数间距(QR)表示,组间比较采用非参数Mann-Whiney U检验,利用GraphPad Prism 5.0软件进行图像绘制。对病例组与对照组结果用SigmaPlot 12.5绘制受试者工作曲线(Receiver-operator characteristic, ROC),ROC曲线下面积的比较用Hanley-McNeil非参数检验法。以P < 0.05为差异有统计学意义。
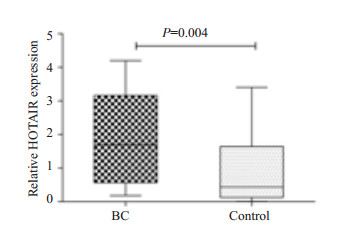
2 结果 2.1 检测HOTAIR在乳腺癌组织中的表达采用定量PCR的方法对24例乳腺癌病例组和24例对照组组织标本中的HOTAIR进行检测,分析HOTAIR在乳腺癌组织中的表达水平,发现病例组HOTAIR表达水平(1.70±2.60)明显高于对照组(0.44±1.51),差异有统计学意义(P=0.004,图 1)。
|
图 1 HOTAIR在乳腺癌组织中相对于癌旁组织的表达水平 Figure 1 Expression levels of HOTAIR in breast cancer tissues relative to that in adjacent tissues. |
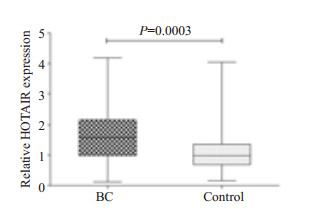
采用定量PCR的方法分析70例乳腺癌患者术前血浆中HOTAIR相对于86例对照组的表达水平,发现HOTAIR在乳腺癌病例组血浆中表达水平(1.59±1.18)明显高于对照组(0.99±0.67)(P=0.0003,图 2)。
|
图 2 HOTAIR在乳腺癌血浆中相对于对照组的表达水平 Figure 2 Mean plasma level of HOTAIR in breast cancer patients relative to that in healthy controls. |
通过对70例乳腺癌患者病理资料统计分析发现,血浆中HOTAIR表达水平与雌激素受体(ER)(P=0.04)和淋巴结转移相关(P=0.010),而与患者年龄、肿瘤分期、孕激素受体(PR)、c-erbB-2及Ki-67不具有相关性(表 1)。
| 表 1 乳腺癌患者血浆中HOTAIR表达水平与临床特征相关性 Table 1 Correlation of plasma HOTAIR and clinical characteristics of the breast cancer patients |
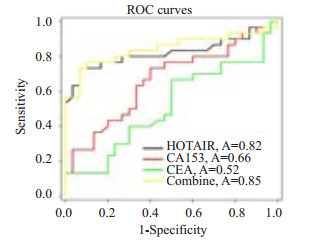
为了评价血浆中过表达的HOTAIR相对于传统标志物对乳腺癌的诊断价值,我们采用电化学发光免疫测定法检测70病例组和86例对照组血浆中CA153和CEA表达水平,并采用SigmaPlot 12.5绘制绘制ROC曲线,发现血浆中过表达的HOTAIR曲线下面积(AUC=0.82)明显大于乳腺癌传统标志物CA153(AUC=0.66,P=0.030)和CEA(AUC=0.52,P=0.001),且HOTAIR诊断灵敏度和特异性高于CA153和CEA(表 2),3项指标联合分析后,其诊断效能明显高于3项指标的单独检测(图 3)。
|
图 3 血浆中HOTAIR相对于传统标志物CA153和CEA对乳腺癌的诊断价值 Figure 3 Diagnostic value of plasma HOTAIR relative to that of the conventional tumor markers CA153 and CEA for breast cancer. |
| 表 2 HOTAIR及乳腺癌传统标志物CA153、CEA的灵敏度和特异度 Table 2 Diagnostic sensitivity and specificity of plasma HOTAIR, CA153 and CEA for breast cancer |
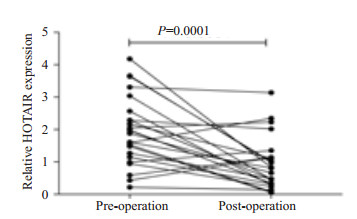
为了评价血浆中过表达的HOTAIR对乳腺癌患者肿瘤的动态监控情况,我们采用定量PCR的方法分析24位乳腺癌患者术前和术后血浆中HOTAIR的表达水平,发现术后HOTAIR表达水平(0.74±0.62)较术前(1.95±1.05)明显降低(图 4,P=0.0001)。
|
图 4 乳腺癌患者术前和术后血浆中HOTAIR表达水平 Figure 4 Plasma HOTAIR levels in breast cancer patients before and after the operation. |
为了明确乳腺癌患者组织和血浆中HOTAIR表达相关性,我们采用定量PCR的方法分析24位乳腺癌初诊患者组织与对应血浆中HOTAIR表达相关性,发现血浆中HOTAIR表达水平与组织中度相关(r=0.62,P < 0.0001,图 5)。
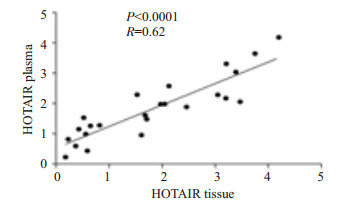
|
图 5 乳腺癌组织和血浆标本中HOTAIR表达水平的Spearman秩相关散点图 Figure 5 Spearman's rank correlation scatter plot of HOTAIR levels in tumor samples and plasma of breast cancer patients. |
目前,乳腺癌血清学诊断和临床监控生物标志物主要为CA153、CA27.29以及CEA,然而这些肿瘤标志物由于缺乏足够高的诊断灵敏度和特异性因而使得在乳腺癌诊断方面优势明显不足。近年来研究发现,循环核酸(cfCNA)广泛存在于人体血液、尿液、乳汁以及脑脊液等循环系统中,且和疾病的发生发展密切相关,通过检测循环核酸可以达到无创诊断疾病的目的,尤其是肿瘤[9-11]。循环miRNAs作为乳腺癌诊断的非浸入性生物靶标已受到广泛关注和应用,并显示出较高的临床应用价值和前景[12-14]。然而,血浆中lncRNAs表达水平对乳腺癌的诊断和监控价值报道较少。
HOTAIR作为一个长度为2.2 kb的基因间反义lncRNA。Gupta等[4]研究发现,HOTAIR高表达于原发或转移性乳腺组织中,且HOTAIR表达水平与乳腺癌的侵袭转移显著相关。在原发性乳腺癌中,HOTAIR的表达水平可作为乳腺癌最终转移和死亡的一个强有力的独立预测指标。最近,Zhang等[7]发现,HOTAIR可表达于乳腺癌外周血清中,其高表达可作为乳腺癌诊断的一个新型标志物。我们通过定量PCR的方法对24例乳腺癌组织和70例乳腺癌血浆中HOTAIR检测发现,无论在乳腺癌组织还是血浆HOTAIR表达水平均增高,且血浆中HOTAIR表达水平与淋巴结转移明显相关(P=0.01)。为了明确血浆HOTAIR对乳腺癌的诊断价值,我们对70位乳腺癌患者血浆中高表达的HOTAIR及其传统标志物CA153和CEA绘制ROC曲线并建立多元逻辑回归模型,发现HOTAIR曲线下面积(AUC)明显大于乳腺癌传统标志物CA153(P=0.030)和CEA(P=0.001),且HOTAIR诊断灵敏度和特异性高于CA153和CEA,3项指标联合分析后,其诊断效能明显高于3项指标的单独检测,表明血浆中HOTAIR可能为乳腺癌诊断的一个潜在的生物标记。
最近研究表明,HOTAIR的表达水平与雌激素受体(ERs)密切相关[15-17]。Bhan等[15]发现,在HOTAIR转录启动子区域内存在雌激素多功能反应元件(EREs)。雌激素受体(ERs)和各种雌激素受体共调节因子,如组蛋白甲基酶(MLL1、MLL3)以及CREB结合蛋白P300能够以雌二醇(E2)依赖的方式结合到HOTAIR启动子上,促使HOTAIR的表达增高,从而诱导乳腺癌的进程。相反,抑制ERs和组蛋白甲基酶(MLLs)将降低E2诱导的HOTAIR表达。此外,HOTAIR还可作为ER阳性原发性乳腺癌的一个独立预测指标,其高表达预示乳腺癌高转移风险和预后不良。Sørensen等[16]对164例原发性乳腺癌患者进行回顾性研究发现,高水平的HOTAIR与原发性乳腺癌的不良预后显著相关(P=0.012),且这一强烈相关性仅限于ER阳性的肿瘤患者(P=0.0086),而在ER阴性的肿瘤患者中未能检测到HOTAIR表达与预后价值的相关性。我们通过对49例ER阳性和21例ER阴性乳腺癌患者对比发现,ER阳性乳腺癌患者血浆中HOTAIR表达水平高于ER阴性患者(P=0.004),这进一步证实了HOTAIR表达水平与ER阳性的相关性。然而,Gökmen-Polar等[17]最近采用RNA原位杂交(RNA-ISH)的方法对133例乳腺癌患者淋巴结转移情况进行检测,并通过癌症基因组图谱(TCGA)对乳腺癌的预后价值进行分析发现,HOTAIR在乳腺导管癌中表达降低,而在ER阴性肿瘤中表达增高,且高表达的HOTAIR与淋巴结转移和ER阳性患者的预后不具有相关性。此外,HOTAIR的表达对预后的影响仅限于ER阴性的乳腺癌患者(P=0.018)。这一结论与前述研究结果具有相当的争议,这一争议在我们后续实验中将进一步扩大样本进行证实。
乳腺癌患者血液中循环核酸起源不是非常清楚,目前一般认为是癌症细胞凋亡或坏死释放入血[9, 18]。Zhou等[19]研究发现,血浆中H19的表达水平能够监测胃癌患者体内肿瘤的动态情况。通过对位胃癌患者术前和术后血浆中H19检测发现,胃癌患者血浆中H19表达水平较术前明显降低(P=0.001),且血浆中H19的表达水平与肿瘤组织中H19的表达水平相关(r=0.587,P < 0.0001)。我们通过对24位乳腺癌患者术前和术后10d血浆中的HOTAIR进行比较,发现术后血浆中HOTAIR表达水平较术前明显降低(P=0.0001)。同时,HOTAIR在血浆中表达水平与组织中表达水平中度相关(r=0.62,P < 0.0001),表明血浆中HOTAIR水平可动态反应肿瘤的表达情况,监测血浆中HOTAIR的水平将有助于乳腺癌患者手术效果评价和肿瘤复发的监控。综上所述,血浆中的HOTAIR表达水平可作为乳腺癌诊断的一个潜在的分子标志物,但其在乳腺癌中的临床实用价值以及与ER的相关性有待进一步研究。后期我们也将进一步分析溶血、脂血以及血细胞对血浆中HOTAIR的影响并扩大样本明确HOTAIR临床转化价值。
| [1] |
Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J].
Lancet Oncol,2014, 15 (7) : e279-89.
DOI: 10.1016/S1470-2045(13)70567-9. ( 0) 0)
|
| [2] |
Duffy MJ, Evoy D, Mcdermott EW. CA 15-3:uses and limitation as a biomarker for breast cancer[J].
Clin Chim Acta,2010, 411 (23/24) : 1869-74.
( 0) 0)
|
| [3] |
Rinn JL, Kertesz M, Wang JK, et al. Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs[J].
Cell,2007, 129 (7) : 1311-23.
DOI: 10.1016/j.cell.2007.05.022. ( 0) 0)
|
| [4] |
Gupta RA, Shah N, Wang KC, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J].
Nature,2010, 464 (7291) : 1071-6.
DOI: 10.1038/nature08975. ( 0) 0)
|
| [5] |
Li JT, Wang LF, Zhao YL, et al. Nuclear factor of activated T cells 5 maintained by Hotair suppression of miR-568 upregulates S100 Calcium binding protein A4 to promote breast cancer metastasis[J].
Breast Cancer Res,2014, 16 (5) : 454.
DOI: 10.1186/s13058-014-0454-2. ( 0) 0)
|
| [6] |
Tao S, He H, Chen Q. Estradiol induces HOTAIR levels via GPER-mediated miR-148a inhibition in breast cancer[J].
J Transl Med,2015, 13 : 131.
DOI: 10.1186/s12967-015-0489-x. ( 0) 0)
|
| [7] |
Zhang L, Song X, Wang X, et al. Circulating DNA of HOTAIR in serum is a novel biomarker for breast cancer[J].
Breast Cancer Res Treat,2015, 152 (1) : 199-208.
DOI: 10.1007/s10549-015-3431-2. ( 0) 0)
|
| [8] |
Dong L, Qi P, Xu MD, et al. Circulating CUDR, LSINCT-5 and PTENP1 long noncoding RNAs in sera distinguish patients with gastric cancer from healthy controls[J].
Int J Cancer,2015, 137 (5) : 1128-35.
DOI: 10.1002/ijc.v137.5. ( 0) 0)
|
| [9] |
Schwarzenbach H, Hoon DS, Pantel K. Cell-free nucleic acids as biomarkers in cancer patients[J].
Nat Rev Cancer,2011, 11 (6) : 426-37.
DOI: 10.1038/nrc3066. ( 0) 0)
|
| [10] |
Dawson SJ, Tsui DW, Murtaza M, et al. Analysis of circulating tumor DNA to monitor metastatic breast cancer[J].
N Engl J Med,2013, 368 (13) : 1199-209.
DOI: 10.1056/NEJMoa1213261. ( 0) 0)
|
| [11] |
De Leeneer K, Claes K. Non coding RNA molecules as potential biomarkers in breast cancer[J].
Adv Exp Med Biol,2015, 867 : 263-75.
DOI: 10.1007/978-94-017-7215-0. ( 0) 0)
|
| [12] |
Shaker O, Maher M, Nassar Y, et al. Role of microRNAs-29b-2, -155, -197 and -205 as diagnostic biomarkers in serum of breast cancer females[J].
Gene,2015, 560 (1) : 77-82.
DOI: 10.1016/j.gene.2015.01.062. ( 0) 0)
|
| [13] |
Müller V, Gade S, Steinbach B, et al. Changes in serum levels of miR-21, miR-210, and miR-373 in HER2-positive breast cancer patients undergoing neoadjuvant therapy:a translational research project within the Geparquinto trial[J].
Breast Cancer Res Treat,2014, 147 (1) : 61-8.
DOI: 10.1007/s10549-014-3079-3. ( 0) 0)
|
| [14] |
Bertoli G, Cava C, Castiglioni I. MicroRNAs:new biomarkers for diagnosis, prognosis, therapy prediction and therapeutic tools for breast cancer[J].
Theranostics,2015, 5 (10) : 1122-43.
DOI: 10.7150/thno.11543. ( 0) 0)
|
| [15] |
Bhan A, Hussain I, Ansari KI, et al. Antisense transcript long noncoding RNA(lncRNA)HOTAIR is transcriptionally induced by estradiol[J].
J Mol Biol,2013, 425 (19) : 3707-22.
DOI: 10.1016/j.jmb.2013.01.022. ( 0) 0)
|
| [16] |
Sørensen KP, Thomassen M, Tan Q, et al. Long non-coding RNA HOTAIR is an Independent prognostic marker of metastasis in estrogen receptor-positive primary breast cancer[J].
Breast Cancer Res Treat,2013, 142 (3) : 529-36.
DOI: 10.1007/s10549-013-2776-7. ( 0) 0)
|
| [17] |
Gökmen-Polar Y, Vladislav IT, Neelamraju Y, et al. Prognostic impact of HOTAIR expression is restricted to ER-negative breast cancers[J].
Sci Rep,2015, 5 : 8765.
DOI: 10.1038/srep08765. ( 0) 0)
|
| [18] |
Van d VM, Pretorius PJ. Circulating DNA. Its origin and fluctuation[J].
Ann NY Acad Sci,2008, 1137 : 18-26.
DOI: 10.1196/nyas.2008.1137.issue-1. ( 0) 0)
|
| [19] |
Zhou X, Yin C, Dang Y, et al. Identification of the long non-coding RNA H19 in plasma as a novel biomarker for diagnosis of gastric cancer[J].
Sci Rep,2015, 5 : 11516.
DOI: 10.1038/srep11516. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
