2. 南方医科大学公共卫生与热带医学学院三级生物安全实验室, 广东 广州 510515
2. Biosafety Level-3 Laboratory, Guangdong Provincial Key Laboratory of Tropical Disease Research, School of Public Health and Tropical Medicine, Southern Medical University, Guangzhou 510515, China
热疗用于肿瘤治疗由来已久,随着磁热疗技术的发展,热疗再次成为肿瘤治疗的研究热点。目前关于热疗基因水平的作用机制研究较多,有文献报道热处理可致S期阻滞及此期氧化碱基、无碱基位点、碱基脱氨基等DNA损伤形成[1]。近期较多关于热损伤后DNA双链断裂(DSB)形成的文献发表[2-6],但现有报道大多提示DSB主要发生在G1、G2期,S期无或极少产生DSB,这与S期热敏感现象矛盾。为探讨S期细胞热敏感原因,我们猜想S期细胞受热后发生碱基损伤并使损伤修复蛋白变性失活,当含碱基损伤的DNA继续指导复制时可延迟形成DSB,最终导致细胞死亡。因此本研究应用S期同步化细胞进行热处理后动态观察DSB形成,同时监测细胞周期、细胞死亡率以探讨S期热敏感原因,结合DNA复制、损伤修复蛋白结果分析DSB形成机制。
1 材料和方法 1.1 材料 1.1.1 细胞及培养条件非小细胞肺癌H1299细胞由美国北卡罗来纳教堂山分校病理学和实验医学实验室惠赠,并用含10%胎牛血清、1%双抗的DMEM完全培养基置于37 ℃、5% CO2培养箱中培养。
1.1.2 主要试剂DMEM培养基、胎牛血清、0.25%胰酶、D-Hanks液与双抗均购自美国Gibco,细胞周期检测试剂盒(KGA214)和RNase A购自凯基生物公司,锐博EdU检测试剂盒(C10310)、碧云天细胞核蛋白抽提试剂盒(P0027)均购自广州安邦生物科技有限公司,多聚甲醛(美国Sigma),低熔点琼脂糖(美国Amresco),正常熔点琼脂糖(西班牙Biowest),p-ATM(phospho S1981,英国abcam)抗体、RAD18抗体(美国CST)。
1.1.3 主要仪器细胞培养箱(美国Thermo Fisher),流式细胞仪(guava easyCyte HT,美国Millipore),倒置荧光显微镜(日本OLYMPUS IX51),图像采集系统(日本OLYMPUS DP Controller),化学发光成像系统(中国Tanon)。
1.2 方法 1.2.1 细胞热损伤取对数生长期细胞换为45 ℃预热的培养基后迅速放入45 ℃ 5% CO2孵箱加热1 h(研究的预实验—平板克隆形成实验结果提示克隆形成率为50%左右的加热条件为45 ℃×1 h),热处理后换为37 ℃预热的培养基并根据实验目的放回37 ℃孵箱内继续培养0、2.5、5、7.5、10、12.5 h用于后续实验。
1.2.2 流式细胞术周期检测将各组细胞用胰酶消化、离心收集细胞沉淀后参照周期检测试剂盒说明书操作:PBS清洗2遍再加入适量70%乙醇于4 ℃过夜固定;次日弃掉固定液并用PBS清洗,重悬细胞使浓度为1×105/mL,加入适量的RNase储备液37 ℃水浴30 min去除RNA后再加入PI染液常温避光染色30 min,上机检测,最后用Modifit软件分析检测结果。每组各3瓶细胞,实验重复3次。
1.2.3 EdU掺入实验将96孔板中对数生长期细胞进行实验处理后参照EdU试剂盒说明书操作:每孔加入50 μL 50 μmoL的EdU培养基孵育2 h后用4%多聚甲醛固定,再每孔加入50 μL 1×Apollo染色反应液避光染色EdU,1×Hoechst33342反应液复染DNA。最后每孔随机选5个视野用荧光显微镜拍照、Image-Pro Plus6.0软件计数,EdU阳性率=复染细胞数/总细胞数。每组各设3个复孔。
1.2.4 血清饥饿法细胞周期同步将对数生长期细胞用D-Hanks液清洗两遍后加入无血清DMEM进行饥饿培养,饥饿时间参考Akihisa Takahashi报道的28 h[6],然后恢复全培继续培养,每2 h随机取3皿细胞(汇合度 < 100%)采用流式细胞术检测周期并将检测结果绘制成周期图,将周期图中S期比例最高的时间点作为H1299细胞S期的同步条件。
1.2.5 中性彗星实验参照Velichko,A.K.的实验步骤[2]并稍作调整:(1)铺胶:取150 μL正常熔点琼脂糖凝胶均匀铺于毛玻璃载玻片,置4 ℃固化,分别取30 μL各组细胞悬液与70 μL低熔点琼脂糖凝胶混匀后均匀铺于第1层凝胶上,4 ℃固化;(2)裂解和电泳:凝胶板置于新鲜配制的中性裂解液并于4 ℃裂解2 h;TE溶液漂洗去掉多余盐分,于4 ℃电泳液(TBE溶液,pH:8.2~8.5)中解旋30 min后电泳(25 V 30 min);(3)染色和观察:PI染色后荧光显微镜(×20)下观察并每个样本随机摄取3个视野。CASP软件分析各样本结果,Olive尾距(OTM)作为分析指标。实验重复3次。
1.2.6 蛋白免疫印记实验按细胞核蛋白提取试剂盒操作步骤提取DNA结合蛋白并用BCA法测定蛋白浓度,各组细胞分别取50 μg蛋白用10% SDS-PAGE凝胶进行分离。完成电泳后利用半干转法将蛋自质转印至PVDF膜,将膜以脱脂奶粉封闭后转入p-ATM、RAD18蛋白抗体稀释液中4 ℃孵育过夜, 然后用过氧化物酶偶联的二抗孵育2 h,最后经充分清洗后以ECL化学发光法显色曝光并采集图片。
1.2.7 台盼蓝拒染实验将各组细胞悬液浓度调整为5×105/mL,分别吸出0.9 mL均匀细胞液,加0.1 mL 0.4%的台盼蓝混匀染色,3 min内计数,细胞变蓝者为死细胞,每瓶细胞计数3次,取均值。细胞死亡率=死细胞总数(/活细胞总数/死细胞总数)×100%。
1.3 统计学方法实验数据用SPSS 20.0统计软件分析,两组间比较采用两独立样本t检验,检验水准α=0.05,P < 0.05为差异具有统计学意义。
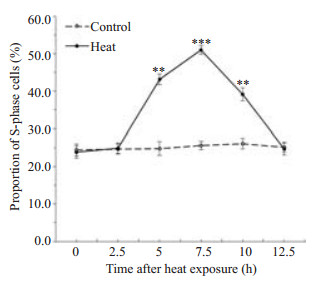
2 结果 2.1 H1299细胞经45 ℃热损伤1 h后可致S期阻滞热处理后动态观察加热组及对照组细胞的周期分布(图 1)可看出:H1299细胞热损伤后随着37 ℃正常孵育时间延长,S期细胞逐渐增多并于7.5 h左右比例达到最高:(51.63±0.27)%;之后S期比例逐渐减小,提示阻滞解除。未加热组S期比例变化微小。正常孵育5、7.5、10 h加热组S期比例与对照组差异有统计学意义(P < 0.01)。
|
图 1 H1299细胞热损伤(45 ℃×1 h)后加热组与对照组的S期比例对比 Figure 1 Proportion of S-phase cells in heat exposure group(45 ℃×1 h) and control group. Data are presented as Mean±SD from 3 independent experiments (**P < 0.01, ***P < 0.001). |
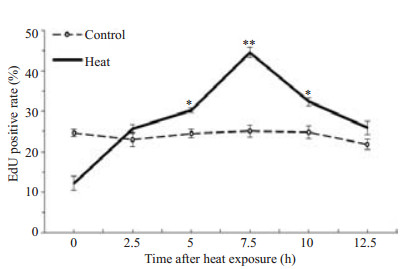
为了验证45 ℃热损伤1 h后细胞复制是否停止,我们进行了EdU掺入实验。其结果(图 2)与图 1比较分析可知EdU阳性率与S期比例随时间变化的趋势相似:两者均以7.5 h为界先升后降。
|
图 2 H1299细胞热损伤(45 ℃×1 h)后加热组与对照组的EdU阳性率比较 Figure 2 Comparison of EdU positivity rate between heat exposure group(45 ℃ × 1 h) and control group. Data are presented as Mean±SD from 3 independent experiments (*P < 0.05, **P < 0.01). |
本实验采用血清饥饿法同步周期,根据其结果可知H1299细胞经血清饥饿培养28 h再恢复全培18 h可有效使细胞同步至S期,其比例可达(69.27±0.81)%;而未经饥饿的细胞S期持续在(27.24±1.75)%。
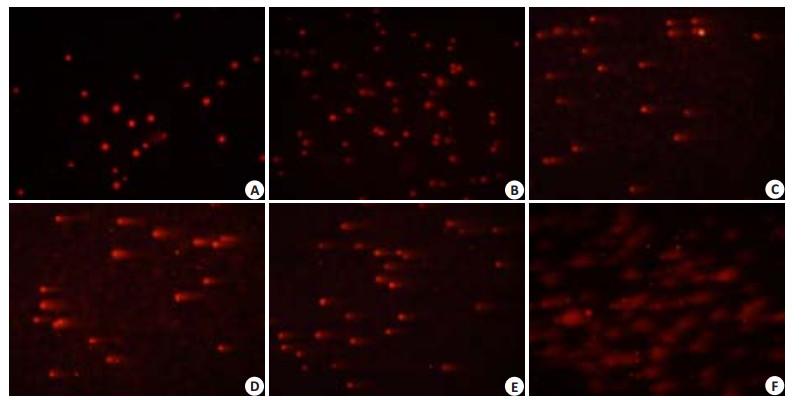
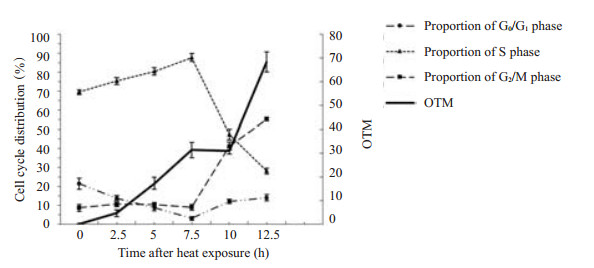
2.4 S期H1299细胞热损伤后延迟形成DSB图 3可看出S期H1299细胞热处理并恢复37 ℃培养0、2.5 h组细胞均未见明显的“彗星拖尾”现象,其OTM值与对照组亦无统计学差异(图 4);正常培养5 h后开始出现明显的“慧尾”,OTM值与对照组有统计学差异(P < 0.05)。将OTM值与细胞周期变化比较可知OTM值变化趋势同S期比例变化(图 4)
|
图 3 S期H1299细胞热损伤后的彗星图像 Figure 3 Comet images of S-phase synchronized H1299 cells at different time points after thermal exposure(Original magnification: × 20). A: 0 h; B: 2.5 h; C: 5 h; D: 7.5 h; E: 10 h; F: 12.5 h. |
|
图 4 S期H1299细胞热损伤(45 ℃×1 h)后尾力矩(OTM值)及细胞周期的变化趋势 Figure 4 Variation of Olive tail moment and cell cycle distribution in S-phase synchronized H1299 cells after heat exposure. Data are presented as Mean±SD from 3 independent experiments. |
台盼蓝拒染实验结果(图 5)显示S期H1299细胞热损伤后恢复正常培养7.5 h前H1299细胞死亡率保持较低水平,7.5 h后死亡细胞迅速增多。
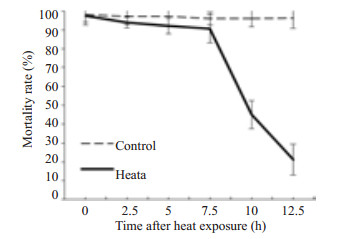
|
图 5 台盼蓝拒染实验检测热处理(45 ℃×1 h)对S期H1299细胞死亡率的影响 Figure 5 Effect of heat exposure(45 ℃ × 1 h) on cell viability of S-phase synchronized H1299 cells measured by Trypan blue dye exclusion assay. Data are presented as Mean±SD from 3 independent experiments. |
未加热细胞无ATM磷酸化,加热组细胞ATM磷酸化水平逐渐增高直至恢复正常培养5 h达最多,之后磷酸化水平下降至消失;加热后DNA结合的RAD18较对照组显著减少(图 6)。
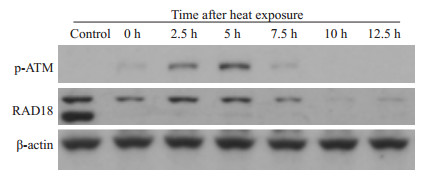
|
图 6 热损伤(45 ℃ × 1 h)后ATM磷酸化、DNA结合RAD18的变化 Figure 6 Changes of ATM phosphorylation and DNA binding RAD18 in cells after heat exposure (45 ℃×1 h). |
热处理自用于肿瘤治疗以来常作为放、化疗的疗效“增敏剂”应用于临床[7],随着近几年磁流体热疗技术的发展,肿瘤热疗再次成为研究热点[8]。目前研究者认为热疗增强放疗疗效的机制之一是放疗抵抗的S期细胞对热损伤敏感,两者存在互补杀伤作用[9],但S期细胞热损伤敏感的机制尚不清楚。有研究报道热处理可致细胞S期阻滞[10],我们的研究亦发现H1299热损伤后S期比例逐渐升高,且DNA复制活性迅速恢复(图 1、2)。Ghosal等[11]认为当DNA损伤存在时细胞将启动S期阻滞以修复损伤,ATM的S1981位点磷酸化为周期阻滞调节通路的重要环节。故我们研究了热损伤后ATM磷酸化情况,其结果也支持上述发现(图 6),间接反应热损伤后细胞内形成了一定的碱基损伤,并进一步发生S期阻滞以利于损伤修复。
热疗增强放疗疗效的另一机制是热疗可抑制放疗形成的DSB损伤修复[12],但热疗本身可否形成DSB存在争议。Velichko报道热损伤后S期细胞仅产生DNA单链断裂(SSB),DSB主要来自非S期细胞[2]。一般情况下,含SSB的细胞尚不足以导致细胞死亡,但细胞一旦存在一个DSB未修复即可引起细胞死亡;故上述报道与S期热损伤敏感相矛盾。本研究动态观察S期H1299细胞热损伤后“彗星拖尾”现象并分析其尾力矩值,结果显示S期细胞热损伤后延迟形成DSB,且DSB形成与细胞死亡密切相关(图 3、4、5),有文章报道热疗可促进细胞凋亡[13]。我们分析Velichko未观察到S期细胞DSB形成可能是由于其观察时间较短(热后立马检测)所致。因PCR技术即使涉及95 ℃高温也未发生DNA链断裂,结合目前的研究结果可以看出S期阻滞细胞内的DSB为间接产生。有研究证实热处理可直接导致DNA碱基脱氨基及碱基位点缺失等损伤[1],并有研究发现氧化应激等导致的碱基损伤可在S期继续指导复制而形成DSB[14]。综合分析前人关于细胞内DSB形成的观点及本研究的前述结果,我们推测S期细胞受热后DSB形成的机制为:DNA复制遭遇未及时修复的碱基损伤,复制叉无法继续前行而崩溃,进而形成DSB。故我们利用蛋白免疫印记实验对多个DNA损伤修复相关蛋白表达进行分析,研究结果首次证明热处理可抑制DNA跨损伤修复:热处理后跨损伤修复蛋白RAD18与DNA结合长时间受到抑制(图 6),而RAD18所主导的跨损伤修复通路对于修复复制叉所遭遇的DNA损伤极为重要[15]。此结果支持我们关于DSB形成的猜想。
综上所述,本研究证实了S期细胞热损伤后可产生DSB,但具有延迟性特点;DSB形成的可能机制为:热损伤后DNA复制受影响较小或恢复迅速,而DNA跨损伤修复长时间受到抑制,导致复制叉遭遇不能及时修复的损伤而崩溃,然后间接形成DSB,最终导致细胞死亡。本研究丰富了肿瘤热疗可能作用机制的理论基础,使热疗有望单独应用于临床,但其详细机制有待进一步研究。
| [1] |
Takahashi TO. What is the critical hyperthermia target in cancer cells[J].
J Hyperthermic Oncol,2006, 22 (7) : 229-37.
( 0) 0)
|
| [2] |
Velichko AK, Petrova NV, Kantidze OL. Dual effect of heat shock on DNA replication and genome integrity[J].
Mol Biol Cell,2012, 23 (17) : 3450-60.
DOI: 10.1091/mbc.E11-12-1009. ( 0) 0)
|
| [3] |
李明, 张保国. 热休克预处理对高温致中国仓鼠肺细胞(V79)细胞DNA双链断裂的影响[J].
肿瘤防治研究,2012, 39 (1) : 6-8.
( 0) 0)
|
| [4] |
Roti JL. Cellular responses to hyperthermia (40-46 degrees C):Cell killing and molecular events[J].
Intern Hyperth,2008, 24 (1) : 3-15.
DOI: 10.1080/02656730701769841. ( 0) 0)
|
| [5] |
Takahashi A, Mori E, Somakos GI, et al. Heat induces gamma H2AX foci formation in mammalian cells[J].
Mutat Res,2008, 656 (1/2) : 88-92.
( 0) 0)
|
| [6] |
Takahashi A, Matsumoto H, Nagayama K, et al. Evidence for the involvement of double-strand breaks in heat-induced cell killing[J].
Cancer Res,2004, 64 (24) : 8839-45.
DOI: 10.1158/0008-5472.CAN-04-1876. ( 0) 0)
|
| [7] |
Szasz A. Current status of oncothermia therapy for lung cancer[J].
Korean J Thorac Cardiovasc Surg,2014, 47 (2) : 77-93.
DOI: 10.5090/kjtcs.2014.47.2.77. ( 0) 0)
|
| [8] |
Kim KS, Lee SY. Nanoparticle-mediated radiofrequency capacitive hyperthermia:A phantom study with magnetic resonance thermometry[J].
Int J Hyperthermia,2015, 31 (8) : 831-9.
DOI: 10.3109/02656736.2015.1096968. ( 0) 0)
|
| [9] |
Kaur P, Hurwitz MD, Krishnan S, et al. Combined hyperthermia and radiotherapy for the treatment of cancer[J].
Cancers (Basel),2011, 3 (4) : 3799-823.
DOI: 10.3390/cancers3043799. ( 0) 0)
|
| [10] |
Velichko AK, Petrova NV, Razin SV. Mechanism of heat stressinduced cellular senescence elucidates the exclusive vulnerability of early S-phase cells to mild genotoxic stress[J].
Nucleic Acids Res,2015, 43 (13) : 6309-20.
DOI: 10.1093/nar/gkv573. ( 0) 0)
|
| [11] |
Ghosal G, Chen JJ. DNA damage tolerance:a double-edged sword guarding the genome[J].
Transl Cancer Res,2013, 2 (3) : 107-29.
( 0) 0)
|
| [12] |
Genet SC, Fujii Y, Maeda J, et al. Hyperthermia inhibits homologous recombination repair and sensitizes cells to ionizing radiation in a time-and temperature-dependent manner[J].
J Cell Physiol,2013, 228 (7) : 1473-81.
DOI: 10.1002/jcp.24302. ( 0) 0)
|
| [13] |
高琨, 方绳权, 张彩红, 等. 同步热放化疗对宫颈癌组织Bax、Bcl-2、P53蛋白表达的影响[J].
南方医科大学学报,2009, 29 (12) : 2537-9.
( 0) 0)
|
| [14] |
Fridlich R, Annamalai D, Roy R, et al. BRCA1 and BRCA2 protect against oxidative DNA damage converted into double-strand breaks during DNA replication[J].
DNA Repair (Amst),2015, 30 (9) : 11-20.
( 0) 0)
|
| [15] |
Sasatani M, Xu Y, Kawai H, et al. RAD18 activates the G2/M checkpoint through DNA damage signaling to maintain genome integrity after ionizing radiation exposure[J].
PLoS One,2015, 10 (2) : e117845.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
