2. 南昌工学院基础教学部, 江西 南昌 330108
2. Department of Basic Education, Nanchang Technology University, Nanchang 330108, China
邻苯二甲酸二(2-乙基)己酯[(Di-(2-ethylhexyl)phthalate, DEHP]属于邻苯二甲酸酯类化合物,作为一种增塑剂及化妆品添加剂被广泛使用且存在于环境中,由于DEHP与塑料制品之间不能产生共价结合,随着产品的反复使用、加热及清洗,其可通过呼吸、饮水、饮食及皮肤接触等途径进入机体,对动物和人体造成危害[1-3]。已有研究表明,妊娠期间DEHP的暴露,可导致子宫内膜接受性明显下降、妊娠率的降低、胎儿流产率升高以及胎儿体质量减轻等现象发生[4-6]。然而,这些现象发生是否与妊娠期间DEHP暴露导致胎盘的生长发育障碍以及母胎界面uNK细胞和血管形成密切相关呢?至目前为止,还未见相关的研究。本项目拟通过强制性灌胃方法,在体观察妊娠期间DEHP暴露对小鼠胎盘生长发育、母胎界面uNK细胞数及血管形成的影响。
1 材料和方法 1.1 实验动物及处理成年雌、雄性昆白小鼠(8~10周龄,体质量30 g左右)购于江西中医药大学实验动物科技中心,在室温25 ℃左右、周期性光照14 h的条件下饲养。将处于动情期雌鼠小鼠分别与同品系雄鼠进行交配,次日早晨检出阴栓日定为妊娠第1天。妊娠的小鼠随机分为4个组(n=10):对照组、125 mg·kg-1·d-1 DEHP组、250 mg·kg-1·d-1 DEHP组及500 mg·kg-1·d-1 DEHP组。从妊娠第1天至处死当天,每天早晨8:30通过灌胃的方式给予植物油以及用植物油配制不同浓度的DEHP。于妊娠第13天16:00称重,通过颈脱位处死,取出相应的子宫及胎盘组织进行拍照、统计胚胎着床数及称重,且冷冻至-80 ℃中保存以供进一步分析。
1.2 HE染色石蜡切片依次浸泡于二甲苯Ⅰ、二甲苯Ⅱ中各10 min,递度酒精水化。然后用PBS清洗5 min,苏木精染色5 min,用自来水清洗多余的苏木精后,浸泡在PBS内5 min。用1%盐酸乙醇中分化3 s,然后迅速用自来水冲洗,水中返蓝15 min。伊红染色3 min,然后用自来水冲洗5 min。依次脱水、透化,中性树脂封片。CCD采集图片,用ImageJ软件测量胎盘各个部分的面积。
1.3 免疫组织化学将上述处理的标本固定于Bouin's氏液中,经逐步脱水处理后包埋于石蜡中。组织切片(5 μm)经脱蜡、入水,将切片浸入含3%双氧水的PBS中10 min,以灭活内源性的过氧化物酶。5% BSA室温封闭60 min,弃去多余液体,再加入一抗兔抗laminin(1:1200,Sigma),或生物素化DBA-lectin一抗(1:1500, Sigma L6533)4 ℃过夜。切片经过PBS冲洗后,分别加入的HRP标记抗兔的二抗或HRP标记链霉卵白素的二抗(北京中杉金桥生物技术有限公司),37 ℃孵育1 h后,用DAB方法显色显微镜下观察,蒸馏水终止染色,苏木精复染细胞核,酒精梯度脱水,二甲苯透明,中性树脂封片。染色结果采用尼康TS-100显微镜进行镜检,Nikon致冷型CCD采集图片。对于小鼠uNK细胞判断和计数参照徐宏等[7]方法。
1.4 统计学方法结果以均值±标准差表示,数据分析采用统计软件SPSS 18.0进行分析。两组以上数据用单因素方差分析的LSD分析,统计结果P < 0.05为差异显著意义,P < 0.01为差异极显著意义。
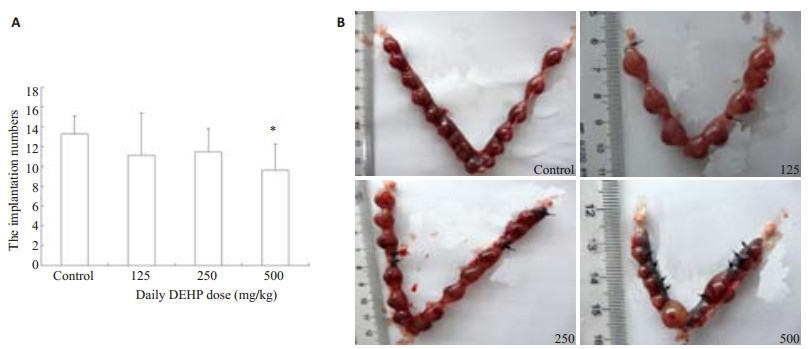
2 结果 2.1 妊娠期DEHP暴露对胚胎着床数的影响与对照组相比,低剂量DEHP 125、250 mg·kg-1·d-1对胚胎着床数没有明显影响(P > 0.05;图 1A、B)。然而,500 mg·kg-1·d-1剂量DEHP可显著性降低胚胎着床数(P < 0.05,图 1A、B)。此外,DEHP暴露可导致胎儿流产率明显上升(图 1B)。
|
图 1 DEHP对胚胎着床数的影响 Figure 1 Effect of DEHP exposure at different doses on the number of embryo implantation. A: Numbers of implanted embryos on gestational day 13. *P < 0.05 vs control group; B: Representative images of implanted embryos in the uteri on gestational day 13. Arrows: Aborted embryos. |
与对照组相比(0.0786±0.0143 g),DEHP暴露呈剂量(125、250、500 mg·kg-1·d-1)依赖性抑制胎盘的质量(分别为0.0637±0.0133、0.0587±0.0176、0.0524±0.0183 g;均为P < 0.01,图 2)。

|
图 2 DEHP对胎盘生长发育的影响 Figure 2 Effect of DEHP exposure on the growth and development of placenta. A: Control group; B, C, D: DEHP groups at the exposure doses of 125, 250, and 500 mg/kg, respectively. |
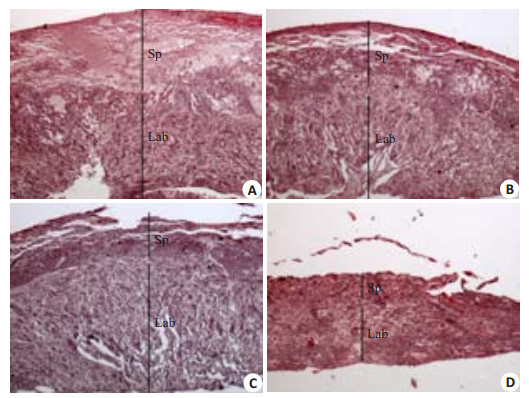
与对照组相比(100±3.70)%,DEHP暴露呈剂量(125、250、500 mg·kg-1·d-1)依赖性抑制胎盘海绵体滋养层细胞的面积[分别为(88.9±2.24)%、(55.9±8.85)%、(47.1±4.31)%;P < 0.05或0.01,图 3];相对于对照组(100±4.51)%,250 mg·kg-1·d-1和500 mg·kg-1·d-1 DEHP组能明显抑制胎盘总的面积[分别为(86.2±6.06)%、(50.9±3.32)%;P < 0.05或0.01,图 3],而125mg/(kg·d)DEHP组没有明显变化[(90.1±2.48)%,P > 0.05]。
|
图 3 DEHP对胎盘组织结构的影响 Figure 3 Effect of DEHP exposure on placental histopathology (Original magnification: × 40). A: Control group; B, C, D: DEHP groups at the exposure doses of 125, 250, and 500 mg/kg, respectively. Sp: Spongiotrophoblasts; Lab: Labyrinth. |
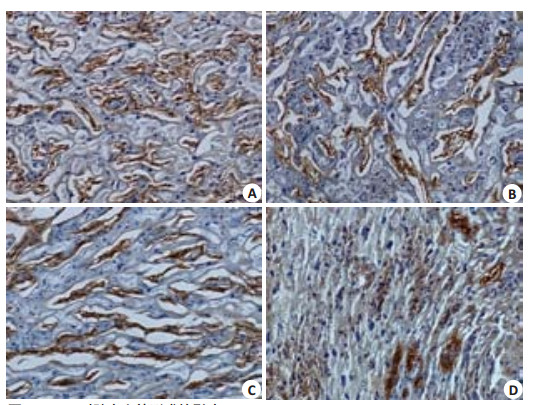
为了鉴定胎盘迷路层的胎儿血管,本研究采用层粘连蛋白(Laminin)染色,它存在于胎儿的毛细血管基膜,母体血管没有相应的表达。研究结果表明,与对照组相比,DEHP暴露将导致胎儿血管分支数明显降低,血管塌陷及闭锁(图 4),尤其在高剂量DEHP组500 mg·kg-1·d-1没有观察到小血管网的形成(图 4D)。
|
图 4 DEHP对胎盘血管形成的影响 Figure 4 Effect of DEHP on vascularization inthe placenta (Original magnification:×200). A: Control group; B, C, D: DEHP groups at the exposure doses of 125, 250, and 500 mg/kg, respectively. |
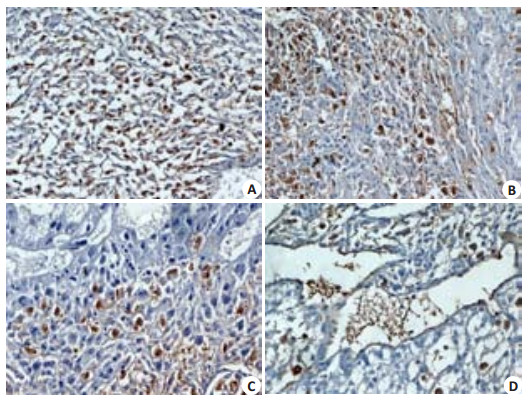
与对照组相比(105.1±14.2/HP),DEHP暴露呈剂量125、250、500 mg·kg-1·d-1依赖性抑制子宫NK细胞数(分别为83.2±10.3、60.7±12.4、50.4±14.5/HP;均为P < 0.01,图 5)。
|
图 5 DEHP对uNK细胞数的影响 Figure 5 Effect of DEHP on the numbers of uNK cells (Original magnification: × 200). A: Control group; B, C, D: DEHP groups at the exposure doses of 125, 250, and 500 mg/kg, respectively. |
胎儿的正常发育,一方面取决于子宫内膜的接受性,另外一方面还依赖于胎盘的发育。本研究显示,妊娠早期DEHP暴露,将呈剂量依赖性抑制胎盘的生长和发育,导致胎盘重量的下降以及胎儿流产率的升高。与本研究结果相一致是,顾潇等[8]研究显示,妊娠中、晚期中剂量(500 mg/kg)DEHP暴露将导致胎盘重量的减轻,但高剂量组(1000 mg/kg)胎盘体积增大,重量增加,这种结果不一致性的原因,可能是由于所用的剂量不同,本研究的最大剂量为500 mg/kg。另外一种可能原因是由于高剂量情况下,胎盘的淤血水肿所致[8]。在机体内,胎盘主要是由合体滋养层和细胞滋养层细胞所构成,故在一些离体研究中,主要观察了DEHP对滋养层细胞生长、凋亡以及迁移和侵润的影响,来间接反应其对胎盘生长发育的影响。Wang等[9]通过annexin V和TUNEL染色研究显示,DEHP可通过上调Bax基因的表达,诱导细胞滋养层细胞的凋亡。王心等[10]研究显示,DEHP可通过下调基质金属蛋白酶、整合素以及选择素家族等相关基因表达,影响早孕绒毛膜细胞滋养细胞的侵润和黏附能力,从而导致胎盘、胎儿的生长发育障碍。
胎盘的生长发育障碍,其可能是由于血管形成以及血液供应障碍所致,故本研究进一步通过层粘连蛋白染色,检测胎儿迷路层血管的发育。研究结查显示,DEHP暴露将导致胎儿血管分支数显著性降低,血管塌陷、闭锁。与此结果相似是,Li等[5]研究发现,DEHP可明显抑制子宫内膜血管的形成,导致子宫内膜接受性和胚胎着床数的下降。另外,Zei等[11]研究显示,DEHP可明显扰乱视网膜毛细血管网的排列以及抑制血管的形成。这些研究结果提示,DEHP可通过抑制血管形成和排列,导致胎盘血液灌流量的不足以及胎儿的生长发育障碍。然而,有关其具体的形成机制,如DEHP暴露是否影响VEGF的表达以及血管内皮细胞的凋亡率是否会明显增加,有待于进一步研究。
子宫自然杀伤细胞(uNK cell)是妊娠过程中一种最重要的免疫细胞,已有研究显示,它在重建母胎界面的高容量、低阻力血管以及免疫耐受和胎盘发育方面具有十分重要意义[12]。本研究通过近年来发展一种新型uNK的特异性标志物DBA-lectin[7],检测DEHP暴露对母胎界面uNK数量的影响。研究结果显示,与对照组相比,DEHP暴露呈剂量依赖性抑制uNK数量,可能导致胎盘血管的生成和重构障碍,且对胎儿这种携有父源抗原成分的半移植物产生免疫排斥,从而导致流产率的升高。这种现象在Tonk等[13]实验中也得到类似的证明,通过体外强制性灌胃方法,研究发现DEHP可明显抑制外周血液中uNK数量,且在未成年大鼠中表现更为明显,主要原因是DEHP可明显抑制性腺激素的分泌。有关其对激素分泌的影响,Guo等[14-15]研究显示,妊娠期间DEHP暴露将导致妊娠黄体数量和面积的下降以及孕酮分泌量明显降低,这种抑制作用是通过PPARγ信号途径来产生的。另外,有研究显示DEHP可抑制鱼的B淋巴细胞增殖以及减少分泌IgM的免疫细胞产生[16]。从这些结果提示,DEHP可影响不同种类的免疫细胞,其可能作用机制是通过抑制机体的性腺激素的分泌,从而影响到免疫细胞的迁移和分化,最后导致胚胎着床率的下降以及流产率的升高。
综上所述,妊娠期DEHP暴露可明显抑制胎盘的重量、母胎界面血管形成及uNK数,这可能是妊娠期间DEHP暴露导致妊娠率的降低、胎儿流产率升高以及胎儿体重下降等现象发生的原因之一。因此,妊娠期间预防、减少DEHP进入孕妇女体内以及研发非邻苯二甲酸酯类低毒性增塑剂将具有重要的社会和临床价值。
| [1] |
Kay VR, Bloom MS, Foster WG. Reproductive and developmental effects of phthalate diesters in males[J].
Crit Rev Toxicol,2014, 44 (6) : 467-98.
DOI: 10.3109/10408444.2013.875983. ( 0) 0)
|
| [2] |
杨俊杰, 马洪, 李静, 等. 邻苯二甲酸二乙基己酯及代谢产物邻苯二酸-单-2-乙基己酯对雄性幼鼠生精细胞凋亡的影响[J].
南方医科大学学报,2012, 32 (12) : 1758-63.
( 0) 0)
|
| [3] |
梁添, 欧阳俊彦, 羿利华, 等. 邻苯二甲酸二(2-乙基)己酯短期重复暴露对大鼠行为的影响[J].
南方医科大学学报,2013, 33 (3) : 401-5.
( 0) 0)
|
| [4] |
Hayashi Y, Ito Y, Nakajima T. Effects of exposure to Di (2-ethylhexyl) phthalate during fetal period on next Generation[J].
Nihon Eiseigaku Zasshi,2014, 69 (2) : 86-91.
DOI: 10.1265/jjh.69.86. ( 0) 0)
|
| [5] |
Li R, Yu C, Gao R, et al. Effects of DEHP on endometrial receptivity and embryo implantation in pregnant mice[J].
J Hazard Mater,2012, 24 (1) : 231-40.
( 0) 0)
|
| [6] |
Latini G, De Felice C, Presta G, et al. In utero exposure to di-(2-ethylhexyl) phthalate and duration of human pregnancy[J].
Environ Health Perspect,2003, 111 (14) : 1783-5.
DOI: 10.1289/ehp.6202. ( 0) 0)
|
| [7] |
徐宏, 余克花, 张保平, 等. 雌、孕激素对小鼠uNK细胞在子宫壁内分布的影响[J].
中国免疫学杂志,2010, 26 (4) : 330-4.
( 0) 0)
|
| [8] |
顾潇, 徐婉, 尚丽新, 等. 孕中晚期不同剂量邻苯二甲酸二(2-乙基)己酯暴露对胎鼠生长发育的影响[J].
现代妇产科进展,2015, 24 (5) : 334-7,342.
( 0) 0)
|
| [9] |
Wang X, Shang LX, Wu N, et al. Effects of di-(2-ethylexyl) phthalate on apoptosis of cytotrophoblasts in early pregnancy[J].
Zhonghua Fu Chan Ke Za Zhi,2010, 45 (6) : 411-4.
( 0) 0)
|
| [10] |
王心, 尚丽新, 王晶, 等. 邻苯二甲酸二(2-乙基)己酯影响早期妊娠绒毛滋养细胞的分子机制[J].
中国实用妇科与产科杂志,2010, 26 (8) : 611-4.
( 0) 0)
|
| [11] |
Zei D, Pascarella A, Barrese C, et al. DEHP effects on retinal vessels in newborn rats:a qualitative and quantitative analysis[J].
Histochem Cell Biol,2009, 132 (5) : 567-75.
DOI: 10.1007/s00418-009-0627-8. ( 0) 0)
|
| [12] |
Bulmer JN, Lash GE. The role of uterine NK cells in normal reproduction and reproductive disorders[J].
Adv Exp Med Biol,2015, 868 (5) : 95-126.
( 0) 0)
|
| [13] |
Tonk EC, Verhoef A, Gremmer ER, et al. Relative sensitivity of developmental and immune parameters in juvenile versus adult male rats after exposure to di(2-ethylhexyl) phthalate[J].
Toxicol Appl Pharmacol,2012, 260 (1) : 48-57.
DOI: 10.1016/j.taap.2012.01.018. ( 0) 0)
|
| [14] |
Guo M, Lai L, Zong T, et al. Exposure to di(2-ethylhexyl) phthalate inhibits luteal function via dysregulation of CD31 and prostaglandin F2alpha in pregnant mice[J].
Reprod Biol Endocrinol,2015, 13 (11) : 11.
( 0) 0)
|
| [15] |
Parillo F, Maranesi M, Brecchia G, et al. In vivo chronic and in vitro acute effects of di(2-ethylhexyl) phthalate on pseudopregnant rabbit corpora lutea:possible involvement of peroxisome proliferator-activated receptor gamma[J].
Biol Reprod,2014, 90 (2) : 41.
DOI: 10.1095/biolreprod.113.109223. ( 0) 0)
|
| [16] |
Martins K, Applegate B, Hagedorn B, et al. Di(2-ethylhexyl) phthalate inhibits B cell proliferation and reduces the abundance of IgM-secreting cells in cultured immune tissues of the rainbow trout[J].
Fish Shellfish Immunol,2015, 44 (1) : 332-41.
DOI: 10.1016/j.fsi.2015.02.037. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
