人淋巴瘤细胞株Ramos、Raji、U937、SNK-6、HUT-78、Daudi购自美国ATCC,α-MEM培养液和胎牛血清购自美国Gibco,LipofectamineTM LTX and Plus Reagent转染试剂盒购自美国Invitrogen,G418购自北京索莱宝科技有限公司,TRIzol试剂、PrimeScriptTM RT reagentKit with gDNA Eraser(Perfect Real Time)和SYBR® Premix Ex TaqTM(Tli RNaseH Plus)试剂盒购自宝生物工程(大连)有限公司,RIPA裂解液购自北京普利莱基因技术有限公司,BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所,兔抗人AXIN 、β-catenin 、MMP7、MMP9和α微管蛋白(α-Tubulin)多克隆抗体购自美国Proteintech,山羊抗兔IgG(二抗)购自北京中杉金桥生物技术有限公司,化学发光检测试剂盒购自北京天根生物科技有限公司;限制性内切酶BamHⅠ、XhoⅠ、XbaⅠ,T4DNA连接酶,pyrobest DNA聚合酶,DpnⅠ酶,质粒提取试剂盒,DNA凝胶回收试剂盒,一步法RT反转录试剂盒及大肠杆菌DH5α感受态细胞购自大连宝生物公司(TaKaRa);设计的AXIN、β-catenin等序列及相关引物由上海生工公司合成;pCMV5-HA、pcDNA5-His质粒购自promega;AXIN-shRNA、β-catenin-shRNA购自上海吉玛制药技术有限公司
1.2 方法 1.2.1 细胞培养及转染淋巴瘤细胞置于37 ℃、CO2体积分数为5%的培养箱中培养,用含10%胎牛血清的α-MEM培养液换液传代培养。选取AXIN低表达的Raji细胞后,,按新型脂质体LipofectamineTM LTX and Plus Reagent转染试剂说明用不含10%胎牛血清的α-MEM培养液进行转染,分别转染pCMV5-HA-Axin和pcDNA5-His-β-catenin及共转,设置空白对照组,于转染4~6 h后更换含有10%胎牛血清的α-MEM培养液中继续培养,48 h后质粒高表达期提取细胞RNA和总蛋白。在稳定高表达AXIN的Raji细胞中,采用相同方法及分组转染干扰质质粒。
1.2.2 设计引物及构建pCMV5-HA-Axin和pcDNA5-His-β-catenin质粒根据Genbank的基因序列设计引物,具体见表 1。提取人淋巴瘤细胞Raji和Daudi中的总RNA,以总RNA为模板反转录为cDNA。进行PCR扩增反应,利用T4 DNA连接酶连接β-catenin全长片段与pcDNA5-His空载体,连接Axin全长片段与pCMV5-HA载体,然后将连接产物转化到DH5α感受态大肠杆菌,扩增后抽提质粒DNA,酶切及测序验证。
| 表 1 PCR引物序列、产物大小及复性温度 Table 1 PCR primers, product length and anealing temperatures |
取对数生长期的人淋巴瘤细胞Raji细胞接种于6孔板中(2×105细胞/孔),待细胞融合度为70%~80%时,按LipofectamineTM LTX and Plus Reagent转染试剂盒说明书提供的方法分别将重组载体pCMV5-HA-Axin质粒和阴性对照载体转染至Raji细胞。转染48 h后,加入1000 μg/mL的G418进行筛选,有阳性克隆长出时,在荧光显微镜下标记后挑取单克隆细胞进行培养,在96孔板中以有限稀释法筛选和纯化稳定转染的单克隆细胞并扩大培养,培养过程中应用500 μg/mL G418维持培养。荧光显微镜下观察筛选后各组细胞绿色荧光蛋白的表达情况。成功转染重组载体质粒后的细胞称pCMV5-HA-Axin-Raji。
1.2.4 实时荧光定量PCR法检测各基因的mRNA表达水平收集未经处理的多种淋巴瘤细胞株细胞以及过表达AXIN或β-catenin的Raji细胞、干扰AXIN或β-catenin的稳定高表达细胞,应用TRIzol试剂和PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)分别提取各组细胞的总RNA,并将其反转录成cDNA反应条件:37 ℃ 15 min,85 ℃ 5 s),随后以此cDNA为模板应用SYBR® Premix Ex TaqTM(Tli RNaseHPlus)进行PCR扩增。PCR反应条件: 95 ℃ 30 s;95 ℃ 5 s、60 ℃ 30 s,共40个循环。以2-ΔΔCt值表示各基因mRNA的相对表达水平。
1.2.5 蛋白质印迹法检测各基因蛋白的表达水平收集未经处理的多种淋巴瘤细胞株细胞以及过表达AXIN或β-catenin的Raji细胞、干扰AXIN或β-catenin的稳定高表达细胞,用RIPA裂解液提取细胞总蛋白,BCA法测定蛋白质浓度。取20 μg/孔蛋白质进行10% SDSPAGE,将电泳分离后的蛋白质转移至聚偏二氟乙烯膜上,用含5%脱脂奶粉的封闭液于室温下封闭1 h;加入1:1000稀释的抗AXIN和α-Tubulin(内参照)抗体,4 ℃反应过夜;TBST
漂洗3次,加入1:10 000稀释的辣根过氧化物酶标记的羊抗兔或羊抗鼠IgG(二抗),室温反应l h;TBST漂洗3次,加入化学发光试剂显影成像,应用Image Lab软件进行蛋白条带灰度值的分析。以目的蛋白条带的灰度值与内参照α-Tubulin蛋白条带灰度值的比值表示目的蛋白的相对表达水平。
1.2.6 Transwell侵袭实验检测细胞侵袭和迁移能力使用Transwell检测空白处理对照组、稳定高表达AXIN组、干扰AXIN的稳定高表达AXIN组细胞的侵袭能力变化。取对数期生长的Raji细胞,经过胰酶消化下来,低速离心后,大约按2×105细胞数加入到每个小室,用不含血清的培养液进行培养,放置在含有10%的血清培养液的24孔板上,放置在5% CO2、37 ℃封闭环境内孵育24 h,甲醛固定20 min,用0.1%结晶紫染色20 min,用PBS洗3遍。显微镜(×200)下计数迁移至滤膜外表面的细胞数,取平均值,实验重复3次。
1.3 统计学方法采用SPSS19.0统计软件,数据以均数±标准差表示,两组间数据的比较采用t检验,多组间数据的比较采用方差分析,组间两两比较采用Tukey法或Dunnett's T3法进行分析,P < 0.05为差异有统计学意义。本研究中的所有实验均重复3次。
2 结果 2.1 在多株淋巴瘤细胞株里AXIN、β-catenin、MMP7、MMP9的表达情况用RT-PCR和Western blotting法观察多株淋巴瘤细胞株里AXIN、β-catenin、MMP7、MMP9的mRNA及蛋白表达情况。结果发现:观察蛋白水平,Raji细胞中AXIN相对低表达;当AXIN升高时,β-catenin、MMP7、MMP9降低,当AXIN降低时,β-catenin、MMP7、MMP9呈升高趋势(图 1)。推测AXIN与β-catenin、MMP7、MMP9呈负相关。
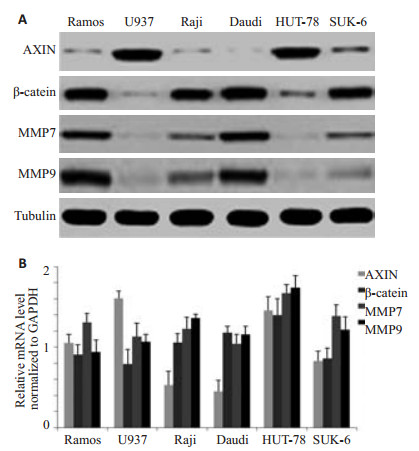
|
图 1 在多株淋巴瘤细胞株里AXIN、β-catenin、MMP7、MMP9的表达情况 Figure 1 Expression of Axin, β-catenin, MMP7 and MMP9 at the protein (A, Western blotting) and mRNA (B, qRTPCR) in different lymphoma cell lines. |
对于Raji细胞组分空白对照组、pCMV5-HA-Axin、pcDNA5-His-β-catenin、pcDNA5-His-β-catenin+ pCMV5-HA-Axin这4组,HUT-78细胞组分空白对照组、AXIN-shRNA、β-catenin-shRNA和AXIN-shRNA+ β-cateni-shRNA这4组。采用RT-PCR和Western blot法检测各个基因的蛋白及mRNA水平。图 2A结果显示:过表达Axin的细胞中,β-catenin、MMP7、MMP9蛋白水平较空白对照组明显下降,MMP7、MMP9 、β-catenin mRNA未变化;过表达β-catenin的细胞中,MMP7、MMP9蛋白及mRNA水平较空白对照组明显升高,而Axin未见明显变化;过表达Axin和过表达β-catenin的细胞中,β-catenin、MMP7、MMP9表达较过表达β-catenin组明显下降。图 2B HUT-78细胞株的结果与Raji细胞株的蛋白水平结果相反,mRNA水平结果同样说明Axin不影响β-catenin、MMP7、MMP9的mRNA。说明蛋白水平,升高Axin可以下调β-catenin、MMP7、MMP9的表达水平,而且Axin可以恢复过表达β-catenin产生的影响。
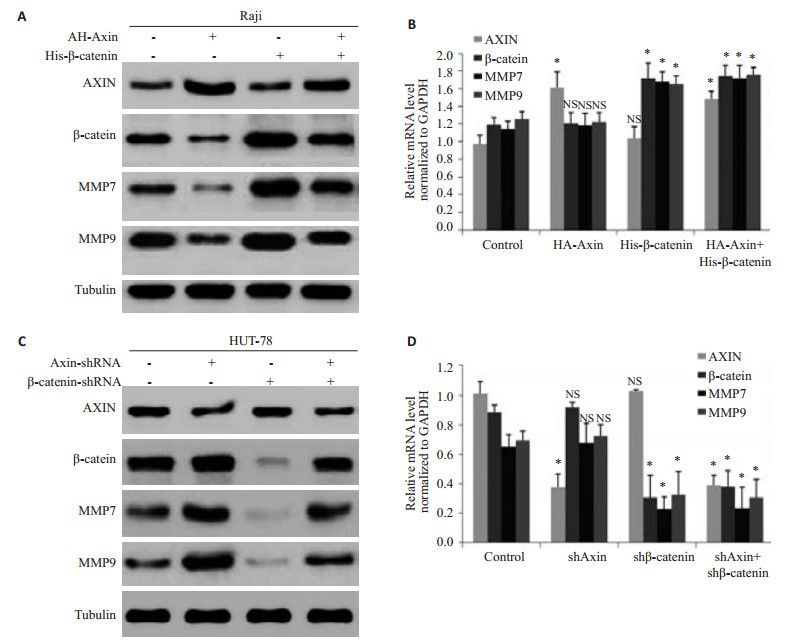
|
图 2 在Raji 和HUT-78细胞中过表达和干扰AXIN或β-catenin中MMP7、MMP9的表达情况 Figure 2 Expression of MMP7 and MMP9 in Raji and HUT-78 cells after overexpressing and interfering AXIN or β-catenin. A: Protein expressions in Raji cells; B: mRNA levels in Raji cells; C: Protein expressions in HUT-78 cells; D: mRNA levels in HUT-78 cells. *P<0.05. NS: No significance. |
在稳定高表达Axin的Raji细胞中,分四组分别转染空白干扰片段、AXIN-shRNA、β-catenin-shRNA、AXIN-shRNA + β-catenin-shRNA。用RT-PCR和Wes-tern blot技术分别检测各个基因表达情况。结果显示:构建稳定高表达Axin的Raji细胞株成功;干扰Axin的pCMV5-HA-Axin-Raji后,β-catenin、MMP7、MMP9蛋白水平较空白干扰组明显升高,MMP7、MMP9、β-catenin mRNA未变化;干扰β-catenin的pCMV5-HA-Axin-Raji后,MMP7、MMP9表达较空白干扰组明显下降,而Axin未见明显变化;干扰Axin和β-catenin的细胞后,β-catenin、MMP7、MMP9表达较干扰β-catenin组明显升高(图 3)。说明降低Axin可以上调β-catenin、MMP7、MMP9的表达水平,而且Axin可以恢复干扰β-catenin产生的影响。
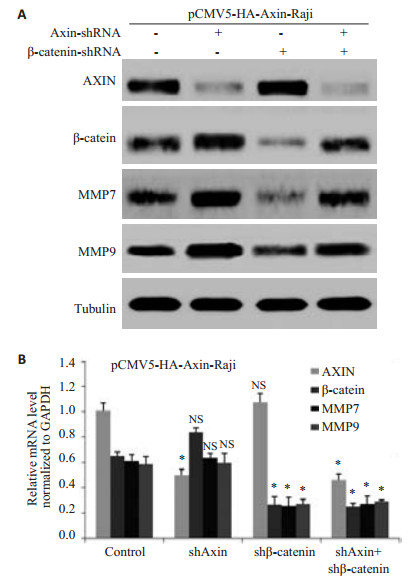
|
图 3 在 稳 定 高 表 达 AXIN 细 胞 中 干 扰AXIN或β-catenin中MMP7、MMP9的表达情况 Figure 3 Expression of MMP7 and MMP9 proteins (A) and mRNA (B) in cells overexpressing Axin after AXIN or β-catenin knockdown. *P<0.05. NS: No significance. |
Transwell侵袭实验结果显示:稳定高表达Axin组Raji细胞穿膜细胞数48±2.74明显低于空白处理对照组90±6.63及干扰AXIN的稳定高表达AXIN组76±4.69(P=0.024,图 4)。
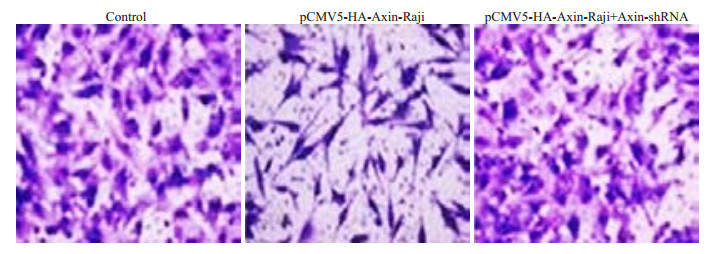
|
图 4 AXIN调节MMP7、MMP9对淋巴瘤细胞侵袭能力的影响 Figure 4 Effect of Axin-mediated regulation of MMP7 and MMP9 on invasion ability of lymphoma cells. |
在全球范围内,恶性淋巴瘤的发病率近30年来已高达20/10万。在我国恶性淋巴瘤也已是常见肿瘤第8位,发病率高达6/10万~7/10万[11]。而且淋巴细胞分布全身各部,一旦恶变,手术切除效果有限,临床治疗需结合放化疗[12]。生物治疗已成为恶性淋巴瘤的第四治疗方式。无论何种治疗方式,淋巴瘤的浸润和转移是造成预后不良患者死亡的主要原因。本文从转移相关基因MMP7、MMP9开始研究,进一步研究了AXIN-β-catenin-MMP7/MMP9转移机制轴。为了研究AXIN在淋巴瘤细胞的侵袭和转移的内在机制,我们进一步实验发现改变Axin后,发现β-catenin的蛋白含量明显发生变化,而β-catenin mRNA水平无明显变化,证实AXIN虽然不影响β-catenin的转录,但通过诱导其降解可以显著下调β-catenin在细胞内的含量,这与其他实验室的研究结果一致。
先前研究报道过,肿瘤细胞发生侵袭时,肿瘤细胞通过扩散并逐渐侵入细胞外基质(ECM),肿瘤细胞和基质细胞通过分泌蛋白酶导致ECM的降解,从而使基底膜缺损,肿瘤细胞可以由这种方式进入血管,向远处进行转移[13-14],肿瘤细胞或肿瘤间质组织产生降解ECM的主要是蛋白水解酶,目前认为最为重要的是基质金属蛋白酶系列(MMPs)[15]。MMP7、MMP9属于MMPs家族中的一员,而且MMP7、MMP9是MMPs家族最重要的蛋白酶之一[16]。AXIN与肿瘤的转移研究并非我们首次报道,AXIN是1997年从一种称为Fused的小鼠突变株中克隆到的基因[17]。AXIN以构架蛋白的形式在Wnt信号转导途经中起负调节作用[18]。Xu等[19]研究认为AXIN的表达减少与肿瘤的TNM分期和淋巴结转移相关,并是食管鳞癌进展的重要原因之一,这与我们在淋巴瘤里研究一致。非小细胞肺癌中研究存在着AXIN的表达减少时,出现β-catenin的核蓄积和肺癌的低分化[20],我们在淋巴瘤中研究也发现AXIN与β-catenin呈负相关。大量研究证实AXIN能与Wnt信号途径中的许多成员相互结合从而影响wnt/β-catenin信号通路影响细胞的功能。β-catenin是经典的cadherin-catenin复合体和Wnt通路的重要成员,其异常蓄积对肿瘤的恶性增殖和侵袭转移有重要作用[21-22]。AXIN作为调控β-catenin蛋白降解的关键分子,对保持Wnt通路的低活性状态,调节细胞的增殖和凋亡具有重要作用[23]。这与我们研究结果相一致,说明AXIN在诱导β-catenin降解和分布,抑制肿瘤发生、发展和侵袭方面发挥重要作用。AXIN与MMP7、MMP9的关系并没有学者研究过,我们首次在实验中发现AXIN相对低表达的Raji细胞中转染过表达AXIN质粒后,与侵袭相关的靶基因MMP-7、MMP9表达减少,进而导致淋巴瘤细胞的侵袭转移能力减弱,而共转染β-catenin质粒会使淋巴瘤细胞的侵袭转移能力恢复;在稳定高表达AXIN的Raji细胞中转染Axin-shRNA,MMP7、MMP9表达上升,进而导致淋巴瘤细胞的侵袭转移能力增强,当共转染β-catenin-shRNA会使淋巴瘤细胞的侵袭转移能力下降。证明β-catenin在AXIN和MMP7、MMP9之间起着桥梁作用。
综上所述,肿瘤细胞浸润转移过程中最为重要的过程无疑是ECM的降解导致的,研究已证实MMPs是降解ECM的重要蛋白水解酶家族,能降解ECM和BM所有成分从而导致肿瘤细胞的侵袭和转移[24-26]。而且我们首次证实AXIN通过β-catenin调控侵袭相关的靶基因MMP-7、MMP9的表达,进而影响淋巴瘤细胞侵袭转移能力。本研究阐述了AXIN抑制淋巴瘤细胞的侵袭转移能力的机制,为淋巴瘤靶向治疗提供了新的理论依据和实验基础。
| [1] |
马莉, 马梁明. 格列卫对恶性淋巴瘤细胞Raji凋亡和增殖的实验研究[J].
山西大同大学学报:自然科学版,2010, 26 (2) : 65-8.
( 0) 0)
|
| [2] |
Pećina-Slaus N, Martić TN, Kokotović T, et al. AXIN-1 protein expression and localization in glioblastoma[J].
Coll Antropol,2011, 35 (Suppl 1) : 101-6.
( 0) 0)
|
| [3] |
Hida T, Nakamura F, Usui H, et al. Semaphorin3a-induced axonal transport mediated through phosphorylation of axin-1 by GSK3β[J].
Brain Res,2015, 1598 (14) : 46-56.
( 0) 0)
|
| [4] |
杨连赫, 马爽, 徐洪涛, 等. Axin通过负向调控Wnt通路抑制A549细胞系增殖[J].
现代肿瘤医学,2013, 21 (1) : 21-4.
( 0) 0)
|
| [5] |
Behrens J, Jerchow BA, Würtele M, et al. Functional interaction of an axin homolog, conductin, with beta-catenin, APC, and GSK3beta[J].
Science,1998, 280 (5363) : 596-9.
DOI: 10.1126/science.280.5363.596. ( 0) 0)
|
| [6] |
Malemud CJ. Matrix metalloproteinases (MMPs) in health and disease:an overview[J].
Front Biosci,2006, 11 (6) : 1696-701.
( 0) 0)
|
| [7] |
Patterson BC, Sang QA. Angiostatin-converting enzyme activities of human matrilysin (MMP-7) and gelatinase B/type IV collagenase (MMP-9) J][J].
J Biol Chem,1997, 272 (46) : 28823-5.
DOI: 10.1074/jbc.272.46.28823. ( 0) 0)
|
| [8] |
Watelet JB, Bachert C, Claeys C, et al. Matrix metalloproteinases MMP-7, MMP-9 and their tissue inhibitor TIMP-1:expression in chronic sinusitis vs nasal polyposis[J].
Allergy,2004, 59 (1) : 54-60.
DOI: 10.1046/j.1398-9995.2003.00364.x. ( 0) 0)
|
| [9] |
Thorns V, Walter GF, Thorns C. Expression of MMP-2, MMP-7, MMP-9, MMP-10 and MMP-11 in human astrocytic and oligodendroglial gliomas[J].
Anticancer Res,2003, 23 (5A) : 3937-44.
( 0) 0)
|
| [10] |
Kishida S, Yamamoto H, Ikeda S, et al. Axin, a negative regulator of the wnt signaling pathway, directly interacts with adenomatous polyposis coli and regulates the stabilization of beta-catenin[J].
J Biol Chem,1998, 273 (18) : 10823-6.
DOI: 10.1074/jbc.273.18.10823. ( 0) 0)
|
| [11] |
张玉玲, 庹吉妤, 郑荣寿, 等. 中国2009年恶性淋巴瘤发病与死亡分析[J].
中国肿瘤,2013, 22 (5) : 338-43.
( 0) 0)
|
| [12] |
陈为民. 老年弥漫大B细胞淋巴瘤的特点与治疗进展[J].
实用老年医学,2014, 122 (6) : 464-8.
( 0) 0)
|
| [13] |
Waterland RA, Dolinoy DC, Lin JR, et al. Maternal methyl supplements increase offspring DNA methylation at Axin Fused[J].
Genesis,2006, 44 (9) : 401-6.
DOI: 10.1002/(ISSN)1526-968X. ( 0) 0)
|
| [14] |
金利华, 李勤喜, 叶志云. Axin在Wnt信号转导途径中的作用[J].
中国生物化学与分子生物学报,2006, 22 (4) : 289-95.
( 0) 0)
|
| [15] |
Xu HT, Wang L, Lin D, et al. Abnormal beta-catenin and reduced axin expression are associated with poor differentiation and progression in non-small cell lung cancer[J].
Am J Clin Pathol,2006, 125 (4) : 534-41.
DOI: 10.1309/0MDY02KHEW1F6RT6. ( 0) 0)
|
| [16] |
刘树立, 徐洪涛, 杨连赫, 等. Axin过表达下调β-catenin和TCF-4表达并抑制肺癌BE1细胞的增殖和侵袭[J].
中国肺癌杂志,2009, 12 (4) : 277-82.
( 0) 0)
|
| [17] |
Huang H, He X. Wnt/beta-catenin signaling:new (and old) players and new insights[J].
Curr Opin Cell Biol,2008, 20 (2) : 119-25.
DOI: 10.1016/j.ceb.2008.01.009. ( 0) 0)
|
| [18] |
Willert K, Shibamoto S, Nusse R. Wnt-induced dephosphorylation of axin releases beta-catenin from the axin complex[J].
Genes Dev,1999, 13 (14) : 1768-73.
DOI: 10.1101/gad.13.14.1768. ( 0) 0)
|
| [19] |
Wiechens N, Heinle K, Englmeier L, et al. Nucleo-cytoplasmic shuttling of Axin, a negative regulator of the Wnt-beta-catenin Pathway[J].
J Biol Chem,2004, 279 (7) : 5263-7.
DOI: 10.1074/jbc.M307253200. ( 0) 0)
|
| [20] |
Kim BS, Mooney DJ. Development of biocompatible synthetic extracellular matrices for tissue engineering[J].
Trends Biotechnol,1998, 16 (5) : 224-30.
DOI: 10.1016/S0167-7799(98)01191-3. ( 0) 0)
|
| [21] |
Shapiro SD. Matrix metalloproteinase degradation of extracellular matrix:biological Consequences[J].
Curr Opin Cell Biol,1998, 10 (5) : 602-8.
DOI: 10.1016/S0955-0674(98)80035-5. ( 0) 0)
|
| [22] |
Oberhauser AF, Marszalek PE, Erickson HP, et al. The molecular elasticity of the extracellular matrix protein tenascin[J].
Nature,1998, 393 (6681) : 181-5.
DOI: 10.1038/30270. ( 0) 0)
|
| [23] |
Di Girolamo N, Mccluskey P, Lloyd A, et al. Expression of MMPs and TIMPs in human pterygia and cultured pterygium epithelial cells[J].
Invest Ophthalmol Vis Sci,2000, 41 (3) : 671-9.
( 0) 0)
|
| [24] |
Chaussain-Miller C, Fioretti F, Goldberg M, et al. The role of matrix metalloproteinases (MMPs) in human caries[J].
J Dent Res,2006, 85 (1) : 22-32.
DOI: 10.1177/154405910608500104. ( 0) 0)
|
| [25] |
Hemmann S, Graf J, Roderfeld M, et al. Expression of MMPs and TIMPs in liver fibrosis-a systematic review with special emphasis on anti-fibrotic strategies[J].
J Hepatol,2007, 46 (5) : 955-75.
DOI: 10.1016/j.jhep.2007.02.003. ( 0) 0)
|
| [26] |
Sutnar A, Pesta M, Liska V, et al. Clinical relevance of the expression of mRNA of MMP-7, MMP-9, TIMP-1, TIMP-2 and CEA tissue samples from colorectal liver metastases[J].
Tumour Biol,2007, 28 (5) : 247-52.
DOI: 10.1159/000110897. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
