2. 南方医科大学南方医院门诊部, 广东 广州 510515
2. Department of Out-patient, NanfangHospital Southern Medical University, Guangzhou 510515, China
miRNA是一类在人体内广泛分布的内源性非编码RNA,可以通过与目标mRNA 3'末端的非编码区结合而引起靶mRNA的降解[1],广泛参与细胞生理活动的调节,譬如增殖、分化、迁移、生长及发育等,它的异常表达和很多疾病病理进展过程密切相关[2-4]。近年来研究[5]发现miRNA在器官移植后发生的急性排斥反应(AR)过程中起重要作用,Wilflingseder等[6]发现肾移植患者发生AR时其移植肾组织miR-663表达水平较没有发生AR的患者明显升高。目前miR-663参与调控移植肾组织AR发生发展过程的机制尚不明确,因此本研究旨在比较肾移植AR病人及非AR组病人血清miR-663表达水平,并在细胞水平上探讨miR-663在肾移植急性排斥反应过程中的调控机制。
1 材料和方法 1.1 一般资料临床患者:选取我院2012年1月~2014年12月首次行肾移植术的30例患者,其中男19例,女11例,年龄19~58岁(平均37岁),群体反应性抗体(PRA) < 10%,供受者血型均相配,淋巴细胞毒试验阴性。
AR诊断标准及移植后免疫抑制剂用原则见参考文献[7]。根据术后1月内发生AR与否分为AR组(9例)和非AR组(21例),两组患者的年龄、性别、血透时间、HLA错配数及术前肌酐水平等无统计学差异。术前1 d及术后第1、2、3、4周各抽取外周血5mL待检。
1.2 细胞培养人肾小球内皮细胞(Human renal glomerular endothelial cells, HRGEC)及人巨噬细胞系分别置于DMEM+10%胎牛血清+100 g/L链霉素+105 U/L青霉素培养基中,在37 ℃、5% CO2恒温孵育箱内培养。
1.3 转染miRNA mimic和miRNA inhibitormiR-663 mimic和inhibitor及慢病毒包装委托基因化学公司完成。HRGEC细胞以2×105个/孔接种于6孔板,待细胞贴壁后去除培养基,加入含有8 mg/L聚凝胺的转染增强液,以病毒滴度(MOI)为1:50加入慢病毒,按说明书转染10 h后终止慢病毒感染,加入正常培养基继续培养,于转染后72 h后于荧光显微镜下观察绿色荧光表达量以判断感染效率。
1.4 Real-time PCRTrizol裂解细胞后提取RNA, 按照试剂生产商的说明书运用SYBR PrimeScript miRNA RT-PCR kit首先将RNA逆转录为cDNA,然后进行PCR扩增检测细胞cDNA的相对表达量,PCR反应在ABI7500实时荧光定量PCR反应仪进行,以U6为内参。
1.5 MTT设置miR-663 mimic组、miR-663 inhibitor组、阴性对照组(Scrambled control)及空白对照组;各组以5×103/孔密度接种于96孔板中。37 ℃、5% CO2培养至所需的实验时间后,每孔加入20 µL 5 mg/mL MTT,37 ℃孵育4 h,吸出上清,每孔加入200 µL DMSO,置于摇床震荡充分溶解结晶,酶标仪490 nm波长处测量吸光值,每组4个复孔。实验至少重复3次。
1.6 细胞凋亡按照上述分组将各组以2×105/孔密度接种于6孔板中,待细胞贴壁后,继续培养48 h后收集贴壁及悬浮细胞,按照AnneXin V-FITC细胞凋亡试剂盒说明书进行操作,首先预冷1×PBS洗2次,然后加入500 µL结合缓冲液重悬细胞,最后加入5 µL Annexin V-FITC和5 µL碘化丙锭(PI)并混匀,流式细胞仪检测细胞凋亡率。
1.7 ELISA检测炎症因子表达水平细胞按上述实验分组处理并培养48 h后,按照ELISA试剂盒说明书测定相关炎症因子的表达水平,具体见方法参考文献[8]。测定的炎症因子包括IL-6、IFN-γ、TNF-α和CCL2。
1.8 巨噬细胞趋化性实验巨噬细胞趋化性实验采用24孔的transwell小室(孔直径大小=5 µm)进行。巨噬细胞和HRGEC细胞(miR-663 mimic组,miR-663 inhibitor组及阴性对照组)分别置于transwell的上室和下室。巨噬细胞置于无血清的培养基之中,在不同时间点测定巨噬细胞由上室穿过小孔到达下室的数目。采用CyQuant GR Dye进行荧光染色,倒置荧光显微镜在波长480 nm/520 nm计算下室巨噬细胞数目。计算时随机挑选4个视野,每个视野重复计算3次,最后取平均值。
1.9 统计学分析两独立样本t检验进行两组间比较,多样本运用One Way ANOVA及Fisher's post-hoc test进行数据处理。所有数据以均数±标准差的方式进行表达,采用SPSS 21.0统计软件进行统计分析,P < 0.05表明差异有统计学意义。
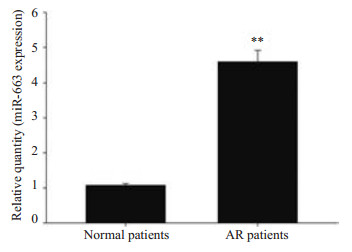
2 结果 2.1 血清miR-663在肾移植发生AR患者及没有发生AR的患者的表达水平运用realtime PCR检测并比较肾移植AR组和非AR组患者血清miR-663的表达水平,结果显示发生AR组血清miR-663表达水平明显高于非AR组高(4.73±0.28 vs 1.06±0.04),差异具有统计学意义(P < 0.01,图 1)。
|
图 1 血清miR-663在肾移植发生AR患者及没有发生AR的患者的表达水平 Figure 1 Results of quantitative RT-PCR showing increased serum miR-663 in recipients with AR. **P<0.01. |
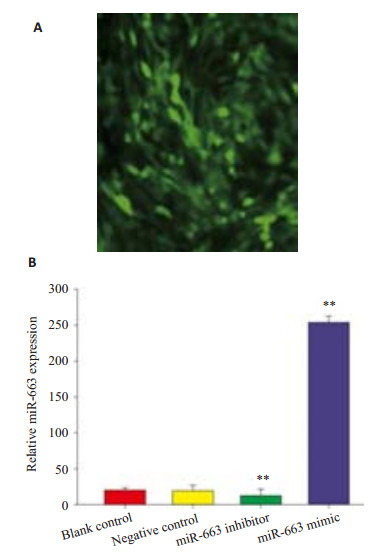
转染miR-663 mimic及miR-663 inhibitor至HRGEC内,倒置荧光显微镜观察结果显示感染效率高(图 2A)。realtime PCR结果显示miR-663 mimic能明显提高细胞miR-663的表达水平(P < 0.000),而miR-663 inhibitor则能明显降低细胞miR-663的表达水平(P < 0.01,图 2B)。说明构建的miR-663 mimic及miR-663 inhibitor是有效的。
|
图 2 转染miR-663 mimic及miR-663 inhibitor Figure 2 Transfection of miR-663 mimic and miR-663 inhibitor. A. Fluorescent microscopy for assessing transfection efficiency of FAM-labeled miRNA oligo in HRGECs. B. Expression levels of miR-663 in cells transfected with miR-663 mimics or inhibitor measured by real-time PCR. **P<0.01. |
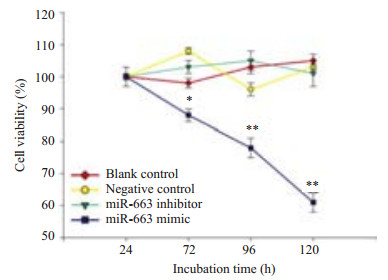
MTT结果显示miR-663 mimic组细胞生存率在4个所测时间点均较其他3组明显降低(P < 0.05,P < 0.01),说明miR-663过表达不利于HRGEC的生存,miR-663 inhibitor组细胞生存率和其他两组对照组相比在各个时间点生存率均没有明显差异(P > 0.05)。
|
图 3 MTT检测miR-663 mimic及miR-663 inhibitor对 HRGEC生存率的影响 Figure 3 Viability of HRGEC was reduced by miR-663 inhibitor as determined by MTT assay. *P<0.05; **P<0.01. |
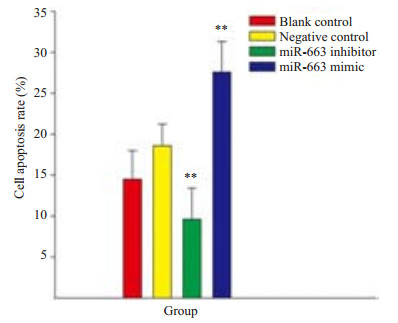
annexin V/PI染色结果显示miR-663 mimic能明显促进HRGEC细胞的凋亡率,和对照组相比明显增高(P < 0.01),而miR-663 inhibitor则能明显降低HRGEC细胞的凋亡率,和对照组相比明显统计学差异(P < 0.01,图 4)。
|
图 4 检测miR-663 mimic及miR-663 inhibitor 对HRGEC细胞凋亡率的影响 Figure 4 Flow cytometry for detecting cell apoptosis using annexin V/PI staining. **P<0.01. |
ELISA结果显示miR-663 mimic能明显上调IL-6、TNF-α、IFN-γ及CCL2表达水平,较对照组有显著性差异,而miR-663 inhibitor则可以在不同程度上抑制上述4种炎症因子的表达水平(表 1)。
| 表 1 miR-663 mimic及miR-663 inhibitor对HRGEC细胞炎症因子表达的影响 Table 1 Levels of IL-6, TNFα, IFN-γ and CCL-2 released by HRGEC transfected with miR-663 mimics or inhibitor determined by sandwich ELISA |
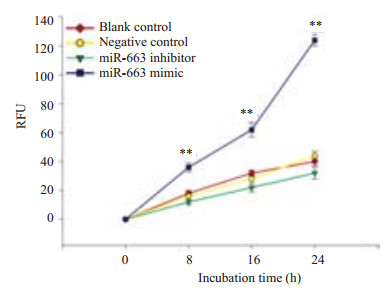
Transwell结果显示miR-663 mimic组穿过小孔的巨噬细胞数量明显要比对照组增多,差异具有统计学意义(P < 0.01),而miR-663 inhibitor组穿过小孔的巨噬细胞数量和对照组相比没有明显差异(P > 0.05,图 5)。
|
图 5 miR-663 mimic及miR-663 inhibitor对巨噬细 胞趋化能力的影响 Figure 5 Number of macrophages migrating to the lower chambers containing conditioned medium from HRGECs transfected with miR-663 mimics or inhibitor. **P<0.01. |
急性排斥反应是影响移植肾长期存活的主要因素之一,早期诊断及时治疗AR可以有效减少移植器官的病理损害程度,延长移植器官的存活时间。miRNA作为体液(外周血、唾液、尿液等)标志物,易于获得,具有较好的时效性,能有效动态监测疾病的发展和治疗效果,且在外周血液中理化性质极其稳定[9-11],使其成为理想的标志物,同时已有多项研究证实miRNA在移植肾AR过程中起调控作用,并可通过检测相关miRNA快速准确判断肾移植AR。
Anglichea等[12]比较了发生AR的移植肾组织和正常的移植肾组织miRNAs表达谱差异,发现发生AR的移植肾组织和外周血单核细胞中高表达miR-142-5p、miR-155及miR-223。最近Soltaninejad等[13]发现肾移植急性T细胞介导的排斥反应的组织miR-142-5p,miR-142-3p,miR-155及miR-223较正常移植物组织明显升高,不同于Anglichea等研究,该研究外周血单核细胞中miR-142-3p及miR-223表达水平升高。Oghumu等[14]比较了肾移植后发生急性肾盂肾炎及急性排斥反应的患者的miRNA表达谱差异,发现两组疾病至少有25个miRNAs表达上存在明显差异。同时,Lorenzen等[15]发现肾移植发生AR的病人的尿液中miR-210表达水平明显降低,而且其降低的水平和肾移植患者1年后的肾小球滤过率密切相关,表明检测肾移植患者尿液miR-210的表达水平不仅可早期诊断肾移植AR,而且有望用以判断和监测肾移植患者的预后。从以上研究可以看出,miRNA家族异常表达与移植肾急性排斥反应的进展过程存在密切联系,在肾脏AR的过程中起重要的调控作用,并可作为一项敏感、特异的体液标志物用以诊断移植肾AR。
本研究显示,发生移植肾AR的患者血清miR-663表达水平明显较没有发生AR的肾移植患者升高,该结果提示了miR-663参与了移植肾AR的发生发展过程。细胞实验中,首先验证了miR-663 mimic及miR-663 inhibitor转染的有效性,然后进一步发现过表达miR-663可以抑制HRGEC的生存并且明显增加其的凋亡率,而抑制miR-663的表达可以抑制HRGEC的凋亡,该结果表明发生移植肾AR时miR-663在造成人肾小球内皮细胞损害中扮演着重要角色。我们还发现过表达miR-663可以明显提高IL-6、TNF-α、IFN-γ及CCL2等炎症因子的表达水平,并且可以明显增加巨噬细胞的趋化性,说明了miR-663在肾移植AR微环境的炎症反应中起调控作用。Ni等[16]发现,miR-663增加了单核细胞在血管内皮细胞上的粘着,介导了振荡剪切力引起的炎性反应过程,从侧面支持了我们的研究结果。
综上所述,本研究证实了miR-663在肾移植AR过程中发挥着重要作用,并阐明其可能的作用机制。miR-663在AR及非AR患者外周血中差异表达,可抑制肾小球内皮细胞的生存和增加其凋亡,并参与增加炎症因子表达和提高巨噬细胞趋化性,提示我们miR-663有望成为诊断及治疗肾移植AR的一个潜在分子靶点。
| [1] |
Guo H, Ingolia NT, Weissman JS, et al. Mammalian microRNAs predominantly act to decrease target mRNA levels[J].
Nature,2010, 466 (738) : 835-40.
( 0) 0)
|
| [2] |
Liu X, Dong C, Jiang Z, et al. MicroRNA-10b downregulation mediates acute rejection of renal allografts by derepressing BCL2L11[J].
Exp Cell Res,2015, 333 (1) : 155-63.
DOI: 10.1016/j.yexcr.2015.01.018. ( 0) 0)
|
| [3] |
Heegaard NH, Schetter AJ, Welsh JA, et al. Circulating micro-RNA expression profiles in early stage nonsmall cell lung cancer[J].
Int J Cancer,2012, 130 (6) : 1378-86.
DOI: 10.1002/ijc.v130.6. ( 0) 0)
|
| [4] |
Guo L, Liu Y, Bai Y, et al. Gene expression profiling of drugresistant small cell lung cancer cells by combining microRNA and cDNA expression analysis[J].
Eur J Cancer,2010, 46 (9) : 1692-702.
DOI: 10.1016/j.ejca.2010.02.043. ( 0) 0)
|
| [5] |
Sui W, Lin H, Peng W, et al. Molecular dysfunctions in acute rejection after renal transplantation revealed by integrated analysis of transcription factor, microRNA and long noncoding RNA[J].
Genomics,2013, 102 (4) : 310-22.
DOI: 10.1016/j.ygeno.2013.05.002. ( 0) 0)
|
| [6] |
Wilflingseder J, Regele H, Perco P, et al. miRNA profiling discriminates types of rejection and injury in human renal allografts[J].
Transplantation,2013, 95 (6) : 835-41.
DOI: 10.1097/TP.0b013e318280b385. ( 0) 0)
|
| [7] |
刘小友, 徐健. Micro-RNA-223参与肾移植后急性排斥反应中的作用[J].
细胞与分子免疫学杂志,2011, 27 (10) : 1121-3.
( 0) 0)
|
| [8] |
Flieger O, Engling A, Bucala R, et al. Regulated secretion of macrophage migration inhibitory factor is mediated by a non-classical pathway involving an ABC transporter[J].
FEBS Lett,2003, 551 (1/3) : 78-86.
( 0) 0)
|
| [9] |
张婕, 刘小友. 外周血miRNA在肾移植术后急性排斥反应中的作用[J].
器官移植,2015, 6 (5) : 348-50.
( 0) 0)
|
| [10] |
Turchinovich A, Weiz L, Langheinz A, et al. Characterization of extracellular circulating microRNA[J].
Nucleic Acids Res,2011, 39 (16) : 7223-33.
DOI: 10.1093/nar/gkr254. ( 0) 0)
|
| [11] |
Hunter MP, Ismail N, Zhang XL, et al. Detection of microRNA expression in human peripheral blood microvesicles[J].
PLoS One,2008, 3 (11) : e3694.
DOI: 10.1371/journal.pone.0003694. ( 0) 0)
|
| [12] |
Anglicheau D, Sharma VK, Ding R, et al. MicroRNA expression profiles predictive of human renal allograft status[J].
Proc Natl Acad Sci USA,2009, 106 (13) : 5330-5.
DOI: 10.1073/pnas.0813121106. ( 0) 0)
|
| [13] |
Soltaninejad E, Nicknam MH, Nafar M, et al. Differential expression of microRNAs in renal transplant patients with acute T-cell mediated rejection[J].
Transpl Immunol,2015, 33 (1) : 1-6.
( 0) 0)
|
| [14] |
Oghumu S, Bracewell A, Nori U, et al. Acute pyelonephritis in renal allografts:a new role for microRNAs[J].
Transplantation,2014, 97 (5) : 559-68.
DOI: 10.1097/01.TP.0000441322.95539.b3. ( 0) 0)
|
| [15] |
Lorenzen JM, Volkmann I, Fiedler J, et al. Urinary miR-210 as a mediator of acute T-cell mediated rejection in renal allograft recipients[J].
Am J Transplant,2011, 11 (10) : 2221-7.
DOI: 10.1111/ajt.2011.11.issue-10. ( 0) 0)
|
| [16] |
Ni CW, Qiu H, Jo H. MicroRNA-663 upregulated by oscillatory shear stress plays a role in inflammatory response of endothelial cells[J].
Am J Physiol Heart Circ Physiol,2011, 300 (5) : H1762-9.
DOI: 10.1152/ajpheart.00829.2010. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
