结直肠癌是目前世界范围内最常见的恶性肿瘤之一,近年来发病率仍有上升趋势。现有研究发现哺乳动物雷帕霉素靶蛋白(mTOR)信号通路的过度活化与结直肠肿瘤的发生、发展密切相关[1-3],是肿瘤治疗的一个重要靶点[4]。mTOR在生物体以两种复合物的形式存在,即mTOR复合物1(mTORC1)及mTOR复合物2(mTORC2)。目前研究较多的是mTORC1复合物,而对mTORC2复合物研究不多,Rictor(rapamycin insen-sitive companion of mTOR)是mTORC2中一个新确定的蛋白成员,与mTOR、mLST8,mSin1,Protor和Deptor这6者一起组成mTORC2,它作为后者的特征性支架蛋白,分子中包含多个结构域,参与调节mTORC2信号及其下游靶基因如Akt的表达,缺少Rictor则mTOR失去激酶活性[5-6]。已有研究表明[7]:在IV期结直肠癌中Rictor所在的mTORC复合物2(mTORC2)与mTORC复合物1(mTORC1)的表达水平明显增高。因此,我们推测Rictor可能与结直肠癌的发生、发展和预后有关。Chitose Oneyama等[8]研究显示:miR-424/503通过介导rictor表达而抑制包括前列腺和结肠肿瘤在内的多种人类肿瘤的发生、发展。但目前还没有学者针对Rictor与结直肠癌临床病理分期、分级、淋巴结转移和预后中的价值进行报道。鉴于此,本课题拟采用免疫组织化学法在临床收集的组织标本中检测结直肠癌组织中Rictor蛋白表达的情况,采用免疫荧光和Western blotting(WB)法在细胞层面(HCT116、SW480、LoVo和HCoEpiC这4种细胞中)验证Rictor和p-mTOR两种蛋白的表达情况,分析Rictor表达与结直肠癌临床病理参数的相关性,为进一步提高结直肠癌诊断治疗提供新思路。
1 材料与方法 1.1 材料HCT116、SW480、LoVo这3种结肠肿瘤细胞,人正常结肠上皮细胞HCoEpiC,胎牛血清FBS(Gibco公司,美国);1640培养液(Gibco公司,美国);细胞培养瓶及培养皿为美国Corning公司产品。Rictor鼠抗人单克隆抗体(Sigma公司,美国);p-mTOR兔抗人单克隆抗体(Cell Signaling Technology公司,美国);二抗:Alexa Fluor 488标记抗兔二抗(Cell Signaling Technology公司,美国),Alexa Fluor 594标记抗鼠二抗(中杉金桥,中国)。4',6-二脒基-2-苯基吲哚(DAPI)购自罗氏公司Roche公司,瑞士);ECL试剂盒(碧云天公司,中国)。
收集南方医科大学珠江医院2008年6月至2010年8月手术切取的62例结直肠癌及癌旁正常黏膜标本62例。患者男性34例,女性28例,年龄30~88岁,中位年龄66岁。所有患者术前均未接受放疗或化疗;癌旁正常黏膜组织均取自肿瘤切缘≥5 cm处,经病理学检查取材干净,无癌细胞浸润。由2名有经验的病理科医师对全部病例切片进行复查。常规苏木精-伊红(HE)染色进行病理诊断及病变分型,观察结直肠癌手术标本的肿瘤分化程度和浸润情况,中低分化41例,高分化21例,并参照国际抗癌联盟的TNM分期判别标准进行分期,其中Ⅰ/Ⅱ期患者28例,Ⅲ/Ⅳ期34例。
1.2 方法 1.2.1 免疫荧光法检测Rictor和mTOR蛋白在结直肠肿瘤细胞中的表达(1)细胞种板:将HCT116、SW480、LoVo、HCoEpiC这4种细胞按1×105个/孔板的密度进行种板,10%血清的1640培养基培养24 h;(2)免疫荧光染色:吸去培养液,室温下PBS清洗3次,每次5 min;4%多聚甲醛固定15 min,PBS清洗3次,每次5 min;0.5% Triton通透10 min,PBS清洗3次,每次5 min;5% BSA封闭45 min;一抗抗mTOR抗体(1:400)、抗Rictor抗体(1:500)孵育4 ℃过夜,PBS洗3次,每次5 min;二抗室温孵育1 h,PBS清洗3次,每次5 min;DAPI染核2 min,PBS清洗3次,每次10 min;(3)共聚焦显微镜拍照:统一×600倍下观察拍照。
1.2.2 WesternBlotting检测Rictor和mTOR蛋白在结直肠肿瘤细胞中的表达细胞铺满培养瓶底85%时进行处理,弃去培养液,用冷PBS洗1遍,加入适量的细胞裂解液,然后用细胞刮铲均匀收集培养皿所有部位的细胞。将收集好的细胞裂解液放于冰上裂解20 min,13 000 r/min离心15 min收集上清液,BCA(bicinchoninic acid)法蛋白浓度定量,细胞蛋白样品加上样缓冲液并煮沸,取30 μg的蛋白上样,用6% SDS-PAGE分离,然后转移到硝酸纤维素膜上,用5%牛血清白蛋白封闭,抗mTOR抗体(1:1000)、抗Rictor抗体(1:1000)作为一抗孵育4 ℃过夜,TBST在室温下脱色摇床上洗3次,每次10 min;TBS洗1次,10 min;抗鼠IgG、抗兔IgG作为二抗室温孵育1 h;TBST在室温下脱色摇床上洗2次,每次10 min;TBS洗1次,10 min;用ECL试剂曝光显影,定影拍照。
1.2.3 免疫组化检测Rictor蛋白的表达情况取术中切除结直肠癌及癌旁正常组织,进行常规固定、包埋、切片, 切片厚度为4 μm。按免疫组化SP法,经脱蜡水化后,在PH为6.2的柠檬酸盐中微波抗原修复10 min,3%双氧水阻断10 min,以消除内源性过氧化物酶,羊血清室温封闭15 min,滴加稀释浓度为1:800的Rictor鼠抗人单克隆抗体,4 ℃孵育过夜。45 min复温后,室温滴加二抗孵育15 min,加辣根酶标记的链酶卵白素15 min,每步骤间均用PBS洗片3次,每次3 min。DAB显色,苏木精复染,盐酸酒精分化,脱水透明后,中性树脂封片供观察评分。实验以已知的阳性表达组织切片作为阳性对照;另以0.1 mol/L PBS代替一抗,做为阴性对照。除预实验切片,所有样品染色均同批次进行。
免疫组织化学检测结果判定(图 1):两种蛋白阳性染色均主要定位于细胞质,以胞质内出现呈棕黄色为阳性指标。对每张切片的阳性细胞率和阳性细胞的染色强度进行分级计分,先按染色强度打分,无色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分,再按阳性细胞百分比打分,0~5%计0分,6%~25%计1分,26%~50%计2分,51%~75%计3分,75%以上计4分。以上述两项之和判定,0~3分为阴性,4~5分为阳性,6~7分为强阳性。以上判断由2名高年资病理科医师共同裁定,并以2人观察结果一致作为最终评定结果。
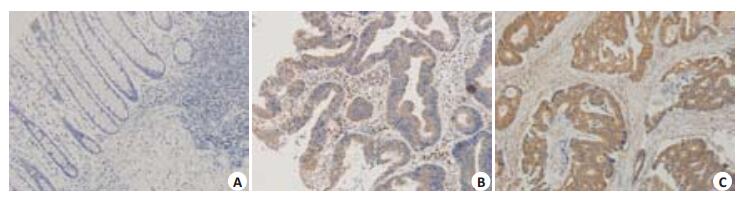
|
图 1 Rictor在结直肠癌及癌旁组织中的表达 Figure 1 Rictor expression in CRC tissues (Original magnification: ×200). A: Negative expression; B: Positive expression; C: Strong positive expression. |
自患者术后1月开始进行规律性随访,方式主要是患者定期复诊及电话随访,术后前两年每隔3月1次,后3年每个6月1次,随访时间持续5年。随访内容包括患者的生存状态及肿瘤灶的恢复情况,随访终点为死亡、失访或生存至截止日期。
1.2.5 统计学方法采用SPSS 20.0软件进行统计学分析。根据研究目的,组间率的比较采用χ2检验或Fisher确切概率检验,相关性分析采用Spearman相关分析。利用Kaplan-Meier法和log-rank检验进行生存分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 Rictor在结直肠癌细胞及组织中的表达情况 2.1.1 Rictor和mTOR免疫荧光双标记染色共聚焦荧光显微镜观察显示,Rictor和mTOR免疫荧光双标记染色HCT116、SW480、LoVo、HCoEpiC4种细胞,结果显示4种细胞中Rictor和mTOR都有表达,且两种蛋白在细胞质和细胞核中表达未见明显差异,两种蛋白Rictor和mTOR两种蛋白的表达量多少无法判定,(图 2)。故Western Blotting实验进行半定量比较。
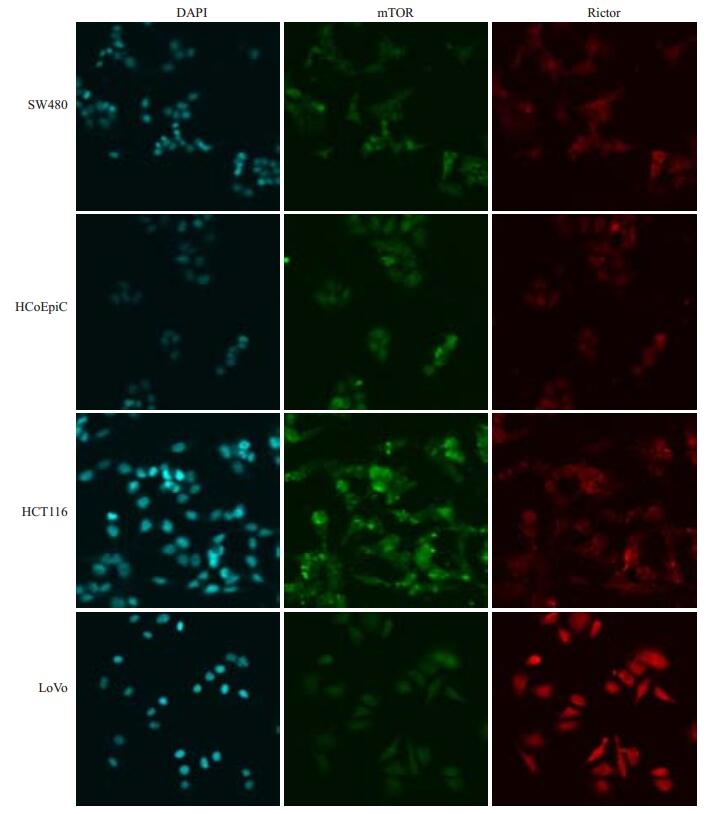
|
图 2 免疫荧光检测Rictor和mTOR在结直肠癌细胞(SW480、 HCT116和LoVo)及人正常结肠上皮细胞(HCoEpiC)中的表达结果 Figure 2 Immunofluorescence analysis of the expression of Rictor and mTOR in colorectal cancer cell lines SW480, HCT116 and LoVo and in human normal colon epithelial cell line HCoEpiC (Original magnification: ×400). |
Western bloting检测mTOR和Rictor两种蛋白结果显示:3种结直肠肿瘤细胞系中的mTOR条带和Rictor条带宽于人正常结肠上皮细胞中的蛋白条带;Image J软件定量分析结果同样显示:HCT116、SW480和LoVo这3种肿瘤细胞中mTOR和Rictor两种蛋白的表达量要高于HCoEpiC细胞中对应的两种蛋白的表达量(图 3)。免疫组化法检测Rictor蛋白定主要位于细胞质,阳性表达率为58.1%(36/62),而在癌旁正常组织的阳性表达率为14.5%(9/62)。Rictor蛋白在结直肠癌组织中的表达水平明显高于癌旁正常结直肠组织,差异有统计学意义(P < 0.05,表 1)。
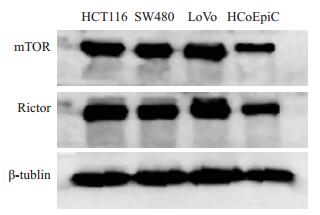
|
图 3 Western Blotting检测Rictor在结直肠癌细胞(HCT116、 SW480和LoVo)及人正常结肠上皮细胞(HCoEpiC)中的表达结果 Figure 3 Western blotting of the expressions of Rictor and mTOR in HCT116, SW480, LoVo and HCoEpiC cells. |
| 表 1 Rictor蛋白表达水平与临床病理参数的相关性 Table 1 Relationship between expression of Rictor protein and clinicopathologic parameters |
统计学相关性分析结果显示(表 1): Rictor蛋白在结直肠癌组织中的表达与肿瘤的Ducks分期及淋巴结转移相关(P < 0.05),与患者年龄、性别、肿瘤大小、分化程度、浸润深度、组织学类型的相关性无统计学意义(P>0.05)
2.3 Rictor蛋白表达与生存分析Kaplan-Meier生存分析结果:结直肠癌患者的生存时间与Rictor蛋白表达水平的关系显示Rictor蛋白表达水平与患者的生存期相关。如图生存曲线所示,Rictor蛋白表达阳性患者总生存时间明显小于表达阴性者,log-rank检验其差异具有统计学意义(P < 0.05,图 4)。
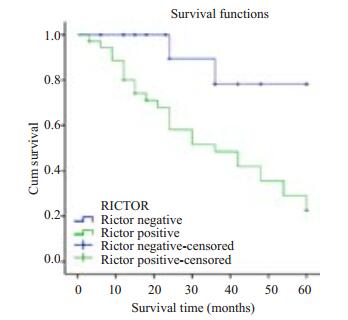
|
图 4 Kaplan-Meier统计62例结直肠癌患者组织中Rictor蛋白的表达与患者生存率的关系 Figure 4 Kaplan-Meier analysis of the relationship between Rictor protein expression and patients' survival time. |
结直肠癌的发生和发展是一个多基因、多步骤的渐变过程,许多基因都与结直肠癌的预后密切相关,因此,寻找结直肠癌的治疗靶点和预后相关指标以提高患者的5年生存率具有重要的理论意义和现实意义。
Rictor作为mTORC2复合物中的一员,在肿瘤增殖、迁移、侵袭和上皮间质转化(epithelial-mesenc-hymaltransition, EMT)等过程中发挥着重要作用[9-11]。例如,磷酸化的Rictor通过激活Akt来诱导c-Myc和细胞周期蛋白E(cyclin E)的表达,最终对结肠癌细胞的增殖和周期起重要的调节作用[12];肿瘤抑制性小干扰RNA(miRNA-34a)可以靶向作用于Akt和Wnt信号通路,从而抑制胶质瘤干细胞的生长和分化[13];整合素连接激酶(integrin-linked kinase, ILK)作为一种局部黏附因子和丝氨酸/苏氨酸蛋白激酶,调控细胞增殖、存活和EMT,它与Rictor组成的复合物可以抑制TGF-β1诱导的EMT和肺癌细胞转移[11]。Rictor也可以不依赖mTOR的存在调控肿瘤的进展,Bashir等[14]报道在恶性胶质瘤中Rictor作为癌基因参与癌细胞的增殖过程。以上研究结果提示:Rictor依赖或不依赖mTOR存在是以不同的形式在恶性肿瘤进展中发挥着重要而复杂的功能。
近年来已有研究显示Rictor与肿瘤的增殖、侵袭、转移、EMT和预后密切相关,例如Bashir等[14]研究表明恶性胶质瘤中Rictor蛋白的高表达与其高复发率密切相关;Tsuruta等[15]研究结果显示Rictor作为miR-152的靶基因在子宫内膜癌中调控癌细胞的增殖,因此,我们推测Rictor蛋白可能参与结直肠癌的增殖、迁移和侵袭等过程。基于此本实验分析了62例结直肠癌中Rictor蛋白的表达水平,发现它在结直肠癌组织中的表达水平明显高于正常大肠组织,同样细胞水平Western Blotting结果也印证了这一点。结果表明Rictor蛋白在结直肠肿瘤中存在过表达,这可能与其参与了结直肠癌的发生和发展有关,但具体的生物学功能未知。通过分析Rictor蛋白与临床病理参数之间的相关性,结果进一步证实Rictor蛋白与Ducks分期及淋巴结转移存在显著相关性,也更进一步的验证了我们的实验猜想。
研究通过Kaplan-Meier生存分析方法分析结直肠癌患者的生存时间与Rictor蛋白表达水平的关系,结果显示Rictor蛋白表达阳性患者总生存时间明显小于表达阴性者,Rictor蛋白可作为结直肠癌的独立预后指标。近期Rictor蛋白的相关研究显示卵巢癌患者体内的Rictor有助于顺铂产生耐药[16],然而它能提高胶质母细胞瘤患者对长春新碱和替莫唑胺药物的敏感性。因此,本研究结果提示在结直肠癌中靶向调控Rictor来提高药物敏感性成为可能。
由于本研究是回顾性分析,研究人群均来自中国,因此还存在很多局限性。另外,作为Rictor在结直肠癌中潜在作用的原始报道还需要开展更多的工作来验证,如前瞻性研究和Rictor和mTOR蛋白的分子机制研究。总之,本研究验证了Rictor和mTOR蛋白在结直肠癌中存在高表达,其中Rictor蛋白表达水平与肿瘤的Ducks分期及淋巴结转移密切相关,是结直肠癌的一项独立预后指标。以上工作为深入研究Rictor和mTOR蛋白在结直肠癌中的功能提供了一定的理论基础,为肿瘤的预后和治疗提供了一条新的思路。
| [1] |
Chiarini F, Evangelisti C, McCubrey JA, et al. Current treatment strategies for inhibiting mTOR in cancer[J].
Trends Pharmacol Sci,2015, 36 (2) : 124-35.
DOI: 10.1016/j.tips.2014.11.004. ( 0) 0)
|
| [2] |
Cargnello M, Tcherkezian J, Roux PP. The expanding role of mTOR in cancer cell growth and proliferation[J].
Mutagenesis,2015, 30 (2) : 169-76.
DOI: 10.1093/mutage/geu045. ( 0) 0)
|
| [3] |
Gentilella A, Kozma SC, Thomas G. A liaison between mTOR signaling, ribosome biogenesis and cancer[J].
Biochim Biophys Acta,2015, 1849 (7) : 812-20.
DOI: 10.1016/j.bbagrm.2015.02.005. ( 0) 0)
|
| [4] |
Francipane MG, Lagasse E. mTOR pathway in colorectal cancer:an update[J].
Oncotarget,2014, 5 (1) : 49-66.
( 0) 0)
|
| [5] |
Frias MA, Thoreen CC, Jaffe JD, et al. mSin1 is necessary for Akt/PKB phosphorylation, and its isoforms define three distinct mTORC2[J].
Curr Biol,2006, 16 (18) : 1865-70.
DOI: 10.1016/j.cub.2006.08.001. ( 0) 0)
|
| [6] |
Jacinto E, Facchinetti V, Liu D, et al. SIN1/MIP1 maintains rictor-mTOR complex integrity and regulates Akt phosphorylation and substrate specificity[J].
Cell,2006, 127 (1) : 125-37.
DOI: 10.1016/j.cell.2006.08.033. ( 0) 0)
|
| [7] |
Gulhati P, Bowen KA, Liu J, et al. mTORC1 and mTORC2 Regulate EMT, Motility, and Metastasis of Colorectal Cancer via RhoA and Rac1 Signaling Pathways[J].
Cancer Research,2011, 71 (9) : 3246-56.
DOI: 10.1158/0008-5472.CAN-10-4058. ( 0) 0)
|
| [8] |
Oneyama C, Kito Y, Asai R, et al. MiR-424/503-mediated Rictor upregulation promotes tumor progression[J].
PLoS One,2013, 8 (11) : e80300.
DOI: 10.1371/journal.pone.0080300. ( 0) 0)
|
| [9] |
Verreault M, Weppler SA, Stegeman A, et al. Combined RNAimediated suppression of Rictor and EGFR resulted in complete tumor regression in an orthotopic glioblastoma tumor model[J].
PLoS One,2013, 8 (3) : e59597.
DOI: 10.1371/journal.pone.0059597. ( 0) 0)
|
| [10] |
Agarwal NK, Chen CH, Cho H, et al. Rictor regulates cell migration by suppressing RhoGDI2[J].
Oncogene,2013, 32 (20) : 2521-6.
DOI: 10.1038/onc.2012.287. ( 0) 0)
|
| [11] |
Serrano I, McDonald PC, Lock FE, et al. Role of the integrin-linked kinase (ILK)/Rictor complex in TGFbeta-1-induced epithelialmesenchymal transition (EMT)[J].
Oncogene,2013, 32 (1) : 50-60.
DOI: 10.1038/onc.2012.30. ( 0) 0)
|
| [12] |
Guo Z, Zhou Y, Evers BM, et al. Rictor regulates FBXW7-dependent c-Myc and cyclin E degradation in colorectal cancer cells[J].
Biochem Biophys Res Commun,2012, 418 (2) : 426-32.
DOI: 10.1016/j.bbrc.2012.01.054. ( 0) 0)
|
| [13] |
Rathod SS, Rani SB, Khan M, et al. Tumor suppressive miRNA-34a suppresses cell proliferation and tumor growth of glioma stem cells by targeting Akt and Wnt signaling pathways[J].
FEBS Open Bio,2014, 4 (1) : 485-95.
DOI: 10.1016/j.fob.2014.05.002. ( 0) 0)
|
| [14] |
Bashir T, Cloninger C, Artinian N, et al. Conditional astroglial Rictor overexpression induces malignant glioma in mice[J].
PLoS One,2012, 7 (10) : e47741.
DOI: 10.1371/journal.pone.0047741. ( 0) 0)
|
| [15] |
Tsuruta T, Kozaki K, Uesugi A, et al. miR-152 is a tumor suppressor microRNA that is silenced by DNA hypermethylation in endometrial cancer[J].
Cancer Res,2011, 71 (20) : 6450-62.
DOI: 10.1158/0008-5472.CAN-11-0364. ( 0) 0)
|
| [16] |
Im-aram A, Farrand L, Bae SM, et al. The mTORC2 component rictor contributes to cisplatin resistance in human ovarian cancer cells[J].
PLoS One,2013, 8 (9) : e75455.
DOI: 10.1371/journal.pone.0075455. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
