近年来活性氧簇(reactive oxygen species, ROS)对皮肤的损伤作用受到人们的广泛重视[1-2]。ROS是正常氧代谢的副产物,在细胞信号传导,维持机体稳态中发挥重要作用[3]。然而在病理条件或外界环境影响下(例如暴露于紫外线或热源等),ROS急剧增多[3-4],对细胞产生损伤称为氧化应激(oxidative stress, OS),目前OS被认为是导致衰老和疾病的一个重要因素。研究显示NADPH氧化酶(NADPH oxidase, Nox)家族是ROS的主要来源,在氧化应激中具有关键作用,而其在皮肤OS中研究较少。H2O2作为ROS的主要成员之一,可直接或间接损伤细胞,诱导细胞凋亡和坏死[5],被广泛应用于体外氧化应激模型的诱导[6-7]。本文拟以H2O2建立人真皮成纤维细胞(human dermal fibroblasts, HFbs)氧化应激损伤模型,以此为基础探讨NADPH氧化酶在H2O2诱导的HFbs氧化损伤中的作用。
1 材料和方法 1.1 材料 1.1.1 主要试剂胎牛血清(BI),Ⅰ型胶酶、DispaseⅡ、MTT以及二苯基氯化碘盐(Diphenyleneiodonium chloride, DPI)(Sigma),DCFH-DA荧光探针(南京建成生物工程研究所),小鼠抗波形蛋白单克隆抗体(Vimentin)和FITC标记山羊抗小鼠IgG二抗(北京中杉金桥),兔抗人gp91phox多克隆抗体(abcam),鼠抗人Gapdh多克隆抗体、HRP标记山羊抗兔IgG二抗和HRP标记山羊抗鼠IgG二抗(Bioword),H2O2(国产分析纯)。
1.1.2 组织来源包皮组织由南方医科大学南方医院泌
尿外科提供,源于4位健康行包皮环切术者,年龄分别是18、18 、20和25岁,并经患者本人同意。
1.2 方法 1.2.1 人真皮成纤维细胞的原代培养及鉴定包皮组织于超净台内用含青霉素和链霉素PBS洗3次,剪去皮下结缔组织和脂肪,0.1% Dispase Ⅱ 4 ℃过夜,分离表皮和真皮,将真皮剪碎至1 mm3,加入5倍体积0.1% Ⅰ型胶原酶,37 ℃消化0.5~1 h后加入等体积全培终止消化,200钼钢网滤过,1500 r/min,离心10 min,弃上清PBS洗2次。最后加入含10% FBS的DMEM培养基,37 ℃、5% CO2孵箱培养。待细胞70~80%融合,常规胰酶消化传代。第3~6代细胞用于正式实验。
免疫荧光法鉴定:取第3代HFbs,按1×105接种于覆有盖玻片的6孔板中,待细胞生长成单层,取出细胞爬片,4%多聚甲醛固定,0.2%Triton X-100透化2~5 min,5%BSA室温封闭30 min,孵育小鼠抗波形蛋白单克隆一抗1:100 4 ℃过夜,避光孵育荧光二抗1:200 2 h,DAPI染核,甘油封片,荧光显微镜下观察。PBS代替一抗作阴性对照。
1.2.2 细胞处理、分组及MTT法检测细胞活力取对数生长期细胞按5×103个细胞接种于96孔板,24 h后换用1%全培使细胞同步化24 h后分别加入200、400、600、700以及800 μmol/L H2O2,另设正常对照组和空白对照组,每组6个复孔,作用2、4、8、12以及24 h后,每孔加入MTT溶液20 μL(5 mg/mL),37 ℃孵育4 h;弃上清,每孔加入150 μL DMSO,振荡10 min。酶标仪于波长490 nm测各孔吸光度(A)值,计算细胞活力,选择处理24 h细胞活力下降30%~40%的H2O2浓度用于构建HFbs氧化应激损伤模型。确定H2O2处理条件后,将实验分为正常组、氧化损伤组(H2O2处理)、抑制剂组(先予以Nox抑制剂DPI预处理2 h后再加H2O2处理,DPI浓度参考Liu等[8]研究),观察各组细胞形态变化及MTT法测定细胞活力。
1.2.3 细胞内活性氧检测取对数生长期细胞,按以上处理后收集细胞计数调整各组细胞数一致,37 ℃孵育DCFH-DA荧光探30 min,PBS洗去多余探针,多功能酶标仪测定各组在激发波长488 nm,发射波长525 nm处荧光值。
1.2.4 Westernblotting检测gp91phox表达用蛋白质印记法检测各组细胞gp91phox表达。收集各组细胞,PBS洗2次,RIPA裂解液提取蛋白,BCA法测定蛋白浓度,行聚丙酰胺凝胶电泳(蛋白上样量为40 μg/泳道),PVDF膜湿转,5%脱脂奶粉封闭1~2 h,4 ℃孵育一抗过夜,稀释浓度为1:500,室温孵育二抗1~2 h,稀释浓度为1:5000。ECL化学发光试剂盒发光、显影。
1.2.5 统计分析SPSS 19.0进行统计分析。所有数据均采用均数±标准差表示,多组间均数比较采用单因素方差分析,如方差齐性,采用LSD-t法进行两两比较;如方差不齐,采用Dunnett's T3法进行两两比较。P < 0.05认为差异有统计学意义。
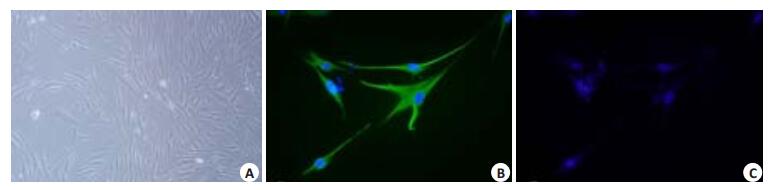
2 结果 2.1 人真皮成纤维细胞形态学观察及鉴定倒置显微镜下观察细胞体积较大,呈长梭形(图 1A)。免疫荧光结果显示:细胞核呈蓝色,卵圆形,Vimentin定位在胞质,呈绿色荧光,高表达相对特异的标记物Vimentin(图 1B),再根据其组织来源证实为HFbs,阴性对照组无阳性荧光表达(图 1C)。
|
图 1 人真皮成纤维形态学观察及鉴定 Figure 1 Morphological observation and identification of cultured human dermal fibroblasts (HFbs). A: Dermal fibroblasts (Original magnification: ×100); B: Vimentin(+)(×400); C: Negative control(×400). |
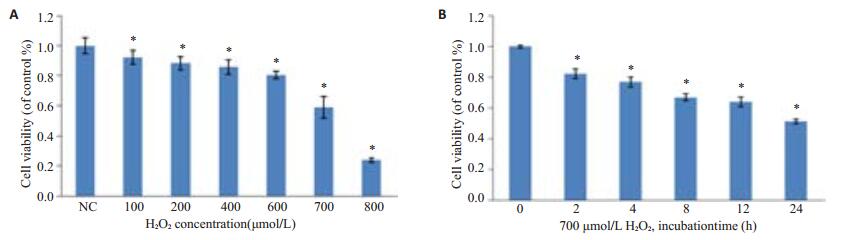
不同浓度H2O2使HFbs细胞活力下降,并呈浓度(图 2A)和时间依赖(图 2B)。H2O2 700 μmol/L处理24 h后,细胞活力较正常组下降40%(P < 0.05),差异有统计学意义。
|
图 2 H2O2对Hfbs细胞活力的影响 Figure 2 Effect of H2O2 on the viability of cultured HFbs. A: H2O2 exposure for 24 h concentration-dependently reduces the cell vitality (*P < 0.05 vs normal cells); B: At the concentration of 700 μmol/L, H2O2 time-dependently reduces the cell vitality (*P < 0.05 vs normal cells). |
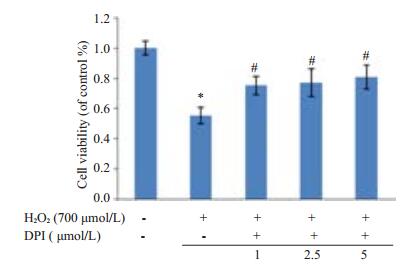
光镜下示100 μmol/L H2O2处理24 h后对细胞形态无明显影响(图 3B),随着浓度增加至700 μmol/L,H2O2可使HFbs形态发生明显改变,细胞皱缩,体积变小、细胞间隙增大(图 3C);而抑制剂组在加入DPI后与氧化损伤组相比体积增大,细胞数目增加(图 3D),同时MTT结果显示抑制剂组细胞活力较氧化损伤组明显升高(P < 0.05)差异有统计学意义(图 4),然而不同浓度DPI处理后各组差异并无统计学意义。

|
图 3 DPI对HFbs细胞形态影响 Figure 3 Effect of NADPH oxidase inhibitor on the morphology of HFbs (Original magnification: ×100). A: Normal control group; B: Cells treated with 100 μmol/L H2O2 for 24 h; C: Cells treated with 700 μmol/L H2O2 for 24 h; D: Cells pretreated 1 μmol/L of NADPH oxidase inhibitor for 2 h before exposure to 700 μmol/L H2O2 for 24 h. |
|
图 4 DPI对HFbs增值的影响 Figure 4 Effect of NADPH oxidase inhibitor on proliferation of HFbs. *P < 0.05 vs normal group; #P < 0.05 vs oxidative stress injury group. |
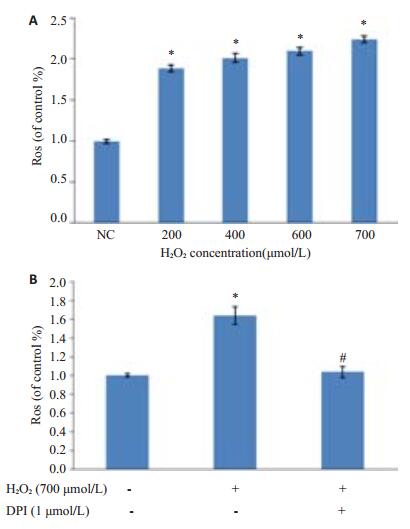
H2O2处理2 h后HFbs细胞内ROS明显升高,并呈浓度依赖(图 5A),而经DPI预处理后抑制剂组与氧化损伤组相比细胞内ROS水平明显下降(P < 0.05),差异有统计学意义;而与正常组相比细胞内ROS未见明显升高(P>0.05),如图 5B所示。
|
图 5 细胞内ROS变化 Figure 5 Changes of intracellular ROS in the cells. *P < 0.05 vs normal group; #P < 0.05 vs oxidative stress injury group. |
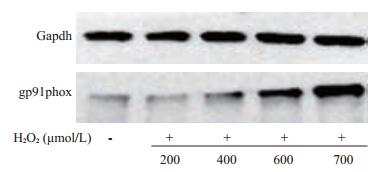
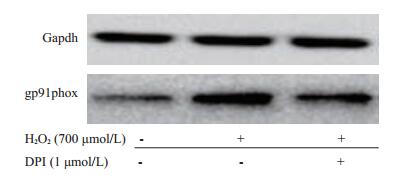
Western blotting显示正常HFbs gp91phox表达较低,而在不同浓度H2O2处理24 h后其表达较正常组升高并呈浓度依赖(图 6)。而如图 7所示抑制剂组加入DPI处理后与氧化损伤组比较可明显降低gp91phox的表达。
|
图 6 H2O2以浓度依赖的方式增加gp91phox表达 Figure 6 H2O2 increased the expression of gp91phox in HFbs in a concentration-dependent manner. |
|
图 7 DPI降低H2O2诱导的gp91phox表达 Figure 7 NADPH oxidase inhibitor decreased H2O2-induced expression of gp91phox in HFbs. |
正常情况下,HFbs内自由基的产生和清除处于动态平衡状态,一旦平衡被打破,ROS过度积累,就会引发氧化链式反应和脂质过氧化反应从而引发皮肤疾病和衰老[9-11]。H2O2是主要的活性氧之一,作为膜易透性氧化剂,可在多种细胞培养模型中引起细胞损伤[12-15]。本实验中加入外源性H2O2诱导HFbs氧化应激损伤,结果显示随着H2O2浓度和作用时间增加氧化损伤组细胞活力逐渐下降,H2O2 700 μmol/L处理24 h后,细胞活力下降40%。实验发现H2O2 100 μmol/L时细胞活力较正常组已有下降,但光镜下细胞形态未见明显改变,然而随着H2O2浓度增加,光镜示细胞数量减少、皱缩,失去原有形态且培养基细胞碎片增多。研究表明ROS水平直接反映了细胞内氧化应激的程度[16],本实验检测细胞内ROS水平亦与细胞损伤相一致,随着细胞活力下降ROS升高也越来越明显,在H2O2 700 μmol/L处理2 h后ROS较正常组升高2倍。以上结果说明随着H2O2浓度的增加表现出明显的损伤效应,先是细胞功能的改变(ROS升高),损伤积累到一定程度就触发了细胞不可逆的损伤(细胞活力下降)。
研究显示NADPH氧化酶是体内催化生成ROS的主要酶体[17-18],由胞膜gp91phox、p22phox亚单位和胞质p47phox、p67phox、p40phox、小GTP酶和Rac亚单位组成,gp91phox是其主要的功能亚单位。在不同细胞中发现一系列gp91phox的同源物,统称为Nox蛋白家族。人类Nox基因组包括7个成员,即Nox1~5、Duox1和Duox2,gp91phox亦称为Nox2。Nox通过配体诱导方式感受胞外信息,外来信号刺激使其激活或失活,从而迅速升高或降低细胞内的ROS水平[19]。Spadoni等[20]发现在系统性硬化病成纤维细胞中Nox2和Nox4表达增加诱导ROS过度产生,并在细胞异常活化和DNA损伤起着至关重要的作用。Zhang等[21]证实TGF-ß1活化Nox,可诱导Nox2表达升高促使ROS积聚加速皮肤纤维化进程,并且这一作用可被DPI和Nox2siRNA减弱。研究发现,心肌缺血再灌注时,Nox2基因表达显著上调,伴随活性氧水平升高,提示Nox2在介导心肌缺血再灌注氧化损伤中起主要作用[22]。宋晖等[23]认为热损伤可激活人皮肤成纤维细胞Nox并促进其蛋白表达,增加ROS产生,细胞内升高的ROS可进一步促进PGE2的释放,从而促进参与创伤修复早期阶段的炎症反应。这些研究表明Nox,特别是Nox2与多种疾病的发生发展都有着密切的联系。本实验结果示正常HFbs中gp91phox表达较低,而在H2O2刺激后明显上调,并与细胞内ROS水平和细胞损伤程度相一致。这些研究都提示H2O2可能是通过诱导Nox活化,进一步导致ROS累积并加重氧化应激反应。
为探讨NADPH氧化酶在氧化应激损伤中的作用,我们在抑制剂组加入DPI预处理2 h后再加入H2O2,结果显示DPI抑制了gp91phox的表达,细胞活力较氧化损伤组明显升高,细胞内ROS水平几乎恢复至正常水平,有效保护了H2O2对HFbs的氧化损伤。由此推测DPI可抑制Nox重要功能亚基gp91phox的表达,减少H2O2诱导的ROS积聚,从而实现对细胞的保护作用,而MTT结果显示抑制剂组细胞活力仍低于正常组,考虑H2O2本身为较强的活性氧物质,可直接损伤细胞,DPI可能仅抑制H2O2对Nox的活化,从而减轻H2O2引发的氧化链式反应和脂质过氧化反应以此保护细胞。
综上所述,Nox在H2O2导致的氧化应激损伤中具有重要作用,DPI有效保护H2O2对HFbs的氧化损伤,且这一保护效应可能是通过抑制gp91phox的表达起作用,结合以往研究:NADPH氧化酶在皮肤纤维化和创伤修复的炎症反应阶段都具有重要作用,皮肤的氧化损伤、纤维化和炎症反应都是引发皮肤衰老的主要原因[24],本研究表明通过抑制Nox能够防止皮肤HFbs氧化损伤,因此对于保护皮肤组织正常结构、功能和延缓皮肤衰老具有重要意义,同时也为改善皮肤衰老提供了一条新的防治思路。除gp91phox在H2O2诱导的HFbs氧化损伤中的变化外,其他Nox亚型及其在皮肤光老化中的作用也应进一步研究。
| [1] |
Oyewole AO, Wilmot MC, Fowler M, et al. Comparing the effects of mitochondrial targeted and localized antioxidants with cellular antioxidants in human skin cells exposed to UVA and Hydrogen peroxide[J].
FASEB J,2014, 28 (1) : 485-94.
DOI: 10.1096/fj.13-237008. ( 0) 0)
|
| [2] |
Giampieri F, Alvarez-Suarez JM, Tulipani S, et al. Photoprotective potent-ial of strawberry (Fragaria x ananassa) extract against UV-A irradiation damage on human fibroblasts[J].
J Agric Food Chem,2012, 60 (9) : 2322-7.
DOI: 10.1021/jf205065x. ( 0) 0)
|
| [3] |
Manke A, Luanpitpong S, Dong CB, et al. Effect of fiber length on Carbon Nanotube-Induced fibrogenesis[J].
Int J Mol Sci,2014, 15 (5) : 7444-61.
DOI: 10.3390/ijms15057444. ( 0) 0)
|
| [4] |
Devasagayam TP, Tilak JC, Boloor KK, et al. Free radicals and antioxid-ants in human health:current status and future prospects[J].
J Assoc Physicians India, (52) : 794-804.
( 0) 0)
|
| [5] |
Bhattacharjee S, Deterding LJ, Chatterjee S, et al. Site-specific radical formation in DNA induced by Cu(II)-H(2)O(2)oxidizing system, using ESR, immuno-spin trapping, LC-MS, and MS/MS[J].
Free Radic Biol Med,2011, 50 (11) : 1536-45.
DOI: 10.1016/j.freeradbiomed.2011.02.034. ( 0) 0)
|
| [6] |
Zhou YE, Dong Y, Xu QG, et al. Mussel oligopeptides ameliorate cognition deficit and attenuate brain senescence in D-galactoseinduced aging mice[J].
Food Chem Toxicol,2013, 59 : 412-20.
DOI: 10.1016/j.fct.2013.06.009. ( 0) 0)
|
| [7] |
Chen QM, Bartholomew JC, Campisi J, et al. Molecular analysis of H2O2-induced senescent-like growth arrest in normal human fibroblasts:p53 and Rb control G1 arrest but not cell replication[J].
Biochem J,1998, 332 (Pt 1) : 43-50.
( 0) 0)
|
| [8] |
Liu L, Rezvani HR, Back JH, et al. Inhibition of p38 MAPK signaling augments skin tumorigene sis via NOX2 driven ROS Generation[J].
PLoS One,, 9 (5) : e97245.
DOI: 10.1371/journal.pone.0097245. ( 0) 0)
|
| [9] |
Sun LW, Isaak CK, Zhou YL, et al. Salidroside and tyrosol from Rhodiola protect H9c2 cells from ischemia/reperfusion-induced apoptosis[J].
Life Sci,2012, 91 (5/6) : 151-8.
( 0) 0)
|
| [10] |
Sohal RS, Allen RG. Oxidative stress as a causal factor in differentiation and aging:a unifying hypothesis[J].
Exp Gerontol,1990, 25 (6) : 499-522.
DOI: 10.1016/0531-5565(90)90017-V. ( 0) 0)
|
| [11] |
Halliwell B, Gutteridge JM. Oxygen toxicity, oxygen radicals, transition metals and disease[J].
Biochem J,1984, 219 (1) : 1-14.
DOI: 10.1042/bj2190001. ( 0) 0)
|
| [12] |
Leichert LI, Gehrke F, Gudiseva HV, et al. Quantifying changes in the thiol redox proteome upon oxidative stress in vivo[J].
Proc Natl Acad Sci USA,2008, 105 (24) : 8197-202.
DOI: 10.1073/pnas.0707723105. ( 0) 0)
|
| [13] |
Hou X, Tong Q, Wang W, et al. Dihydromyricetin protects endothelial cell s from Hydrogen peroxide-induced oxidative stress damage by regulating mitoch ondrial pathways[J].
Life Sci,2015, 130 : 38-46.
DOI: 10.1016/j.lfs.2015.03.007. ( 0) 0)
|
| [14] |
Bian YY, Guo J, Majeed H, et al. Ferulic acid renders protection to HEK293 cells against oxidative damage and apoptosis induced by Hydrogen peroxide[J].
In Vitro Cell Dev Biol Anim,2015, 51 (7) : 722-9.
DOI: 10.1007/s11626-015-9876-0. ( 0) 0)
|
| [15] |
Xia N, Yan RY, Liu Q, et al. Augmenter of liver regeneration plays a prot-ective role against Hydrogen peroxide-inducedoxidative stress in renal proximal tubule cells[J].
Apoptosis,2015, 20 (4) : 423-32.
DOI: 10.1007/s10495-015-1096-2. ( 0) 0)
|
| [16] |
Schieber M, Chandel NS. ROS function in redox signaling and oxidative stress[J].
Current Biology,2014, 24 (10) : R453-62.
DOI: 10.1016/j.cub.2014.03.034. ( 0) 0)
|
| [17] |
Gill PS, Wilcox CS. NADPH oxidases in the kidney[J].
Antioxid Redox Signal,2006, 8 (9/10) : 1597-607.
( 0) 0)
|
| [18] |
Bedard K, Krause KH. The NOX family of ROS-generating NADPH oxidases:physiology and pathophysiology[J].
Physiol Rev,2007, 87 (1) : 245-313.
DOI: 10.1152/physrev.00044.2005. ( 0) 0)
|
| [19] |
Kleniewska P, Piechota A, Skibska B, et al. The NADPH oxidase family and its inhibitors[J].
Arch Immunol Ther Exp (Warsz),2012, 60 (4) : 277-94.
DOI: 10.1007/s00005-012-0176-z. ( 0) 0)
|
| [20] |
Spadoni T, Svegliati B S, Amico D, et al. A reactive oxygen species-mediated loop maintains increased expression of NADPH oxidases 2 and 4 in skin fibroblasts from patients with systemic sclerosis[J].
Arthritis Rheumatol,2015, 67 (6) : 1611-22.
DOI: 10.1002/art.39084. ( 0) 0)
|
| [21] |
Zhang GY, Wu LC, Dai T, et al. NADPH oxidase-2 is a key regulator of human dermal fibroblas ts:a potential therapeutic strategy for the treatment of skin fibrosis[J].
Exp Dermatol,2014, 23 (9) : 639-44.
DOI: 10.1111/exd.12479. ( 0) 0)
|
| [22] |
Zhang YS, He L, Liu B, et al. A novel pathway of NADPH oxidase/vascular peroxidase 1 in mediating oxidative injury following ischemia-reperfusion[J].
Basic Res Cardiol,2012, 107 (3) : 266.
DOI: 10.1007/s00395-012-0266-4. ( 0) 0)
|
| [23] |
宋晖, 石有振, 俞为荣, 等. 热损伤对人皮肤成纤维细胞氧化应激的影响[J].
中华临床医师杂志:电子版,2013 (13) : 5943-7.
( 0) 0)
|
| [24] |
刘玮. 皮肤光老化[J].
临床皮肤科杂志,2003, 32 (7) : 424-6.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
