糖尿病肾病(DN)是全球范围内引起肾衰的首要因素。此外,DN可增加患者的心血管事件及全因死亡率[1]。肾小球系膜细胞增殖、ECM沉积和肾小球基底膜增厚是DN的主要病理改变[2]。Exendin4是一种从希拉毒蜥的唾液中分离得到的含39个氨基酸的多肽化合物[3]。与哺乳动物胰高血糖素样肽-1(GLP-1)的氨基酸序列53%同源[4]。已有研究表明,exendin-4对db/db小鼠有一定的肾脏保护作用[5],对HMC有一定的抗纤维化作用[6]。但是exendin-4发挥肾脏保护作用的机制尚不清楚,目前关于这方面的研究较少。因此本研究采用高糖刺激下HMC为体外模型,观察exendin-4对高糖刺激下HMC损伤的保护作用并探讨其可能的保护机制,为exendin-4用于DN的治疗提供实验依据。
1 材料和方法 1.1 材料 1.1.1 细胞来源HMC购于美国Sciencell公司
1.1.2 主要试剂耗材Cell Counting Kit-8(CCK-8试剂盒)(碧云天生物);Antibody p44/p42 MAPK(ERK1/ 2)、Antibody Phospho-p44/42 MAPK(ERK1/2)(Cell Signaling),Antibody β-actin(中杉金桥生物),Antibody TGF-beta1(RnD),Antibody Fibronectin(sigma),Antibody Collagen Type 1(merck millipore),抗兔、抗鼠荧光二抗(LI-COR Biosciences),exendin-4购于sigmaAldrich,DMEM培养基、胎牛血清、0.25%胰酶购于Gibco,0.45 μm PVDF膜购于Millipore。
1.2 方法 1.2.1 细胞培养及分组干预HMC细胞培养于含10%胎牛血清、青霉素(100 U/mL)和链霉素(100 μg/mL)的DMEM低糖培养基中,置于37 ℃、5% CO2细胞培养箱内培养,2~3 d换培养液,细胞生长至90%融合时传代。细胞进入对数生长期后,用0.25%胰蛋白酶消化制成细胞悬液后分组用于实验。实验分组:正常对照组(NG组,葡萄糖浓度5.6 mmol/L),渗透压对照组(Man组,5.6 mmo/L葡萄糖+24.4 mmol/L甘露醇),高糖组(HG组,葡萄糖浓度30 mmol/L),高糖联合不同浓度exendin-4组(HG+1 nmol/L exendin-4组、HG+10 nmol/L exendin-4组、HG+100 nmol/L exendin-4组)。
1.2.2 HMC增殖的测定取对数期生长的HMC接种于96孔培养板中,使每孔含细胞约4×103个。先用含1%胎牛血清的培养基培养24 h,使细胞同步于静止期,按1.2.1所述方法分组培养24 h。终止前1 h在每个孔内加入CCK-8溶液10 μL,混匀后37 ℃继续孵育1 h,用酶联免疫检测仪在450 nm波长检测每孔吸光度值。实验重复3次。
1.2.3 Western Blotting检测Ⅰ型胶原、FN、TGF-β1、ERK/p-ERK表达HMC分组同上,不同实验分组干预结束后,用RIPA裂解液提取细胞总蛋白,BCA法测蛋白浓度。取变性蛋白样品20 μg以10% SDS-聚丙烯酰胺凝胶电泳分离,PVDF膜转移后,室温封闭1 h后加入1:1000稀释的一抗,4 ℃孵育过夜,置于荧光二抗(1: 15 000)室温孵育1 h,使用Odyssey双色红外荧光扫描成像系统获得图片,运用Quantity One图像分析软件测得条带灰度值,将各目的条带与内参条带比值后,比较各组间差异。实验重复3次。
1.2.4 统计学处理所有数据均以均数±标准差表示,采用SPSS 19.0软件进行统计分析,多组间采用One-way ANOVA进行统计,两两比较使用LSD检验,P值小于0.05表示差异有统计学意义。
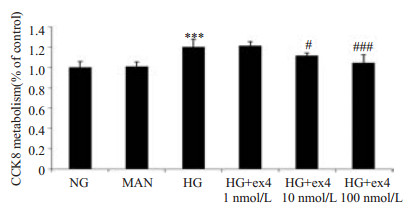
2 结果 2.1 exendin-4对高糖诱导的HMC增殖的影响孵育24 h后,NG和Man组细胞增殖无明显差异。与NG组相比,HG组细胞增殖明显增强(1±0.06 vs 1.20±0.07,P < 0.001);1 nmol/L浓度的exendin-4对高糖诱导的人系膜细胞增殖水平的影响无统计学差异。10、100 nmol/L浓度的exendin-4均可下调高糖诱导的HMC增殖(1.12±0.02 vs 1.20±0.07,P < 0.05,1.05±0.08 vs 1.20±0.07,P < 0.001),且exendin-4浓度越高抑制作用越明显(图 1)。
|
图 1 exendin-4对高糖诱导的HMC增殖的影响 Figure 1 CCK8 assay of effects of exendin-4 on proliferation of high glucose-induced HMC. ***P < 0.001 vs NG group; #P < 0.05, ###P < 0.001 vs HG group. |
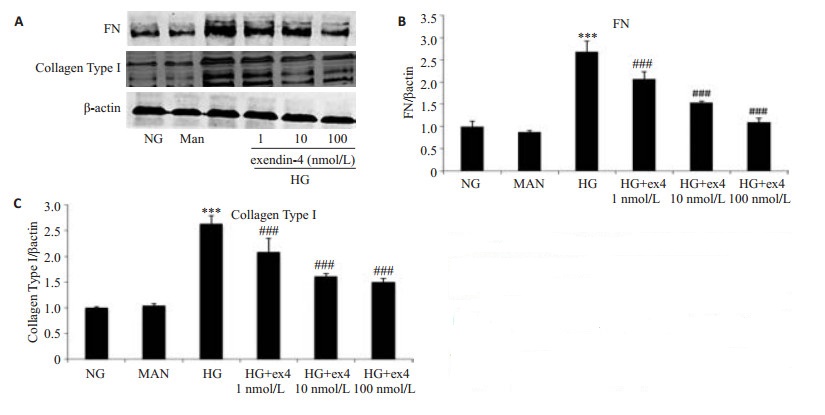
孵育24 h后,NG和Man组HMC的Ⅰ型胶原、FN蛋白表达量无明显差异。与NG组相比,HG组蛋白表达量显著增加(P < 0.001);1、10、100 nmol/L浓度的exendin-4均可下调高糖诱导的HMC的Ⅰ型胶原、FN表达,且exendin-4浓度越高抑制作用越明显(图 2)。
|
图 2 exendin-4对高糖诱导的人肾小球系膜细胞I型胶原、 FN蛋白表达的影响 Figure 2 Effects of exendin-4 on collagen type I and FN expressions under high glucose conditions. A: Protein levels of the FN and collagen type I determined by Western blotting; B-C: Densitometry quantification of Western blotting results; ex-4: Exendin-4. ***P < 0.001 vs NG group; ###P < 0.001 vs HG group. |
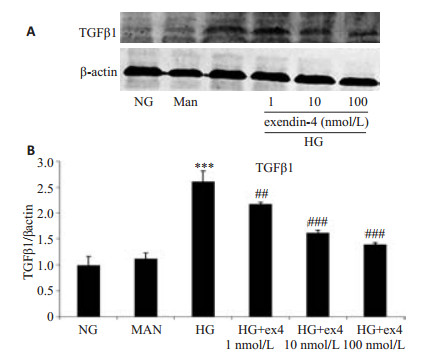
孵育24 h后,NG和Man组HMC的TGFβ1蛋白表达量无明显差异。与NG组相比,HG组蛋白表达量显著增加(P < 0.001);1、10、100 nmol/L浓度的exendin-4均可下调高糖诱导的HMC的TGFβ1表达,且exendin-4浓度越高抑制作用越明显(P < 0.01,图 3)。
|
图 3 exendin-4对高糖诱导的人肾小球系膜细胞TGF-β1蛋白表达的影响 Figure 3 Effects of exendin-4 on TGF-β1 expression under high glucose conditions. A: Protein levels of TGF-β1 determined by Western blotting; B: Densitometry quantification of Western blotting results. ex-4: Exendin-4. ***P < 0.001 vs NG group; ##P < 0.01, ###P < 0.001 vs HG group. |
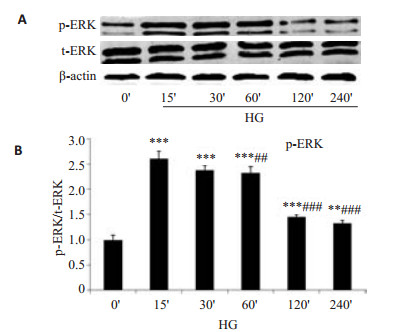
图 4显示HG 0 min(HG 0)' HMC有少量磷酸化ERK蛋白表达,HG刺激15 min(HG 15)'后ERK磷酸化蛋白表达明显增多,刺激30 min(HG 30)'后ERK磷酸化蛋白的表达开始减弱,刺激至4 h(HG 240)' ERK磷酸化蛋白的表达仍未消失。统计学分析显示HG刺激各时间点HMC磷酸化ERK(p-ERK)/总ERK(t-ERK)蛋白相对表达量有显著差异。
|
图 4 HG诱导HMC不同时间点ERK磷酸化蛋白的表达 Figure 4 Effects of high glucose on ERK phosphorylation in HMC. A: Protein levels of p-EERK determined by Western blotting; B: Densitometry quantification of Western blotting results. ***P < 0.001 vs HG 0' group; ##P < 0.01, ###P < 0.001 vs HG 15' group. |
2.4节结果显示HG刺激HMC 15 min能激活ERK,增加ERK磷酸化蛋白的表达。因此本组实验各不同处理组刺激细胞时间为15 min。15 min后,NG组和Man组的ERK磷酸化蛋白表达无明显差异,HG组HMC ERK磷酸化蛋白表达比NG组明显增多(P < 0.001),与HG组比较,HG联合不同浓度的exendin-4培养细胞,随着exendin-4药物浓度的增加,细胞ERK磷酸化蛋白表达水平逐渐减少(P < 0.001,图 5)。
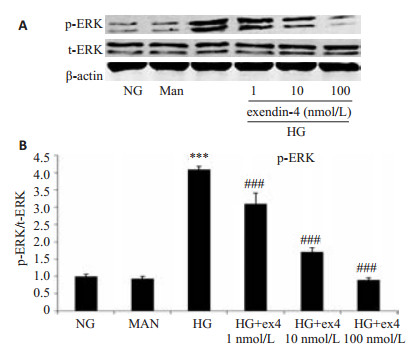
|
图 5 exendin-4对高糖诱导的人肾小球系膜细胞p-ERK蛋白表达的影响 Figure 5 Effects of exendin-4 on p-ERK under high glucose conditions. A: Protein levels of the p-EERK were determined by Western blotting; B: Densitometry quantification of Western blotting results. ex-4: Exendin-4. ***P < 0.001 vs NG group; ###P < 0.001 vs HG group. |
GLP-1通过它的高亲和力受体,人胰高血糖素样肽-1受体(GLP-1R)增加了葡萄糖诱导的胰岛β细胞分泌的胰岛素,抑制了胰高血糖素的分泌。GLP-1R存在于胰岛外组织,比如肾脏(包括肾小球系膜细胞[7])、血管组织和中央神经组织。有研究表明,GLP-1R的表达增多可在人肾小管上皮细胞及SD糖尿病大鼠中发挥肾脏保护作用[8],GLP1-1还可与肾小球系膜细胞上的GLP-1R结合抑制糖基化终产物的生成,起到局部改善糖尿病肾病的作用[9]。但是内源性的GLP-1会迅速被二肽基肽酶(DPP-4)降解,限制了其应用。所以可以抵抗DPP-4的GLP-1R激动剂,比如exendin-4开始应用于治疗2型糖尿病患者, 已有皮下注射针剂获美国FDA批准如艾塞那肽注射液。PARK的研究表明,8周的exendin-4治疗可改善db/db小鼠的糖尿病肾病和代谢异常[5]。
在实验动物模型中,系膜细胞增殖常常先于ECM的沉积,其为肾小球毛细血管的一部分,被碱性成纤维生长因子刺激后开始增殖。系膜细胞增殖受到包括血小板衍生生长因子在内的自身内分泌机制的调节[10]。本研究通过cck8表明,高糖可诱导系膜细胞增殖,与文献报道一致[11]。同时本研究表明exendin-4可以抑制系膜细胞增殖,并呈浓度依赖性。
此外,本研究表明exendin-4可抑制高糖刺激导致的Ⅰ型胶原、FN表达升高。Ⅰ型胶原、FN是ECM中重要的蛋白,在系膜细胞中高糖刺激引起的Ⅰ型胶原、FN表达增多导致肾小球硬化加速,抑制Ⅰ型胶原、FN的表达可减轻肾小球硬化[12-13]。TGF-β1是在包括糖尿病肾病等许多肾脏疾病中的肾小球硬化和肾间质纤维化中起重要作用的纤维化和炎症因子,高血糖引起的TGF-β 1的异常产生导致ECM蛋白的过度沉积,例如胶原和FN,最终导致肾小球系膜扩张和肾小球基底膜增厚[14]。因此,TGF-β1被认为是DN治疗中的一个干预目标。本研究表明高糖刺激的HMC TGF-β1蛋白表达升高,exendin-4处理可抑制TGF-β1蛋白表达。
丝氨酸/苏氨酸蛋白激酶家族中的丝裂原活化蛋白激酶(MAPK),可受多种细胞外刺激调节细胞内信号转导,MAPK亚家族包括ERK、c-Jun氨基末端激酶(JNK)和P38 MAPK[15]。已有研究表明TGF-β1激活非经典smad通路的ERK通路以后,可增加HMCⅠ型胶原的合成[16]。另有研究者发现,TGF-β1通过ERK1/2途径,导致肾小管细胞ECM沉积[17]。TGF-β1/ERK是否参与exendin-4对DN的改善尚未见阐明。本研究表明高糖刺激HMC后ERK磷酸化蛋白表达明显升高,与TGF-β1相关,exendin-4处理后可抑制ERK磷酸化蛋白表达。由于MAPK信号通路之间存在交互和协同作用,因此仍需要进一步研究它们之间的作用及作用机制。
综上所述,exendin-4可通过抑制TGF-β1/ERK信号通路抑制高糖刺激下HMC的增殖和Ⅰ型胶原、FN的分泌,且该抑制作用具有一定的量效关系。由此推测,exendin-4可能在延缓DN肾小球硬化的进程中发挥了积极的作用。
| [1] |
Eboh C, Chowdhury TA. Management of diabetic renal disease[J].
Ann transl med,2015, 3 (11) : 154.
( 0) 0)
|
| [2] |
Dronavalli S, Duka I, Bakris GL. The pathogenesis of diabetic nephropathy[J].
Nature Clin Prac Endocrinol Metabol,2008, 4 (8) : 444-52.
DOI: 10.1038/ncpendmet0894. ( 0) 0)
|
| [3] |
Eng J, Kleinman WA, Singh L, et al. Isolation and characterization of exendin-4, an exendin-3 analogue, from Heloderma suspectum venom. Further evidence for an exendin receptor on dispersed acini from Guinea pig pancreas[J].
J Biol Chem,1992, 267 (11) : 7402-5.
( 0) 0)
|
| [4] |
G?ke R, Fehmann HC, Linn T, et al. Exendin-4 is a high potency agonist and truncated exendin-(9-39)-amide an antagonist at the glucagon-like peptide 1-(7-36)-amide receptor of insulin-secreting beta-cells[J].
J Biol Chem,1993, 268 (26) : 19650-5.
( 0) 0)
|
| [5] |
Park CW, Kim HW, Ko SH, et al. Long-term treatment of glucagon-like peptide-1 analog exendin-4 ameliorates diabetic nephropathy through improving metabolic anomalies in db/db mice[J].
J Am Soc Nephrol,2007, 18 (4) : 1227-38.
DOI: 10.1681/ASN.2006070778. ( 0) 0)
|
| [6] |
Li W, Cui M, Wei Y, et al. Inhibition of the expression of TGF-β1 and CTGF in human mesangial cells by exendin-4, a glucagon-like peptide-1 receptor agonist[J].
Cell Physiol Biochem,2012, 30 (3) : 749-57.
DOI: 10.1159/000341454. ( 0) 0)
|
| [7] |
Kim DI, Park MJ, Heo YR, et al. Metformin ameliorates lipotoxicity-induced mesangial cell apoptosis partly via upregulation of glucagon like peptide-1 receptor (GLP-1R)[J].
Arch Biochem Biophys,2015, 584 : 90-7.
DOI: 10.1016/j.abb.2015.08.009. ( 0) 0)
|
| [8] |
Zhao X, Liu G, Shen H, et al. Liraglutide inhibits autophagy and apoptosis induced by high glucose through GLP-1R in renal tubular epithelial cells[J].
Int J Mol Med,2015, 35 (3) : 684-92.
( 0) 0)
|
| [9] |
Ishibashi Y, Nishino Y, Matsui T, et al. Glucagon-like peptide-1 suppresses advanced glycation end product-induced monocyte chemoattractant protein-1 expression in mesangial cells by reducing advanced glycation end product receptor level[J].
Metabolism,2011, 60 (9) : 1271-7.
DOI: 10.1016/j.metabol.2011.01.010. ( 0) 0)
|
| [10] |
Gruden G, Perin PC, Camussi G. Insight on the pathogenesis of diabetic nephropathy from the study of podocyte and mesangial cell biology[J].
Curr Diabetes Rev,2005, 1 (1) : 27-40.
DOI: 10.2174/1573399052952622. ( 0) 0)
|
| [11] |
Gao J, Wang F, Wang W, et al. Emodin suppresses hyperglycemiainduced proliferation and fibronectin expression in mesangial cells via inhibiting cFLIP[J].
PLoS One,2014, 9 (4) : e93588.
DOI: 10.1371/journal.pone.0093588. ( 0) 0)
|
| [12] |
Hornigold N, Johnson TS, Huang L, et al. Inhibition of collagen I accumulation reduces glomerulosclerosis by a Hic-5-dependent mechanism in experimental diabetic nephropathy[J].
Lab Invest,2013, 93 (5) : 553-65.
DOI: 10.1038/labinvest.2013.42. ( 0) 0)
|
| [13] |
Dixon AJ, Burns J, Dunnill MS, et al. Distribution of fibronectin in normal and diseased human kidneys[J].
J Clin Pathol,1980, 33 (11) : 1021-8.
DOI: 10.1136/jcp.33.11.1021. ( 0) 0)
|
| [14] |
Garud MS, Kulkarni YA. Hyperglycemia to nephropathy via transforming growth factor beta[J].
Curr Diabetes Rev,2014, 10 (3) : 182-9.
DOI: 10.2174/1573399810666140606103645. ( 0) 0)
|
| [15] |
Kim EK, Choi EJ. Pathological roles of MAPK signaling pathways in human diseases[J].
BBA Mol Bas Dis,2010, 1802 (4) : 396-405.
DOI: 10.1016/j.bbadis.2009.12.009. ( 0) 0)
|
| [16] |
Hayashida T, Decaestecker M, Schnaper HW. Cross-talk between ERK MAP kinase and Smad signaling pathways enhances TGFbeta-dependent responses in human mesangial cells[J].
FASEB J,2003, 17 (11) : 1576-8.
( 0) 0)
|
| [17] |
Xiao HB, Liu RH, Ling GH, et al. HSP47 regulates ECM accumulation in renal proximal tubular cells induced by TGF-β1 through ERK1/2 and JNK MAPK pathways[J].
Am J Physiol Renal Physiol,2012, 303 (5) : F757-65.
DOI: 10.1152/ajprenal.00470.2011. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
