2. 解放军总医院泌尿外科, 北京 100853 ;
3. 解放军第 309医院泌尿外科, 北京 100091
2. Department of Urology, General Hospital of PLA, Beijing 100853, China ;
3. Department of Urology, 309 Hospital of PLA, Beijing 100091, China
泌尿系统的肿瘤、炎症、损伤和先天畸形等疾病都可导致输尿管损伤[1],传统的手术治疗方式不一定能完全恢复输尿管自身的功能,甚至可能会引起一系列的手术并发症,如再发性狭窄、输尿管漏、肾损伤等[2]。随着组织工程技术在泌尿系统中广泛应用,为输尿管的重建提供了新的契机[3]。在输尿管重建过程中,支架的选择尤为重要。支架材料主要包括人工合成支架材料和天然支架材料两种。人工合成支架材料缺乏良好的生物相容性,且不具备输尿管的蠕动功能,以及移植后形成硬壳,人工合成支架材料的应用受限[4]。天然支架材料中的脱细胞基质因其独特的优势,引起广泛的关注。本实验采用灌注系统结合脱细胞常规应用的物理和化学法,制备输尿管脱细胞基质,评价制备的输尿管脱细胞基质,探讨其应用于输尿管再造的可能性。
1 材料和方法 1.1 实验动物和主要试剂健康雌性10月龄比格犬5只,体质量7~10 kg,解放军总医院动物中心提供。高糖培养基(H-DMEM)、胎牛血清(Gibco);Ⅳ型胶原酶、Dispase酶、十二烷基硫酸钠(SDS)、TritonX-100、4,6-二脒基-2-苯基吲哚(DAPI)(Sigma);DNA提取试剂盒(天根);犬糖胺聚糖Elisa试剂盒(上海邦奕生物科技有限公司);α-SMA单克隆抗体(北京博奥森公司)。
1.2 输尿管取材比格犬静脉给予3%戊巴比妥钠(25 mg/kg)麻醉,气管插管。下腹正中切口进入腹腔,游离双侧全长的输尿管去除其周围粘连的组织后剪断取出,放在4 ℃的磷酸盐缓冲液(PBS)中。切开膀胱顶部,取2.5 cm×2.5 cm的全层膀胱组织。
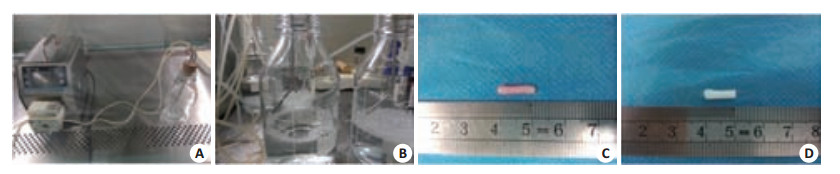
1.3 灌注法制备输尿管脱细胞基质将取材的输尿管放在-80 ℃冰箱中24 h后常温解冻,将16-G的针头插入到输尿管管腔中,通过硅胶管将输尿管连接到蠕动泵上,进行灌注脱细胞(图 1A,B)。分别使用3组不同灌注方案进行灌注脱细胞处理。1% SDS灌注8 h(SDS组);1% TritonX-100灌注8 h(TritonX-100组);1%TritonX-100灌注7 h后再用1% SDS灌注1 h(联合组)。去离子水灌注24 h洗去残留的灌注液。灌注速度保持在1.5 mL/min。制备好的输尿管脱细胞基质浸泡在包含有100 U/mL青霉素和100 μg/mL的链霉素的PBS中,4℃储存。
|
图 1 灌注系统组成及输尿管脱细胞前后大体形态 Figure 1 The perfusion system (A, B) and the canine ureter before (C) and after (D) decellularization (C-D). |
HE染色观察输尿管脱细胞基质中是否有细胞核的残留,DAPI染色进一步观察细胞核残留情况,Masson's 3色染色观察胶原的分布和走向,Alcian Blue染色观察输尿管脱细胞基质中糖胺聚糖(GAG)的分布情况[5]。
1.5 输尿管脱细胞基质DNA定量分析将输尿管和输尿管脱细胞基质分别冻干称重后按照DNA试剂盒说明书中步骤离心纯化DNA。用分光光度计来测量DNA的含量。同时配置2%的琼脂糖凝胶,进行凝胶电泳观察DNA条带。
1.6 输尿管脱细胞基质生物活性成分定量检测将输尿管和输尿管脱细胞基质分别冻干称重,利用酸溶解法测量胶原含量[6]。利用GAG试剂盒测量GAG含量,按照说明书上步骤来提取GAG,酶标仪测量525 nm处的吸光度[7],计算GAG含量。
1.7 输尿管脱细胞基质扫描电镜观察分别用扫描电镜观察输尿管脱细胞基质的管腔面和管壁面。将输尿管脱细胞基质从管腔中间剪开,展开成片状。用2.5%戊二醛室温固定后入梯度酒精脱水,CO2干燥箱干燥样本,喷金后扫描电镜观察[8]。
1.8 膀胱平滑肌细胞分离鉴定膀胱组织去除黏膜和黏膜下层,将平滑肌层剪碎并用Ⅳ型胶原酶和Dispase酶在37 ℃消化30 min,离心,重悬接种到培养皿上培养[9]。取第3代的平滑肌细胞做细胞爬片,平滑肌特异性蛋白α-SMA作为一抗,进行荧光染色并观察。
1.9 输尿管脱细胞基质的毒性检测将制备的输尿管脱细胞基质浸泡在H-DMEM培养基中72 h制备浸提液[10]。第3代犬膀胱平滑肌细胞接种在24孔板上,种植密度为每孔2×104细胞。用H-DMEM培养基培养24 h后改换浸提液作为培养基进行培养,同时将细胞培养在H-DMEM上作为对照组。分别在1,3,7 d用AO/PI染色观察细胞凋亡情况。在1,3,5,7 d进行MTT实验,观察细胞的增殖情况。
1.10 统计学处理所有数据结果均用SPSS 17.0进行分析处理,数据以均数±标准差表示。胶原和GAG含量各组之间的差异情况采用Mann-whitney U检验统计分析。检验水准: α=0.05,P < 0.05认为差异有统计学意义。
2 结果 2.1 输尿管脱细胞基质的大体形态观察脱细胞过程中输尿管组织从最初的红色逐渐变为白色(图 1C,D)。
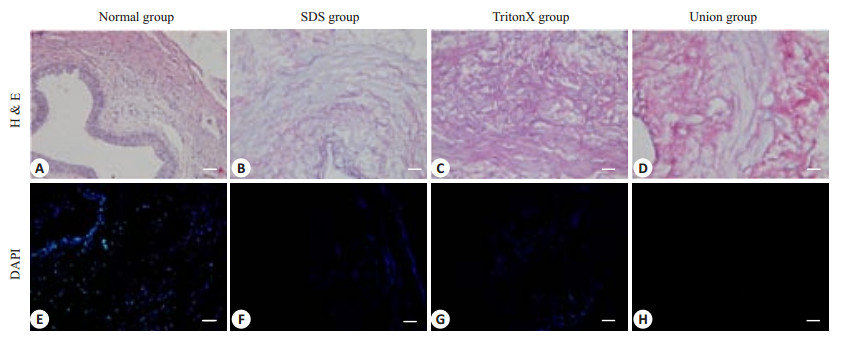
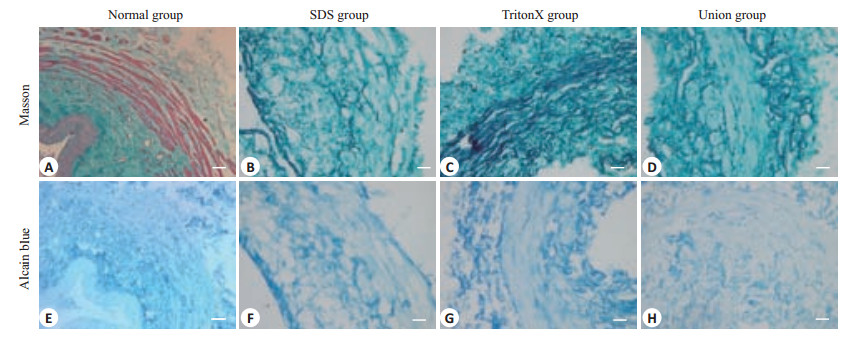
2.2 输尿管脱细胞基质组织学检测HE染色显示SDS组和TritonX-100组制备的输尿管脱细胞基质有核样物质的残留,联合组中没有观察到核样物质的残留(图 2A~D)。DAPI染色进一步证实了HE染色结果(图 2E~H)。Masson's 3色染色显示3组胶原结构均保存良好(图 3A~D)。Alcian Bluer染色显示3组中均保留有GAG(图 3E~H)
|
图 2 输尿管以及3组不同灌注方案制备输尿管脱细胞基质的HE和DAPI染色 Figure 2 HE staining (A-D) and DAPI staining (E-H) of the ureter and the UAM prepared by three different perfusion protocols. Scale bar=100 μm. |
|
图 3 输尿管以及3组不同灌注方案制备输尿管脱细胞基质Masson's 3色和Alcian Blue染色 Figure 3 Masson's trichrome staining (A-D) and Alcian Blue staining (E-H) of the ureter and the UAM prepared by three different perfusion protocos. Scale bar=100 μm. |
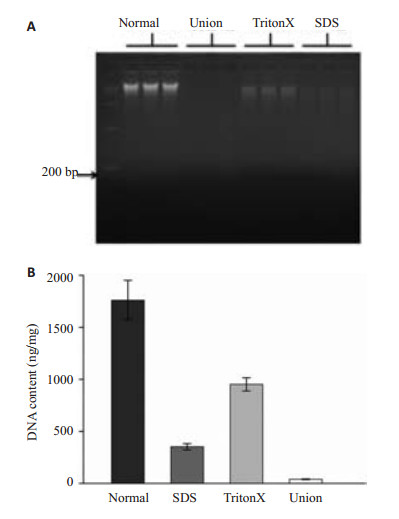
对比正常组输尿管(1760.8±190.1 ng/mg),联合组(40.3±3.5 ng/mg)中核样物质基本被清除,而另外两组中则残留较多的核样物质(SDS组352.5±30.7 ng/mg;Triton-100组951.7±63.4 ng/mg)(图 4B)。2%琼脂糖凝胶电泳显示TritonX-10组可以看到明显的条带,SDS组中可看到条带但不明显,联合组中则完全看不到条带(图 4A)。
|
图 4 DNA琼脂糖凝胶电泳以及DNA定量 Figure 4 Agarose gel electrophoresis and DNA quantification. DNA agarose gel electrophoresis showed no visible DNA bands in the combined group (A). DNA quantification also confirmed that the cellular material was effectively removed in the combined group (B). |
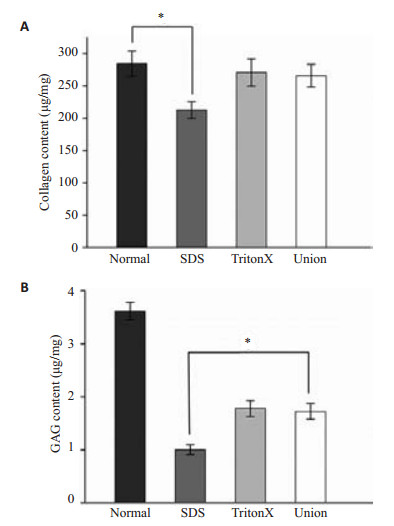
胶原含量测定显示SDS组(212.73±12.97 μg/mg)胶原含量较正常组输尿管(284.47±19.60 μg/mg)含量降低,且有统计学差异。联合组(265.89±17.74 μg/mg)和TritonX-100组(270.86±21.36 μg/mg)胶原含量较正常组输尿管无明显差别(图 5A)。GAG定量检测显示3组GAG含量较正常组输尿管(3.613±0.165 μg/mg)均降低且有统计学差异,TritonX-100组(1.780±0.150 μg/mg)和联合组(1.726±0.148 μg/mg)之间无统计学差异,SDS组(1.001±0.091 μg/mg)GAG含量相比联合组明显下降,且有统计学差异(图 5B)。
|
图 5 胶原和GAG定量分析 Figure 5 Collagen and GAG quantitative analysis. Collagen quantification showed no significant difference between the normal group and the combined group (A). GAG assay showed a lower GAG content in SDS group than in the combined group (B). *P < 0.05. |
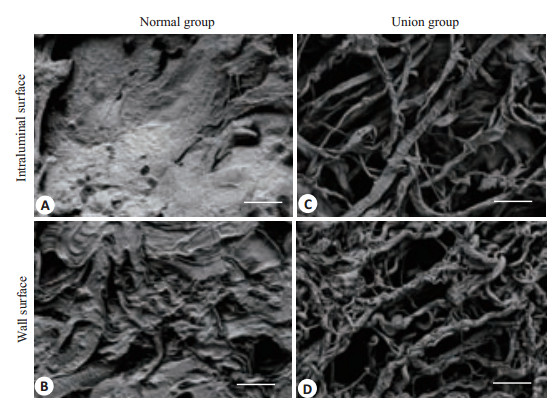
联合组制备的输尿管脱细胞基质电镜照片显示管腔面和管壁面的胶原纤维构成三维网络结构且包含有大量的孔隙。而输尿管本身的管腔面和管壁面结构致密无孔隙结构存在(图 6A~D)。
|
图 6 输尿管和联合组制备输尿管脱细胞基质的扫面电镜观察 Figure 6 SEM images of the ureter and UAM prepared by combined perfusion. A, C: Intraluminal surface; B, D: Tube wall surface. Scale bar=20 μm. |
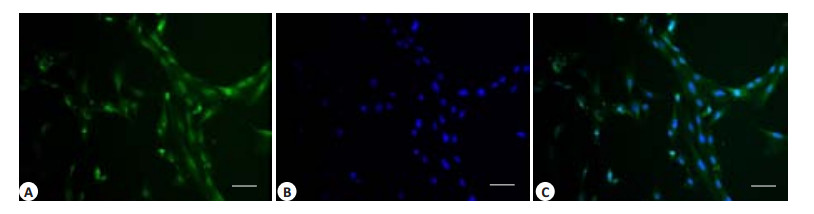
α-SMA蛋白为平滑肌细胞特异性蛋白。免疫荧光染色显示分离的细胞特异性的表达α-SMA蛋白(图 7A,B),结合分离的部位确定所分离的细胞为平滑肌细胞。
|
图 7 平滑肌细胞荧光染色 Figure 7 Fluorescent staining of smooth muscle cells. The smooth muscle protein was stained green (A) and the nuclei were stained blue (B). Scale bar=100 μm; C: Merge. |
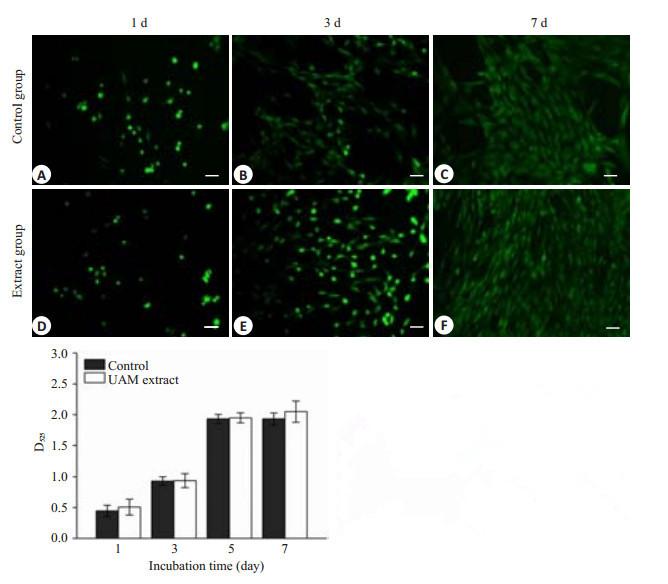
AO/PI染色结果显示细胞在浸提液组中生长良好,未出现明显的凋亡。MTT实验证实细胞在输尿管浸提液中仍保留增殖能力(图 8)。结果表明输尿管脱细胞基质无化学洗涤剂残留,无毒性。
|
图 8 联合组制备输尿管脱细胞基质的毒性检测` Figure 8 Toxicity assay of the UAM prepared by combined perfusion. AO/PI staining showed that the cells could grow in H-DMEM medium supplemented with the extracts of UAM. The viable cells emitted green fluorescence. Scale bar=100 μm. MTT assay showed that the cells maintained proliferative ability. |
近年来,随着内镜技术在临床中的广泛应用,输尿管损伤的发生机率逐年升高。传统的手术治疗效果往往不甚理想。组织工程技术为输尿管的修复重建带来了新的思路。随着组织工程技术的发展,天然组织的细胞外基质(ECM)因起所具有的独特优势受到了越来越广泛的关注。ECM的成分和组成非常独特,在不同的组织器官中细胞外基质的构成也不尽相同,但其共同特点是利于组织器官特异性细胞的生长,且能维持组织或器官的正常功能[11]。
输尿管细胞外基质的常规制备方法[4, 12-13]是利用持续搅拌的物理方法结合化学洗涤剂进行,其缺点是制备过程需要花费几天甚至一周的时间,且长时间的搅拌和洗涤剂持续作用会对输尿管组织结构造成严重破坏,并会导致细胞外基质的生物活性成分的丢失。本研究采用灌注系统来制备输尿管脱细胞基质,使输尿管脱细胞时间大为缩短,且避免了长时间的物理搅拌对输尿管结构和生物活性成分的破坏。灌注系统是利用组织或器官本身的脉管或管腔结构来推动脱细胞液流过整个的组织或器官,在这一过程中带走细胞核成分,同时维持结构的完整性。灌注系统已广泛应用于组织器官脱细胞基质的制备,例如心脏[14]、肺脏[15]、肝脏[16]及肾脏[17],且取得了很好的脱细胞效果。本研究利用输尿管本身存在的管腔结构,将输尿管连接到灌注系统进行脱细胞基质的制备,脱细胞过程完全符合输尿管本身的生理功能。
Crapo等[18]曾指出任何一种细胞成分清除剂和方法都会改变细胞外基质的成分并会造成不同程度的微观结构破坏,我们应当最小程度的降低这些破坏而不是避免。研究过程中我们先将输尿管快速冷冻,这一过程会使细胞内形成冰晶损坏细胞膜使细胞碎裂,但不影响组织结构,同时利于洗涤剂的渗透[19]。Gilbert等[20]研究报道了非离子型洗涤剂TritonX-100作用温和对组织结构损伤小,且对较厚的组织有较强的细胞清除能力。而离子型洗涤剂SDS对细胞成分的清除能力很强,但会对组织结构造成严重破坏并能清除生长因子[18]。实验过程中我们结合两种洗涤剂的不同特性,首先使用作用温和的TritonX-100持续作用于输尿管组织,这一过程中厚而致密的输尿管组织逐渐变得疏松,更加有利于洗涤剂的渗透。后换用脱细胞能力强的SDS,短时间作用于输尿管组织达到完全的脱细胞效果,同时最小程度地破坏输尿管组织的微观结构和生物活性成分。
用于输尿管修复重建的脱细胞基质应该具备两个基本特征[21]:(1)引起免疫反应的细胞核成分被清除,(2)本身的三维结构和生物活性成分得到很好地保留。我们对制备的输尿管脱细胞基质进行了详细的评价。HE染色和DAPI染色结果证实联合组制备的输尿管脱细胞基质细胞核成分几乎被完全移除,且清除效率明显优于另外两组,DNA定量检测和琼脂糖凝胶电泳进一步佐证了这一结果。在三维结构和生物活性成分的保留上,胶原含量测定显示联合组制备的输尿管脱细胞基质与正常组输尿管中胶原含量无差别,而SDS组胶原含量明显降低,表明长时间的SDS作用会导致胶原结构的损伤。GAG定量检测显示联合组制备的输尿管脱细胞基质GAG含量仅为正常输尿管的一半,其减少程度在统计学上有差异,考虑是因为GAG对洗涤剂的高度敏感,导致GAG在脱细胞过程中损失[22]。扫描电镜证实联合组制备的输尿管脱细胞基质表面存在大量的孔隙结构,利于细胞的植入和渗透,而毒性实验也表明制备的输尿管脱细胞基质没有毒性。这些结果证实联合组制备的输尿管脱细胞基质可以用于输尿管修复重建实验研究。
综上所述,本研究证实灌注系统适用于输尿管脱细胞基质的制备,且耗时较短。筛选出一套较为理想的输尿管脱细胞方案,制备的输尿管脱细胞基质细胞核成分几乎被完全清除,三维结构和生物活性成分很好地被保留。输尿管脱细胞基质可以进一步用于输尿管修复重建研究。
| [1] |
Kloskowski T, Kowalczyk T, Nowacki M, et al. Tissue engineering and ureter regeneration:is it possible[J].
Int J Artif Organs,2013, 36 (6) : 392-405.
( 0) 0)
|
| [2] |
Elliott SP, Mcaninch JW. Ureteral injuries:external and iatrogenic[J].
Urol Clin North Am,2006, 33 (1) : 55-66.
DOI: 10.1016/j.ucl.2005.11.005. ( 0) 0)
|
| [3] |
Simaioforidis V, De Jonge P, Sloff M, et al. Ureteral tissue engineering:where are we and how to proceed[J].
Tissue Eng Part B Rev,2013, 19 (5) : 413-9.
DOI: 10.1089/ten.teb.2012.0737. ( 0) 0)
|
| [4] |
Koch H, Hammer N, Ossmann S, et al. Tissue engineering of ureteral grafts:preparation of biocompatible crosslinked ureteral scaffolds of porcine origin[J].
Front Bioeng Biotechnol.,2015, 3 : 89.
( 0) 0)
|
| [5] |
Struecker B, Hillebrandt KH, Voitl R, et al. Porcine liver decellularization under oscillating pressure conditions:a technical refinement to improve the homogeneity of the decellularization process[J].
Tissue Eng Part C Methods,2015, 21 (3) : 303-13.
DOI: 10.1089/ten.tec.2014.0321. ( 0) 0)
|
| [6] |
Bolland F, Korossis S, Wilshaw SP, et al. Development and characterisation of a full-thickness acellular porcine bladder matrix for tissue engineering[J].
Biomaterials,2007, 28 (6) : 1061-70.
DOI: 10.1016/j.biomaterials.2006.10.005. ( 0) 0)
|
| [7] |
Dequach JA, Mezzano V, Miglani A, et al. Simple and high yielding method for preparing tissue specific extracellular matrix coatings for cell culture[J].
PLoS One,2010, 5 (9) : e13039.
DOI: 10.1371/journal.pone.0013039. ( 0) 0)
|
| [8] |
Singelyn JM, Dequach JA, Seif-Naraghi SB, et al. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering[J].
Biomaterials,2009, 30 (29) : 5409-16.
DOI: 10.1016/j.biomaterials.2009.06.045. ( 0) 0)
|
| [9] |
Liu Y, Bharadwaj S, Lee SJ, et al. Optimization of a natural collagen scaffold to aid cell-matrix penetration for urologic tissue engineering[J].
Biomaterials,2009, 30 (23/24) : 3865-73.
( 0) 0)
|
| [10] |
Chan LK, Leung VY, Tam V, et al. Decellularized bovine intervertebral disc as a natural scaffold for xenogenic cell studies[J].
Acta Biomater,2013, 9 (2) : 5262-72.
DOI: 10.1016/j.actbio.2012.09.005. ( 0) 0)
|
| [11] |
Guyette JP, Gilpin SE, Charest JM, et al. Perfusion decellularization of whole organs[J].
Nat Protoc,2014, 9 (6) : 1451-68.
DOI: 10.1038/nprot.2014.097. ( 0) 0)
|
| [12] |
Narita Y, Kagami H, Matsunuma H, et al. Decellularized ureter for tissue-engineered small-caliber vascular graft[J].
J Artif Organs,2008, 11 (2) : 91-9.
DOI: 10.1007/s10047-008-0407-6. ( 0) 0)
|
| [13] |
Derham C, Yow H, Ingram J, et al. Tissue engineering smalldiameter vascular grafts:preparation of a biocompatible porcine ureteric scaffold[J].
Tissue Eng Part A,2008, 14 (11) : 1871-82.
DOI: 10.1089/ten.tea.2007.0103. ( 0) 0)
|
| [14] |
Ott HC, Matthiesen TS, Goh SK, et al. Perfusion-decellularized matrix:using Nature's platform to engineer a bioartificial heart[J].
Nat Med,2008, 14 (2) : 213-21.
DOI: 10.1038/nm1684. ( 0) 0)
|
| [15] |
Petersen TH, Calle EA, Zhao L, et al. Tissue-engineered lungs for in vivo implantation[J].
Science,2010, 329 (5991) : 538-41.
DOI: 10.1126/science.1189345. ( 0) 0)
|
| [16] |
Uygun BE, Soto-Gutierrez A, Yagi H, et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix[J].
Nat Med,2010, 16 (7) : 814-20.
DOI: 10.1038/nm.2170. ( 0) 0)
|
| [17] |
Orlando G, Farney AC, Iskandar SS, et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations[J].
Ann Surg,2012, 256 (2) : 363-70.
DOI: 10.1097/SLA.0b013e31825a02ab. ( 0) 0)
|
| [18] |
Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization processes[J].
Biomaterials,2011, 32 (12) : 3233-43.
DOI: 10.1016/j.biomaterials.2011.01.057. ( 0) 0)
|
| [19] |
Gilbert TW. Strategies for tissue and organ decellularization[J].
J Cell Biochem,2012, 113 (7) : 2217-22.
DOI: 10.1002/jcb.v113.7. ( 0) 0)
|
| [20] |
Gilbert TW, Sellaro TL, Badylak SF. Decellularization of tissues and organs[J].
Biomaterials,2006, 27 (19) : 3675-83.
( 0) 0)
|
| [21] |
Badylak SF, Taylor D, Uygun K. Whole-organ tissue engineering:decellularization and recellularization of three-dimensional matrix scaffolds[J].
Annu Rev Biomed Eng,2011, 13 : 27-53.
DOI: 10.1146/annurev-bioeng-071910-124743. ( 0) 0)
|
| [22] |
Chen K, Lin X, Zhang Q, et al. Decellularized periosteum as a potential biologic scaffold for bone tissue engineering[J].
Acta Biomater,2015, 19 : 46-55.
DOI: 10.1016/j.actbio.2015.02.020. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
