胰岛素瘤是胰腺神经内分泌肿瘤中最常见的类型,大多数为良性,恶性不到10% [1-2]。恶性胰岛素瘤少见且预后很差。临床上无法依据胰岛素瘤细胞的形态学来判断其良恶性质,目前亦无可靠临床指标及分子标记物以用于区分良、恶性胰岛素瘤[3]。核转录因子YY1是近年来新发现的胰岛素瘤致病基因[4],免疫组化法检测证实,胰岛素瘤细胞中YY1呈细胞核阳性表达。然后YY1在良、恶性胰岛素瘤组织中的表达情况未见相关报道。YY1蛋白高表达是否亦可被视为胰岛素瘤的恶性程度标志?故本文旨在探讨YY1在良、恶性胰岛素瘤组织中的表达情况及意义,以期为临床发现可用于区分胰岛素瘤良恶性质的可靠分子标记物。
1 资料和方法 1.1 资料 1.1.1 标本收集2000~2014年南方医院19例胰腺神经内分泌肿瘤组织蜡块,其中胰岛素瘤4例,胰岛素瘤肝转移2例,胰岛细胞瘤4例,胰腺内分泌瘤2例子,胰腺神经内分泌癌7例。患者年龄在22~75岁之间,患者中位年龄为41岁,所有患者均为散发性发病且术前均未接受放化疗治疗。全部病例均经病理科医生诊断证实。采用免疫组织二步法进行检测。
1.1.2 主要试剂Anti-Yy1 rabbit antibody(ab109237): abcam公司;羊抗兔标记IgG二抗:中杉金桥公司;PH6.0柠檬酸盐修复液:武汉博士得试剂公司;磷酸盐缓冲液(1Xpbs):武汉博士得试剂公司;二抗鼠/兔通用试剂盒、DAB显色液:中杉金桥公司。
1.2 方法采用免疫组化法检测YY1在19例胰岛素瘤组织中的表达情况。免疫组化染色按照SP试剂盒操作说明书进行操作,PBS取代一抗作为阴性对照。60 ℃烤片2 h常规脱蜡,3%过氧化氢阻断内源性过氧化物酶,山羊血清封闭30 min,1:500稀释的YY1兔抗人抗体4 ℃孵育过夜,PBS洗涤3次,滴加鼠抗兔二抗37 ℃孵育30 min,PBS洗涤3次,DAB显色。
1.3 免疫组化结果判读采用双盲法在高倍镜(×400)下随机选择10个视野分析,每个视野至少计数100个细胞,取其平均值。根据细胞质或核着色情况对染色强度进行半定量分级,即:未着色为0分;浅黄色为1分;棕色为2分;深棕色为3分。根据阳性细胞的百分率分为5级:阳性细胞数占10%为0分,阳性细胞数10%~25%为1分,阳性细胞数26%~50%为2分,阳性细胞数51%~75%为3分,阳性细胞数75%为4分。每一病例的染色强度与阳性细胞数乘积为0分者为(-),即不表达;1~3分为(+),为低表达;4~8分为(++),为中度表达;9~12分为(+++),为强表达。0分为表达阴性(-);1~12分为表达阳性(+)。
1.4 胰岛素瘤分组分组标准:器官和/或淋巴结出现浸润或者远处转移[2]及镜下肿瘤内有神经、血管、包膜侵犯[5]。依据上述标准将19例胰腺内分泌肿瘤分为良性和恶性胰岛素瘤两组,其中良性组有6例,恶性组有13例。
1.5 统计学分析采用Spss 13.0统计软件包进行处理,两组比较采用两独立样本的秩和检验,相关性分析采用Spearman等级相关性检验,选取检验水准为α=0.05,P < 0.05差异有统计学意义。
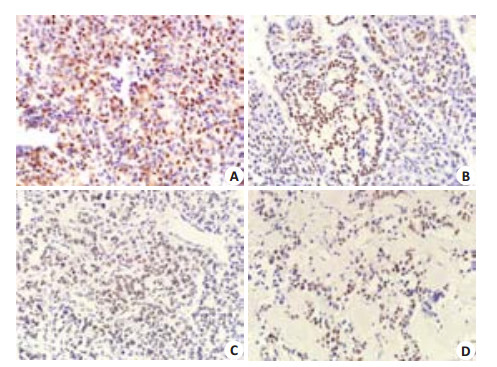
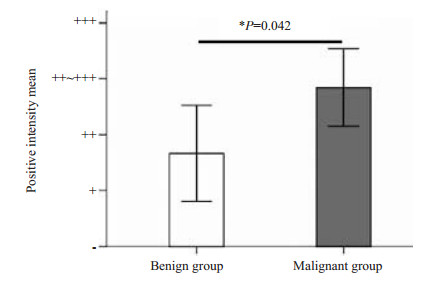
2 结果免疫组化法检测结果示,YY1在良恶性胰岛素瘤中都有表达,YY1在肿瘤组织中的阳性着色主要位于细胞核,呈弥漫性分布(图 1)。统计结果显示: YY1在良性胰岛素瘤的表达呈“+~++”,在恶性胰岛素瘤的表达呈“+~+++”;两组比较发现,YY1在恶性胰岛素瘤组织中的表达强度与良性胰岛素瘤组织中的表达强度有显著性差异(P=0.042),恶性胰岛素瘤组织中YY1表达强度高于良性胰岛素瘤组织(表 1,图 2)。Spearman等级相关性检验分析结果显示: YY1表达强度与胰岛素瘤的良恶性质存在正相关关系(r=0.480,P=0.037,表 1),YY1表达强度高的胰岛素瘤更具恶性潜能。
|
图 1 YY1在胰岛素瘤组织中的表达 Figure 1 Expression of YY1 protein in human insulinomas. A: Benign insulinoma; B: Malignant insulinoma; C: Benign islet cell tumor; D: Malignant islet cell tumor. |
|
图 2 比较YY1蛋白在良性组和恶性组中的表达强度 Figure 2 Comparison of expression intensity of YY1 protein in benign and malignant groups. |
| 表 1 YY1在良性胰岛素瘤与恶性胰岛素瘤组中的表达情况 Table 1 Expression of YY1 in benign and malignant insulinomas |
胰腺神经内分泌肿瘤(pancreatic endocrine tumors, PNETs),又称为胰岛细胞瘤,是源于胰腺多功能神经内分泌干细胞的一类肿瘤[6],胚胎来源为胰岛(amine precursor uptake and decarboxylation, APUD)细胞[7-10]。PNETs发病率仅为0.8~0.9/100万[11],近几年来呈上升趋势。PNETs生长缓慢,但均具有恶性潜能[12-13],容易发生远处转移。约90%以上的PNETs为散发,除家族性多发内分泌腺瘤Ⅰ型和林岛综合征外,散发性PNETs的分子学机制尚未明确[14]。胰岛素瘤是最常见的PNETs,每100万人中约1~4人发病[15]。大多数的胰岛素瘤为良性,恶性虽然不到10% [1-2],但是预后很差。恶性胰岛素瘤的诊断标准是器官和/或淋巴结出现浸润或者远处转移[2]及镜下肿瘤内有神经、血管、包膜侵犯[5]。WHO介绍胰岛细胞瘤主要表现为4种结构:实体性、小梁状、腺样以及混合型。而肿瘤细胞常表现为温和的细胞形态,少见大核及多形核细胞。瘤细胞与毛细血管关系密切[16]。
转录因子Yin-Yang1(YY1,又称NF-E1、δ因子、UCRBP、CF1,小鼠为Yy1)基因定位于14号染色体q32区,编码一段414个氨基酸蛋白,相对分子质量为65000。YYl是锌指类转录因子,与该转录因子之名--“YIN-YANG”相一致的是,YY1既有阻抑转录的作用(阴的一面),又有激活转录的作用(阳的一面),即YY1是一种具有双重转录活性的核转录因子,YY1所招募的共同作用因子可以影响YY1的激活与抑制功能。YY1广泛分布于真核细胞中,调节多种基因的转录活性,参与细胞周期调控、分化、凋亡以及肿瘤形成等多种生物学进程[17]。YY1在C-末端(aa298-397)含有4个C2H2型锌指结构,为DNA结合结构域,该结构域具有转录抑制功能;在靠近N-末端(aa43-53)有一个酸性区域,此区域是典型的激活因子结构域,紧接着是连续11个(aa70— 80)组氨酸序列,至今功能不明;在第154~201氨基酸之间富含甘氨酸和丙氨酸,可能与阻遏作用有关。YYl可通过识别共有序列CGCCATNTI"结合DNA[18]。越来越多的证据表明YY1在肿瘤的发生发展中扮演重要角色。目前有大量文献报道YY1在大部分肿瘤中的基因转录水平比正常组织中显著提高,包括前列腺癌、结肠癌、卵巢癌、宫颈癌、乳腺癌、腺癌、膀胱癌、睾丸精原细胞瘤、急性髓细胞白血病、何杰金淋巴瘤、非何杰金淋巴瘤、肌肉瘤等,YY1在大部分肿瘤中具有促进肿瘤细胞增殖、分化和转移的作用,揭示了YY1在肿瘤发展中的重要作用[19-20]。YY1蛋白高表达被视为前列腺癌和宫颈癌等肿瘤的恶性程度标志,YY1可能成为一种潜在的肿瘤诊断和预诊的标志性基因[21]。核转录因子YY1是近年来新发现的胰岛素瘤致病基因[4],研究者对113位胰岛细胞瘤患者进行了肿瘤二代测序,对10对胰岛细胞瘤DNA样本(肿瘤DNA和匹配的外周血DNA对照)进行了全部外显子测序后发现了重复出现的YY1基因c.C1115G/p.T372R位点突变。定量PCR检测显示没有突变的野生型和突变型YY1基因均在肿瘤中高表达(无显著性差异),体外实验观察发现T372R突变的YY1可显著促进胰岛细胞瘤细胞系MIN6增殖。免疫组化法检测证实,胰岛素瘤细胞中YY1呈细胞核阳性表达。然后YY1在良、恶性胰岛素瘤组织中的表达情况未见相关报道。
本次研究使用免疫组织化学检测了19例经病理科诊断为胰腺神经内分泌肿瘤组织中YY1的表达情况。结果发现,胰岛素瘤组织细胞中的YY1主要于核内表达(与文献一致),符合其转录调控活性。恶性胰岛素瘤与良性胰岛素瘤中YY1的表达强度是有显著差异的(P=0.042),恶性胰岛素瘤组织中的YY1表达强度高于良性胰岛素瘤组织。Spearman等级相关性检验分析结果显示: YY1表达强度与胰岛素瘤良恶性质存在正相关关系(r=0.480,P=0.037,表 1),YY1表达强度高的胰岛素瘤更具恶性潜能。通过本实验初步观察到YY1的高表达强度可能是胰岛素瘤发生发展中的重要事件,在胰岛素瘤发生和发展过程中可能具有重要作用,但其具体机制还不清楚。De Nigris等[22]通过阻断趋化因子SDF1及其受体CXCR4形成的SDF-1/CXCR4途径,发现YY1表达下降,同时骨肉瘤细胞侵袭性下降;再通过沉默YY1,发现MMP的表达,如MMP-2 mRNA的表达下降,同时血管内皮生长因子(VEGFA)蛋白的表达量亦下调;实验还发现在YY1缺失后,转移瘤生长也显著减慢。此外,YY1还可以与金属基质蛋白酶-2相互作用,促进上皮间质转换。目前报道YY1参与肿瘤细胞的侵袭和转移主要机制是直接调控上皮间质转化(EMT)。大量文献报道EMT的过程是由众多信号通路和细胞因子参与的,如MAPK通路、Wnt通路、NF-κB通路、TGF-B、SNAI1、SNAI2等,这些信号通路和细胞因子之间存在相关性。EMT过程起始伴随着NF-κB通路的异常激活,NF-κB进而通过Snail/YY1/PTEN/RKIP进一步增强Raf-1/MEK/ERK和NF-κB通路,增强细胞的增殖,并促使细胞黏附能力下降[23]。研究发现[24] YY1是EMT新的预后生物指标,或许可作为潜在的防止肿瘤转移的靶向治疗的目的基因。YY1可以通过直接结合在血管发生和癌细胞增殖抑制相关靶基因的启动子区,调控靶基因的表达,从而参与肿瘤生长;YY1亦可以通过调控侵袭迁移相关靶基因的转录水平参与肿瘤的侵袭转移。YY1是否有望成为检测胰岛素瘤恶性转化的新肿瘤标志物?YY1在胰岛素瘤中的功能作用值得进一步研究。
| [1] |
Oberg K. Pancreatic endocrine tumors[J].
Semin Oncol,2010, 37 : 594-618.
DOI: 10.1053/j.seminoncol.2010.10.014. ( 0) 0)
|
| [2] |
成兰云, 许世清, 张文健, 等. 胰岛素瘤的研究进展[J].
中国医药生物技术,2013, 8 (4) : 285-8.
( 0) 0)
|
| [3] |
Jonkers Y, Ramaekers F, Speel E. Molecular alterations during insulinoma tumorigenesis[J].
BBA-Rev Cancer,2007, 1775 (2) : 313-32.
( 0) 0)
|
| [4] |
Cao YA, Gao ZB, Li L, et al. Whole exome sequencing of insulinoma reveals recurrent T372R mutations in YY1[J].
Nat Commun,2013, 4 : 2810.
( 0) 0)
|
| [5] |
Varas M, Gornals J, Prieto JL, et al. Diagnostic protocol for pancreatic neuroendocrine tumors (PNETs)[J].
Rev Esp Enferm Dig,2012, 104 (1) : 29-32.
DOI: 10.4321/S1130-01082012000100006. ( 0) 0)
|
| [6] |
付志方, 焦红梅, 王艳君, 等. 胰腺神经内分泌肿瘤的临床观察与分析[J].
中国现代医学杂志,2015, 25 (3) : 71-4.
( 0) 0)
|
| [7] |
黄颖秋. 胰腺内分泌肿瘤的研究进展[J].
世界华人消化杂志,2011, 19 (15) : 1541-9.
( 0) 0)
|
| [8] |
陈原稼, 梅玫. 胰腺内分泌肿瘤临床、分子生物学和遗传学预后指标[J].
胰腺病学,2004, 4 (3) : 182-6.
( 0) 0)
|
| [9] |
Capurso G, Festa S, Valente R, et al. Molecular pathology and genetics of pancreatic endocrine tumours[J].
J Mol Endocrinol,2012, 49 (1) .
( 0) 0)
|
| [10] |
Zhang J, Francois R, Iyer R, et al. Current understanding of the molecular biology of pancreatic neuroendocrine tumors[J].
J Natl Cancer Inst,2013, 105 (14) : 1005-17.
DOI: 10.1093/jnci/djt135. ( 0) 0)
|
| [11] |
Dolan JP, Norton JA. Occult insulinoma[J].
Br J Surg,2000, 87 (4) : 385-7.
DOI: 10.1046/j.1365-2168.2000.01387.x. ( 0) 0)
|
| [12] |
中国胃肠胰神经内分泌肿瘤病理专家组. 中国胃肠胰神经内分泌肿瘤病理学诊断共识意见[J].
中华病理学杂志,2011, 40 (4) : 257-62.
( 0) 0)
|
| [13] |
Tao M, Yuan C, Xiu D, et al. Analysis of risk factors affecting the prognosis of pancreatic neuroendocrine tumors[J].
Chin Med J,2014, 127 (16) : 2924-8.
( 0) 0)
|
| [14] |
高鹤丽, 白春梅. 散发性胰腺神经内分泌瘤的分子学研究进展[J].
癌症进展,2015, 13 (3) : 280-5.
( 0) 0)
|
| [15] |
Okabayashi T, Shima Y, Sumiyoshi T, et al. Diagnosis and management of insulinoma[J].
World J Gastroenterol,2013, 19 (6) : 829-37.
DOI: 10.3748/wjg.v19.i6.829. ( 0) 0)
|
| [16] |
Ronald AD, Ricardo VL, Uh PH.
World Health Organization classification of tumours:pathology and genetics of tumours of endocrine orgas[M]. New York: oxford university press, 2008 : 204 -9.
( 0) 0)
|
| [17] |
Chen QR, Yu LR, Tsang P, et al. Systematic proteome analysis identifies transcription factor YY1 as a direct target of miR-34a[J].
J Proteome Res,2011, 10 (2) : 479-87.
DOI: 10.1021/pr1006697. ( 0) 0)
|
| [18] |
Yant SR, Zhu W, Millinoff D, et al. High affinity YY1 binding motifs:identification of two core types (ACAT and CCAT) and distribution of potential binding sites within the human beta globin cluster[J].
Nucleic Acids Res,1995, 23 (21) : 4353-62.
DOI: 10.1093/nar/23.21.4353. ( 0) 0)
|
| [19] |
Castellano G, Torrisi E, Ligresti GA, et al. The involvement of the transcription factor Yin Yang 1 in cancer development and progression[J].
Cell Cycle,2009, 8 (9) : 1367-72.
DOI: 10.4161/cc.8.9.8314. ( 0) 0)
|
| [20] |
Rizkallah R, Alexander KE, Kassardjian AA, et al. The transcription factor YY1 is a substrate for Polo-Like kinase 1 at the G2/M transition of the cell cycle[J].
PLoS One,2011, 6 (1) : e15928.
DOI: 10.1371/journal.pone.0015928. ( 0) 0)
|
| [21] |
Chinnappan D, Xiao D, Ratnasari A, et al. Transcription factor YY1 expression in human gastrointestinal cancer cells[J].
Int J Oncol,2009, 34 (5) : 1417-23.
( 0) 0)
|
| [22] |
De Nigris F, Rossiello R, Schiano C, et al. Deletion of yin yang 1 protein in osteosarcoma cells on cell invasion and CXCR4/angiogenesis and metastasis[J].
Cancer Res,2008, 68 (6) : 1797-808.
DOI: 10.1158/0008-5472.CAN-07-5582. ( 0) 0)
|
| [23] |
Bonavida B, Baritaki S. The novel role of Yin Yang 1 in the regulation of epithelial to mesenchymal transition in cancer via the dysregulated NF-κB/Snail/YY1/RKIP/PTEN Circuitry[J].
Crit Rev Oncog,2011, 16 (3/4) : 211-26.
( 0) 0)
|
| [24] |
Hirose K, Kawahito S, Mita N, et al. Usefulness of artificial endocrine pancreas during resection of insulinoma[J].
J Med Invest,2014, 61 (3/4) : 421-5.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
