随着对肿瘤细胞周期及其调控机制的深入研究,逐渐认识到肿瘤是由多基因变化导致细胞周期改变,通过缩短或消除细胞周期的G1期及G2期而实现快速失控性生长的一类疾病。F10基因(GenBank号: AB196290)是本研究团队从葡萄胎与正常早孕绒毛的差异cDNA文库中筛选出的新基因[1]。前期研究发现F10基因可能与细胞增殖和凋亡调节相关[2]。F10基因稳定阳性表达的肺癌细胞通过上调增殖核抗原(PCNA)和cyclinD1的表达促进细胞的生长增殖[3]。原位杂交表明F10基因在葡萄胎组织、侵蚀性葡萄胎、绒癌中均阳性表达且依次增强,提示F10基因与滋养细胞肿瘤的发生发展有关。它通过上调侵袭相关蛋白MMP-2、8、11、16、19的表达,下调TIMP-1及PAT-1表达,从而参与调节绒癌细胞的侵袭调节[4]。然而,F10基因是否通过影响细胞周期进程对绒癌细胞的增殖进行调节有待证实。为明确F10基因对绒癌细胞JAR细胞周期的影响,选择建立并筛选的F10基因沉默、稳定过表达绒癌细胞系JAR,以未处理JAR细胞为对照组,比较3组之间的细胞周期及细胞周期蛋白的表达水平差异。
1 材料和方法 1.1 材料JAR细胞株购自中国科学院典型培养保藏委员会细胞库,建立并筛选F10基因沉默及过表达的稳定细胞系,采用添加胎牛血清和青-链霉素的RPMI 1640培养基(Gibco)于CO2培养箱(Thermo Forma Series II)中培养。凯基细胞周期检测试剂盒,BCA蛋白浓度测定试剂盒(Thermo Scientific Inc),SDS×PAGE凝胶制备试剂盒,中相对分子质量Marker,一抗:cyclinA2 (13295-1-AP) 、cyclinB1 (A2056) pAb、cyclinD1 (BS6532) pAb、cyclinE (11554-1-AP) pAb、CDK2 (10122-1-AP)pAb、CDK4(A0366)pAb、CDK6(A3165) pAb、CDK7(11719-1-AP)及HRP标记的二抗(羊抗兔,Bioworld Technology, Inc)。DAP(I BestBio-贝博生物)。
1.2 方法 1.2.1 细胞培养JAR细胞F10基因沉默及过表达的建立与筛选,参见文献[4]。F10基因沉默组、未处理组、F10基因过表达组细胞均用含10%胎牛血清的RPMI 1640培养液,在37 ℃,5%的CO2培养箱中培养。
1.2.2 流式细胞术检测细胞周期选用对数期生长的F10沉默、未处理及F10过表达3组JAR细胞,确保细胞量在1×106个以上,经胰酶消化,800 r/min离心3 min,弃上清,PBS清洗1次,离心去PBS,加入预冷的70%的乙醇,固定24 h,放置4 ℃过夜。次日离心去乙醇,PBS清洗1次,离心去PBS,加100 mL R-Nase A于37 ℃水浴并避光30 min,再加入400 mL PI染色混匀并避光30 min,上机检测。
1.2.3 Western blotting检测选用对数期生长的F10沉默组、未处理组、F10过表达组JAR细胞,弃去全培,预冷PBS清洗3次。根据碧云天全蛋白提取试剂盒说明进行配置裂解液,混匀后每瓶300 mL将裂解液平铺于细胞面,冰上静置30 min,使用刮勺收集细胞蛋白提取液于EP管,14 000 r/min离心15 min,取上清,Bradford法测定蛋白浓度,按样品:上样缓冲液=4:1比例混匀后放置沸水中煮5 min,按30 mg每孔算上样量。配置10%聚丙烯酰胺凝胶,上样,电泳,半干式转膜(PVDF膜),200 mA恒流1 h。封闭液(5%BSA)封闭PVDF膜1 h,一抗4 ℃放置摇床上孵育过夜,次日TBST漂洗10 min×3次,室温下孵育二抗1 h,TBST漂洗10 min×3次,ECL发光液曝光成像。采用Image-J软件分析各蛋白条带灰度值,GAPDH为内参,比较各蛋白条带灰度值与GAPDH的比值。
1.2.4 免疫荧光检测选用对数期生长的F10沉默组、未处理组、F10过表达组JAR细胞,经胰酶消化、台盼蓝染色计数,确保活细胞在97%以上。调整细胞浓度以5×103/mL,接种于24孔培养板中,设3个平行孔,并设PRMI 1640完全培养基调零孔,置培养板于37 ℃,5%的CO2培养箱中培养,接种48小时后吸去全培,PBS清洗3次,4%多聚甲醛固定20 min,2% Triton X-100裂解液裂解10 min。封闭液(1%BSA)封闭1 h,一抗(100 mL /孔)4 ℃孵育过夜,次日PBS清洗3次,避光条件下免疫荧光二抗100 mL/孔室温下孵育1 h,DAPI染核15 min,倒置显微镜下扫描成像。采用IPP软件分析细胞免疫荧光的光密度(IOD)。
1.3 统计学分析数据用SPSS 19.0统计软件储存和分析数据,结果以均数±标准差表示,多组间均数比较采用单因素方差分析,并用LSD法进行两两分析比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 F10基因干预对JAR细胞系细胞周期的影响收集3组对数期生长的JAR绒癌细胞,流式细胞仪检测细胞周期结果显示,F10沉默组、未处理组、F10过表达组的G2/M期细胞依次增多,且沉默组出现凋亡峰,说明3组细胞增殖周期依次加快(表 1)。
| 表 1 流式细胞仪检测3组JAR细胞中各周期细胞数百分比 Table 1 Percentage of JAR cells in each cell cycle phase detected by flow cytometry |
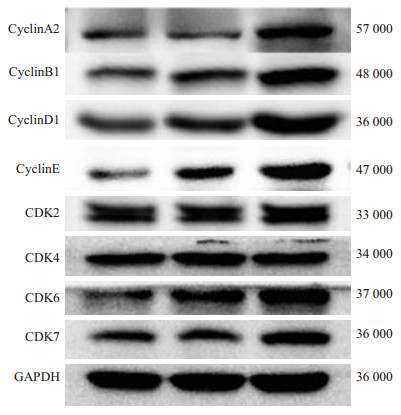
结果显示:与未处理对照组相比,F10过表达组cyclinA2、B1、D1、E和CDK2、6、7蛋白表达水平显著增高(P < 0.001),F10基因沉默组cyclinB1、cyclinD1、cyclinE、CDK6蛋白表达水平显著低于未处理对照组(P < 0.001),3组细胞的CDK4蛋白水平表达无差异(表 2,图 1)。
|
图 1 Western-Blot法检测3组JAR细胞中相关周期蛋 白western-blot电泳图 Figure 1 Expression of cyclin/Cdks in JAR cells detected by Western blotting. A: F10 silenced group; B: Control group; C: F10 over-expression group. |
| 表 2 western blot法检测3组JAR细胞中周期蛋白cyclin/CDKs的表达 Table 2 Expression of cyclin/CDKs in JAR cells detected by Western blotting (Mean±SD) |
结果显示,与未处理对照组比较,F10过表达组cyclinA2、B1、D1、E和CDK2、4、6、7蛋白表达明显增多(P < 0.001),F10基因沉默组cyclinB1、D1、E2及CDK4、6蛋白表达显著低于未处理对照组(P < 0.05,表 3)。
| 表 3 免疫荧光技术检测3组JAR细胞中周期蛋白光密度值(IOD) Table 3 Expression of cyclin/CDKs in JAR cells detected by immunofluoresence (Mean±SD) |
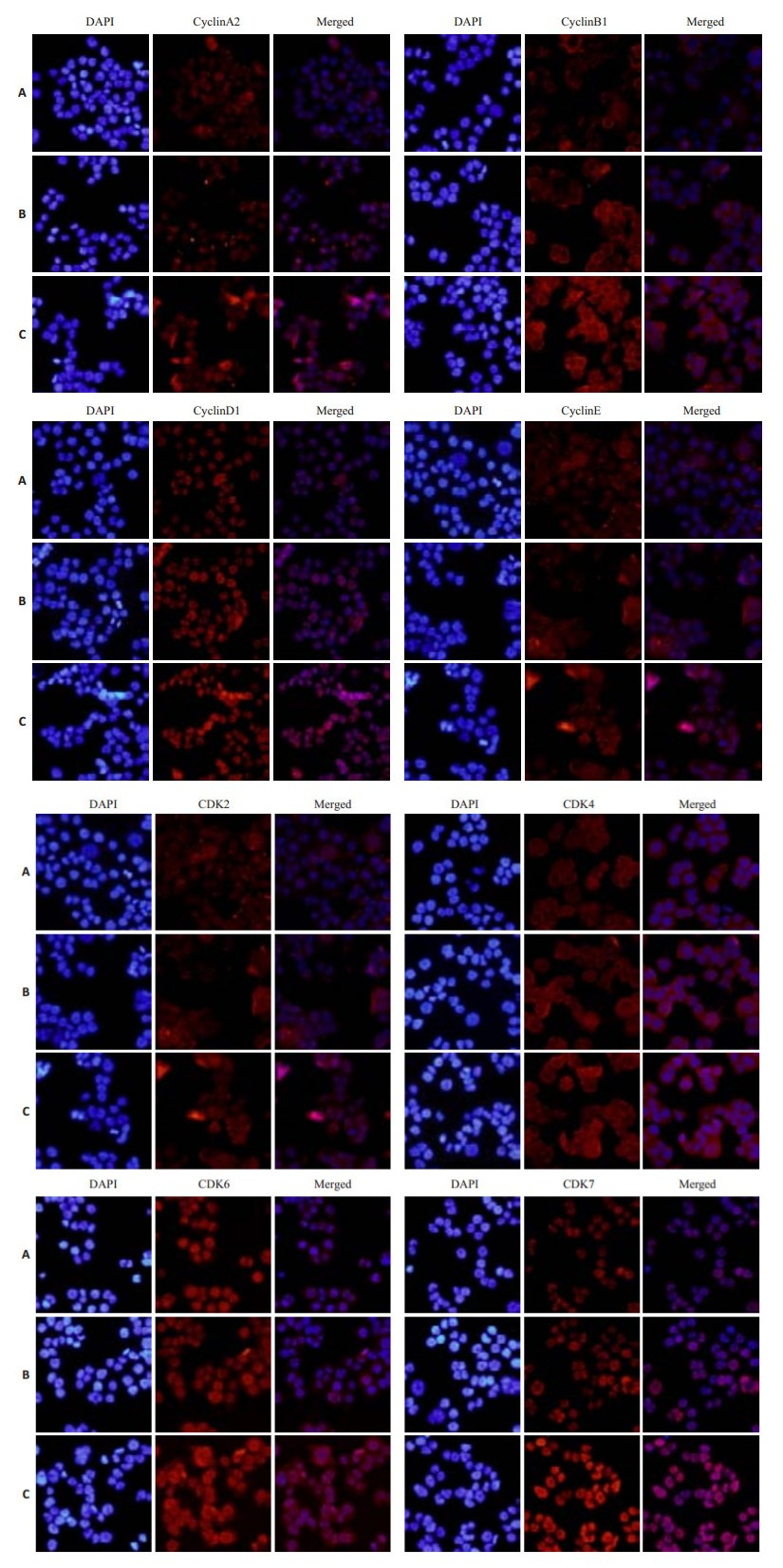
CyclinA2、cyclinD1、CDK7蛋白表达完全在肿瘤细胞核中,cyclinE、CDK2、CDK6蛋白主要表达在细胞核,少量在胞浆,cyclinB1、CDK4蛋白主要定位于胞浆(图 2)。
|
图 2 3组JAR细胞中相关周期蛋白及周期蛋白依赖性激酶CDKs的免疫荧光图 Figure 2 Expression of cyclin/Cdks in JAR cells detected by immunofluoresence assay (Original magnification: × 200). A: F10 silenced group; B: Control group; C: F10 over-expression group. |
肿瘤是多因素、多阶段、多基因变化所致的细胞失控性生长的一类细胞周期性疾病,F10基因是本研究探讨葡萄胎发病机制时发现的功能未知的新基因。前期研究表明,F10基因可能会促进滋养细胞肿瘤的发生,在葡萄胎、侵袭性葡萄胎、绒癌中均阳性表达,且依次增强。在绒癌细胞系JAR中,F10基因通过调节相关侵袭蛋白的表达增强细胞侵袭及转移,并促进细胞增殖[4]。本研究对绒癌细胞系JAR细胞中的F10基因实施干预,建立和筛选出F10沉默组、未处理组及过表达组3组JAR细胞,针对各组细胞分裂周期及细胞周期蛋白、相关依赖性激酶CDKs的表达水平,进一步探讨F10基因对人绒毛膜癌JAR细胞周期及细胞增殖的影响及机制。
细胞周期蛋白(cyclin)与细胞周期蛋白依赖性激酶(CDKs)结合形成的复合物,其周期性的形成和降解,是引发细胞周期进程、促使细胞周期转换的关键点[5],其作为细胞周期调控体系的核心,一旦表达水平改变,将导致细胞周期紊乱,使细胞增殖失控。cyclinD可与CDK4、6结合[6],促使细胞由G0期进入G1期,已证实CyclinD1过度表达使G1期缩短,导致DNA修复障碍及细胞增殖周期加快[7-8],还引起基因组不稳定及部分癌基因扩增[8];而cyclinE可与CDK2结合,启动与DNA复制相关基因的表达,细胞进入S期[8-9],cyclinE与CDK2的过表达能加速其转化,可导致细胞增殖加速[10];cyclinA与CDK2结合,启动DNA复制;而cyclinB与CDK1形成MPF(成熟促进因子),促使细胞进入M期[11],两者表达下调可使细胞停滞于G2/M期[12]。CDK7与cyclinH及MAT1形成三聚体活化CDK,是调控CDK2活化的因子之一,抑制CDK7的活性能够明显导致细胞周期的停滞[13]。
滋养细胞异常增殖与滋养细胞肿瘤的发生密切相关,恶性变的滋养细胞具有更强的增殖能力[14],而滋养细胞病变的一个重要病理机制是周期蛋白的异常表达。已有研究发现葡萄胎恶变者cyclinB1表达显著高于未恶变者[15]。同时在滋养细胞疾病中CyclinD1的表达呈现出明显的趋势性,即绒毛膜癌组最高,侵蚀性葡萄胎组次之,葡萄胎组,正常绒毛组依次减低[16]。本研究采用流式细胞术检测F10基因干预的3组JAR绒癌细胞系的细胞周期,结果显示F10基因沉默组、未处理组、过表达组细胞周期依次加快,通过Western blot及免疫荧光检测3组细胞的周期蛋白表达水平,发现F10过表达组cyclinA2、B1、D1、E和CDK2、6、7蛋白表达水平显著高于F10沉默组及未处理组,提示F10基因可能通过上调与细胞周期关键调控点的正相关调节因子cyclin-CDK复合物的表达水平,加快绒癌细胞的细胞周期进程,增强细胞分裂增殖活动能力,导致滋养细胞增殖失控,有助于绒癌的侵蚀性生长。
| [1] |
李贵堂, 庞战军, 周瑾, 等. 葡萄胎发病相关新基因的克隆[J].
广东医学,2006, 27 (1) : 22-4.
( 0) 0)
|
| [2] |
曹晓敏, 庞战军, 全松, 等. 葡萄胎发病相关新基因F10功能的初步研究[J].
南方医科大学学报,2008 (5) : 722-4.
( 0) 0)
|
| [3] |
曹晓敏, 庞战军, 全松, 等. F10基因对细胞中PCNA和Cyclin D1表达的影响[J].
中山大学学报:医学科学版,2009, 30 (1) : 6-9.
( 0) 0)
|
| [4] |
苏晓华, 庞战军. F10基因过表达及沉默对绒癌细胞系JAR侵袭相关蛋白酶表达的影响[J].
医学研究生学报,2015 (4) : 350-4.
( 0) 0)
|
| [5] |
隗玥. 与细胞周期G_1→S调控点相关的几个重要元件及其与肿瘤的关系[J].
国外医学:分子生物学分册,1998 (1) : 10-3.
( 0) 0)
|
| [6] |
N N, Zhu H, Liu J, et al. Analysing the effect of mutation on protein function and discovering potential inhibitors of CDK4:molecular modelling and dynamics studies[J].
PLoS One,2015, 10 (8) : e0133969.
DOI: 10.1371/journal.pone.0133969. ( 0) 0)
|
| [7] |
Resnitzky D, Gossen M, Bujard H, et al. Acceleration of the G1/S phase transition by expression of cyclins D1 and E with an inducible system[J].
Mol Cell Biol,1994, 14 (3) : 1669-79.
DOI: 10.1128/MCB.14.3.1669. ( 0) 0)
|
| [8] |
Zhou P, Jiang W, Weghorst CM, et al. Overexpression of cyclin D1 enhances gene amplification[J].
Cancer Res,1996, 56 (1) : 36-9.
( 0) 0)
|
| [9] |
Enders GH. Mammalian interphase cdks:dispensable master regulators of the cell cycle[J].
Genes Cancer,2012, 3 (11/12) : 614-8.
( 0) 0)
|
| [10] |
李娜.滋养细胞疾病中Cyclin E及其相关蛋白表达的研究[D].天津医科大学, 2008, 61.
( 0) 0)
|
| [11] |
Wang J, Wang G, Khan MF. Disorder of G2-M checkpoint control in Aniline-Induced cell proliferation in rat spleen[J].
PLoS One,2015, 10 (7) : e0131457.
DOI: 10.1371/journal.pone.0131457. ( 0) 0)
|
| [12] |
Gao SY, Li J, Qu XY, et al. Downregulation of Cdk1 and cyclinB1 expression contributes to oridonin-induced cell cycle arrest at G2/M phase and growth inhibition in SGC-7901 gastric cancer cells[J].
Asian Pac J Cancer Prev,2014, 15 (15) : 6437-41.
DOI: 10.7314/APJCP.2014.15.15.6437. ( 0) 0)
|
| [13] |
Lolli G, Johnson LN. Recognition of Cdk2 by Cdk7[J].
Proteins,2007, 67 (4) : 1048-59.
DOI: 10.1002/prot.21370. ( 0) 0)
|
| [14] |
吴蕾.妊娠滋养细胞肿瘤的细胞增殖机制及化疗方案研究[D].北京协和医学院中国医学科学院北京协和医学院清华大学医学部中国医学科学院, 2013.
( 0) 0)
|
| [15] |
崔金全, 石一复, 傅晓华. 妊娠滋养细胞疾病Cyclin B1、PCNA表达的研究[J].
现代妇产科进展,2004, 13 (1) : 11-3.
( 0) 0)
|
| [16] |
王安英, 郑英, 耿正惠. 妊娠滋养细胞肿瘤中VEGF CyclinD1的表达及意义[J].
中国实用妇科与产科杂志,2003 (3) : 48-50.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
