2. 广东省河源市源城区人民医院骨科, 广东 河源 517000 ;
3. 广东省惠州市中心人民医院关节骨科, 广东 广州 516001
2. Department of Orthopaedic Surgery, Yuancheng Hospital, Heyuan 517000, China ;
3. Department of Joint Surgery, Huizhou Municipal Central Hospital, Huizhou, 516001, China
骨缺损是骨外科临床上常见的难题,骨再生修复材料始终是骨科研究方面的热点之一[1]。既往认为“支架”“、种子细胞”“、细胞因子”是骨组织修复材料不可或缺的三要素[2],目前研究较多的支架材料有磷酸钙复合物物(CPC)[3]、聚己内酯(PCL)[4]、聚乳酸-羟基乙酸共聚物(PLGA)[5]等,各种支架材料都在成骨、成软骨等方面有着不同的表现。而种子细胞方面,间充质干细胞是目前研究最多的细胞[6],其由于来源广泛,细胞多能性好等优点,使其深受研究者们的青睐。但是随着生物材料研究的不断深入,尤其是“Cell homing”理论[7]的提出,使得细胞因子的研究逐渐丰富,该实验研究创新性地利用复合TGFβ-3因子但未携带外源性细胞的支架成功修复白兔膝关节软骨缺损,由此提出了生长因子以引导自体干细胞“归巢”的方式促进组织愈合,使得细胞因子在生物材料研究中占据越来越重要的角色,而无外源性细胞的复合因子-支架材料则为生物材料的研究提供了新的思路。本实验研究采用的CaPfromGEM21是一种β-磷酸三钙颗粒(β-TCP),已被广泛应用于口腔科下颌骨修复[8],具有一定的促下颌骨修复的效果,但相关实验发现单纯植入β-TCP后2-4周,成骨出现抑制[9]。因此本实验选用两种与骨再生密切相关的细胞因子BMP-2/ PDGF-BB,通过构建CaPfromGEM21+BMP-2/PDGF-BB新型生物功能化复合材料,观察材料修复SD大鼠颅骨标准骨缺损的作用,为骨组织再生修复提供实验数据。
1 材料和方法 1.1 实验动物选用健康的SPF级3月龄雄性Sprague-Dawley大鼠,共15只,体质量477.79±65.36 g,由南方医科大学南方医院实验动物中心提供(合格证号: NO.44002100004402)。
1.2 实验分组植入材料为磷酸三钙颗粒CaPfromGEM21,2种细胞因子:BMP-2(浓度为10 ng/100 ng)/PDGF-BB(浓度为0.3 μg/3 μg),共分为6组:(1)CaPfromGEM21;(2) CaPfromGEM21+10 ng BMP-2;(3)CaPfromGEM21+ 100 ng BMP-2;(4)CaPfromGEM21 + 0.3 μg PDGF-BB;(5)CaPfromGEM21+3 μg PDGF-BB;(6)空白组,各组重复N=5。
1.3 动物造模3%戊巴比妥钠以50 mg/kg体质量腹腔灌注麻醉大鼠后,常规消毒、铺单,沿颅骨正中线切开皮肤,逐层分离皮肤、软组织、骨膜,清晰暴露顶骨最平坦部位,以矢状缝为中线,利用环钻于顶骨两侧制作两个直径为3.6 mm的全层圆形缺损,两侧缺损随机植入两组不同的实验材料,逐层缝合骨膜、软组织、皮肤。术后麻醉未醒前独笼观察,待麻醉清醒后重新合笼饲养,每日观察动物活动、饮食、精神状态、切口状况等,观察时间6周。
1.4 X线检测术后6周再次以3%戊巴比妥腹腔麻醉大鼠,麻醉成功后送南方医科大学南方医院影像科行颅骨正侧位摄片(Siemens, Aristos MX2, 73 KV/16 mAs/500 ms),观察骨折生长情况。
1.5 Micro CTX光检测完毕后处死大鼠,取下颅骨标本,至少保留缺损周围2 mm正常颅骨,沿矢状缝分离双侧标本,分别对每个标本进行Micro CT扫描(Scanco, MicroCT81, 55 mV/20 μm)、三维重建、新生骨体积定量分析。
1.6 组织形态学分析Micro CT扫描结束后,所有标本用10%中性缓冲福尔马林溶液固定72 h,EDTA溶液脱钙,期间用大头针轻戳标本,至针头可轻松刺入标本中提示脱钙完成,脱钙时间约4~6周,脱钙完成后60%乙醇4 h→70%乙醇4 h→80%乙醇4 h→正丁醇8 h脱水,脱水完成后常规石蜡包埋,包埋完成后以4 μm厚度连续切片,所得切片行苏木素-伊红染色(HE染色),观察各组材料与组织相容性、成骨及成血管情况,利用Image-Pro Plus 6.0软件计算各组代表性切片组织新生骨面积百分数(New Bone Area Fraction, NBA%)、新生血管密度(New Vessel Density, NVD),分析各组复合材料骨缺损修复效果。
新生骨面积百分数(NBA%)=新生骨面积/缺损总面积×100%。
新生血管密度(NVD)=新生血管数/缺损面积
1.7 统计学分析应用SPSS 20.0统计软件分析,数据用均数±标准差表示,各组资料采用One-way ANOVA方差分析进行检验,如果差异有统计学意义,若方差齐用LSD检验、方差不齐用Dunnett T3检验作两两比较。设P值 < 0.05差异有统计学意义。
2 结果 2.1 术后一般情况术后4 h,大鼠可自行站立,术后3 d,活动基本恢复正常,术后1周伤口即完全愈合,所有动物术后恢复良好,无异常死亡,无伤口感染等术后并发症。
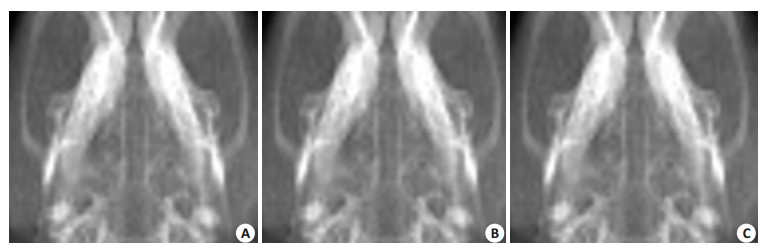
2.2 X线结果术后6周各组骨缺损均有不同程度的修复,骨折线逐渐模糊(图 1)。PDGF-BB组(图 1A右,B右),骨折线基本融合,空白组(图 1C右)仍可见未愈合的骨折线。
|
图 1 术后6周大鼠颅骨X线头位片影像 Figure 1 X-ray of the rat skull at 6 weeks after surgery. A: CaPfromGEM21/CaPfromGEM21+0.3 μg PDGF-BB; B: CaPfromGEM21+10 ng BMP-2/CaPfromGEM21+3 μg PDGF-BB; C: CaPfromGEM21+100 ng BMP-2/Blank. |
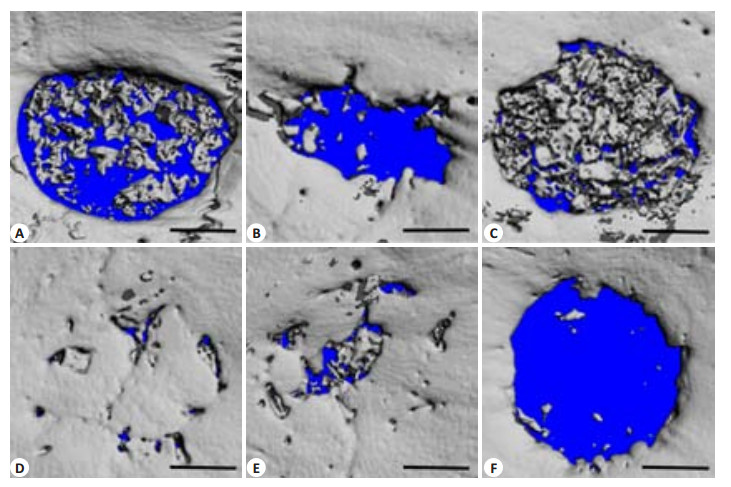
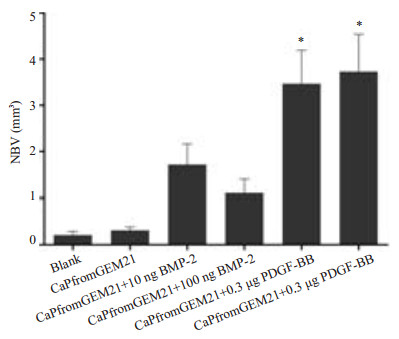
术后6周各实验组边缘至中央均有不同程度的新生骨长入(图 2A~E),PDGF-BB组(图 2D,E)缺损修复明显,空白组(图 2F)则未观察到更多的新生骨长入。对新生骨体积(New Bone Volume, NBV)进行定量分析,定量结果(图 3),运用SPSS进行统计学分析,CaPfromGEM21 + 0.3 μg PDGF-BB组新生骨体积3.72±1.48 mm3、CaPfromGEM21+3 μg PDGF-BB组新生骨体积3.75±1.12 mm3,较空白组0.26±0.18 mm3明显增多,具有统计学意义(P < 0.05),PDGF-BB两个实验组新生骨体积明显大于BMP-2组1.60±1.08 mm3、1.31±0.73 mm3及单纯材料组0.30±0.18 mm3,具有统计学意义(P < 0.05),BMP-2组与单纯材料组,BMP-2与空白组之间差异无统计学意义(P > 0.05)。
|
图 2 术后6周骨缺损Micro CT三维重建图(比例尺=1.0 mm) Figure 2 3D reconstruction of cranial defects at 6 weeks after sugery (Scale Bar=1.0 mm). A: CaPfromGEM21; B: CaPfromGEM21 + 10 ng BMP-2; C: CaPfromGEM21 + 100 ng BMP-2; D: CaPfromGEM21 + 0.3 μg PDGF-BB; E: CaPfromGEM21+ 3 μg PDGF-BB; F: Blank. |
|
图 3 Micro CT新生骨体积的结果分析 Figure 3 Statistical analysis of new bone volume in different groups. *P<0.05. |
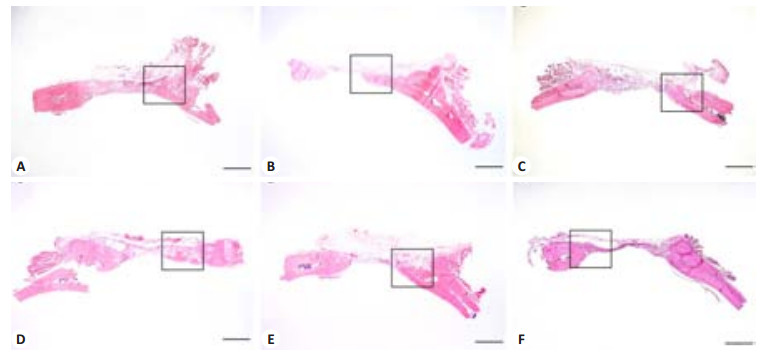
术后6周标本石蜡切片HE染色结果,低倍镜下可见各组实验组有不同程度的新生骨长入(图 4),高倍镜下可见有材料组边沿与周围骨组织无炎性瘢痕组织产生,无各种急慢性炎症细胞浸润,观察缺损中央可见染色均一的新生骨组织,新生骨内可见骨细胞,新生骨边缘可见梭型的成骨细胞,新生骨内及周围可见散在新生血管,血管内可见红细胞(图 5)。
|
图 4 镜下所见病理HE染色切片图像(比例尺=1.0 mm) Figure 4 HE staining of the tissues from the defects (Scale bar=1.0 mm). A: CaPfromGEM21; B: CaPfromGEM21+10 ng BMP-2; C: CaPfromGEM21+100 ng BMP-2; D: CaPfromGEM21+0.3 μg PDGF-BB; E: CaPfromGEM21+3 μg PDGF-BB; F: Blank. |
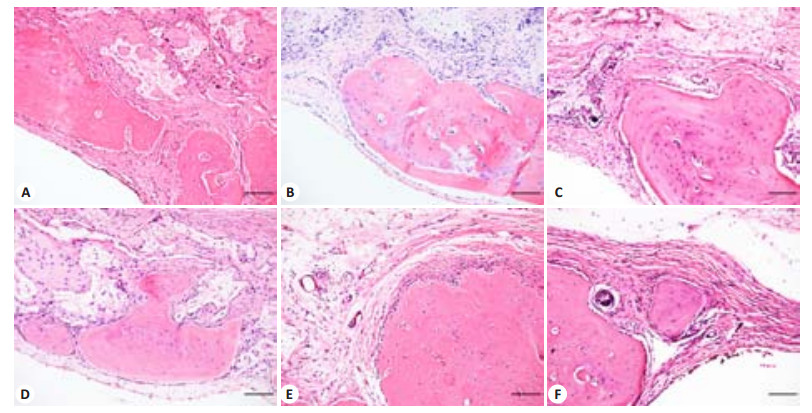
|
图 5 镜下所见病理HE染色切片图像(比例尺=100 μm) Figure 5 HE staining of the tissues from the defects (Scale bar=100 μm). A: CaPfromGEM21; B: CaPfromGEM21 + 10 ng BMP-2; C: CaPfromGEM21+100 ng BMP-2; D: CaPfromGEM21+0.3 μg PDGF-BB; E: CaPfromGEM21+ 3 μg PDGF-BB; F: Blank. |
IPP 6.0软件定量新生骨组织面积百分数及新生血管密度定量(表 1),单纯材料组、10 ng BMP-2组、100 ng BMP-2组、0.3 μg PDGF-BB组新生骨面积百分数较空白组明显增加,具有统计学差异(P < 0.05);3 μg PDGF-BB组2与空白组差异无统计学差异。10 ng BMP-2组及0.3 μg PDGF-BB组新生骨百分数高于单纯材料组(P < 0.05),4个添加细胞因子的实验组之间无统计学差异(P > 0.05)。10 ng BMP-2组新生血管密度、100 ng BMP-2组、0.3 μg PDGF-BB组、3 μg PDGF-BB组较空白组明显增加,具有统计学意义(P < 0.05);4个组添加细胞因子的实验组较单纯材料组12.12±3.48明显增高,具有统计学意义(P < 0.05);4个添加细胞因子的实验组之间无统计学差异(P > 0.05)。
| 表 1 HE染色切片新生骨面积百分数和新生血管密度定量结果 Table 1 Quantitative assessment of new bone area fraction and new vessel density |
BMP是转化生长因子-β(TGF-β)超家族一类的多功能生长因子,BMP-2有促进成骨及促进成骨细胞分化的功能,并表达特异性的成骨细胞产物[10]。血小板衍生因子(PDGF)是人体内重要的促有丝分裂因子,PDGF能促进成骨细胞的生长[11],骨折局部由于机械损伤产生大量PDGF,促使骨原细胞转化为成骨细胞,从而促进骨折的愈合[12]。磷酸三钙(TCP)则是人体骨骼常见成分,骨再生生物材料中最常用的是β-磷酸三钙[13],其具有良好的生物相容性、生物活性以及生物降解性, 是理想的人体硬组织修复和替代材料[14]。
本实验使用磷酸三钙复合不同含量的细胞因子用于修复大鼠颅骨标准骨缺损,根据本实验的研究结果,X线、Micro CT结果提示复合BMP-2/PDGF-BB后骨折愈合加快,缺损有不同程度的新生骨长入,较空白组及单纯材料组有更显著的修复,PDGF-BB组缺损修复最为明显,说明细胞因子起到了加快骨缺损修复的作用,Choo等发现单纯植入β-TCP后2-4周,骨缺损修复出现抑制,而复合了PDGF-BB后成骨能力持续增强,未出现抑制,说明本实验研究的复合材料可克服单纯材料植入所带来的不足。既往研究发现,BMP-2促进成骨存在剂量依赖性,高剂量( > 150 μg/mL)的BMP-2成骨效果未优于中等剂量组(30 μg/mL),但高剂量BMP-2明显增加异常骨化及周围组织的炎症反应[15],本实验所用的BMP-2含量属于低剂量(10 ng/100 ng),HE染色切片组织形态学分析提示材料与周围组织无炎症、排斥反应,提示此剂量范围内,复合材料保持了良好的生物相容性的同时并没有增加不良反应,除此之外BMP-2还可能存在刺激血肿形成、异位骨化、组织水肿或其他全身性的反应[16],因此对于复合因子的剂量需更严谨的探索。
新生骨面积百分数定量提示材料复合BMP-2/ PDGF-BB后可进一步加快新生骨的长入,复合细胞因子的实验组新生骨面积百分数明显大于空白组或单纯材料组,本研究得出的结果与既往的研究结果一致,Kim等[17]的研究表明,复合BMP-2可明显促进碱性磷酸酶活性,增加钙盐沉积及相关成骨基因的表达,从而有效地促进骨缺损的再生。另一方面,在Yamano等[18]的实验中也发现PDGF-BB在材料中含量大于0.5 μg时均可观察到良好的新生骨长入。在一些对此两种因子的比较研究中发现,两种因子都有着良好的促成骨的作用,但是对于大于4周的骨延迟愈合模型中,使用BMP-2作为促成骨因子的效果则明显优于PDGF-BB[19],因此在不同的骨缺损模型中使用细胞因子的种类,也是一个值得探索的课题。
血管化是骨组织再生修复的重要评价指标,新生骨组织的氧含量较低、代谢率较高,因此需要密集的毛细血管网为新生组织供氧,所以新生血管是骨再生的关键促进因素[20]。本实验研究新生血管密度定量提示复合BMP-2/PDGF-BB后可明显促进新生血管生成,BMP-2通过促进细胞内皮细胞管状结构的生长而起到促进血管增殖的作用[21],而PDGF-BB则具有促有丝分裂的作用,体外实验中可促进细胞的增殖,使其具有良好的促进血管生成的能力[22],而Xie等[23]的实验则进一步发现,破骨细胞前体分泌的PDGF-BB可促进一种特异性的CD31及Endomucin强阳性的微血管形成,且CD31及Endomucin在成骨方面同样具有重要意义,本实验研究同样得出了PDGF-BB可同时增强新型生物功能化材料的成血管能力及骨缺损修复能力的结果。
综上所述,本研究所构建的CaPfromGEM21 + BMP-2/PDGF-BB新型生物功能化复合材料在促进骨缺损修复的实验中表现出了良好的生物相容性、促成骨/成血管能力,未见明显的不良副反应,且复合材料可以克服单纯材料植入所带来的弊端。总结本研究得出的初步数据,可认为CaPfromGEM21复合PDGF-BB的骨缺损修复效果优于复合BMP-2,就同一细胞因子而言,在本实验所设置的不同含量组之间,高剂量组的骨缺损修复效果略优于低剂量组。本实验研究为复合细胞因子设置了多个含量,也为进一步探索复合因子的最佳含量提供了宝贵的实验数据。
目前越来越多的细胞因子被纳入到复合生物材料的研究中来,除了本实验所涉及的两种细胞因子外,骨形态发生蛋白-7(BMP-7)[24]、纤维原细胞生长因子(FGF)[25]、基质细胞衍生因子-1(SDF-1)[26]、腓骨蛋白-1(Fbln1)[27]等细胞因子也被用于生物材料的研究,各种配对复合的细胞因子在骨缺损修复模型都表现出了不同程度的促进成骨、加快骨缺损修复的作用。而对于细胞因子的添加方法的研究,也已从外源性蛋白直接添加逐渐发展丰富,近年来报道了如植入带质粒DNA的支架,编码内源性的因子合成促进成骨[28];抗体介导的骨再生(AMOR)[29]等研究都获得了较为满意的实验结果。以上成果都极大地拓展了生物材料研究领域的范围。本实验组下一阶段实验希望进一步提高复合材料的的骨缺损修复效果,是复合因子的材料达到添加干细胞后的促成骨效果[30-31],进而替代干细胞的角色,那将克服干细胞来源、制备方法、潜在成瘤性等不足[32],从而使更多的临床骨缺损患者获得受益。
| [1] |
Götz C, Warnke PH, Kolk A. Current and future options of regeneration methods and reconstructive surgery of the facial skeleton[J].
Oral Surg Oral Med Oral Pathol Oral Radiol,2015, 120 (3) : 315-23.
DOI: 10.1016/j.oooo.2015.05.022. ( 0) 0)
|
| [2] |
Giannoudis PV, Einhorn TA, Marsh D. Fracture healing:the diamond concept[J].
Injury,2007, 38 (Suppl 4) : S3-6.
( 0) 0)
|
| [3] |
Wang P, Zhao L, Chen W, et al. Stem cells and Calcium phosphate cement scaffolds for bone regeneration[J].
J Dent Res,2014, 93 (7) : 618-25.
DOI: 10.1177/0022034514534689. ( 0) 0)
|
| [4] |
Ródenas-Rochina J, Ribelles JL, Lebourg M. Lebourg, comparative study of PCL-HAp and PCL-bioglass composite scaffolds for bone tissue engineering[J].
J Mater Sci Mater Med,2013, 24 (5) : 1293-308.
DOI: 10.1007/s10856-013-4878-5. ( 0) 0)
|
| [5] |
Sheikh FA, Ju HW, Moon BM, et al. Hybrid scaffolds based on PLGA and silk for bone tissue engineering[J].
J Tissue Eng Regen Med,2015 .
DOI: 10.1002/term.1989. ( 0) 0)
|
| [6] |
Zhao L, Weir MD, Xu HH. Human umbilical cord stem cell encapsulation in calcium phosphate scaffolds for bone engineering[J].
Biomaterials,2010, 31 (14) : 3848-57.
DOI: 10.1016/j.biomaterials.2010.01.093. ( 0) 0)
|
| [7] |
Lee CH, Cook JL, Mendelson A, et al. Regeneration of the articular surface of the rabbit synovial joint by cell homing:a proof of concept study[J].
Lancet,2010, 376 (9739) : 440-8.
DOI: 10.1016/S0140-6736(10)60668-X. ( 0) 0)
|
| [8] |
Alfotawei R, Naudi KB, Lappin D, et al. The use of TriCalcium Phosphate (TCP) and stem cells for the regeneration of osteoperiosteal critical-size mandibular bony defects, an in vitro and preclinical study[J].
J Craniomaxillofac Surg,2014, 42 (6) : 863-9.
DOI: 10.1016/j.jcms.2013.12.006. ( 0) 0)
|
| [9] |
Choo T, Marino V, Bartold PM. Effect of PDGF-BB and betatricalcium phosphate(beta-TCP)on bone formation around dental implants:a pilot study in sheep[J].
Clin Oral Implants Res,2013, 24 (2) : 158-66.
DOI: 10.1111/clr.2013.24.issue-2. ( 0) 0)
|
| [10] |
Ramazzotti G, Bavelloni A, Blalock W, et al. BMP-2 induced expression of PLCβ1 that is a positive regulator of osteoblast differentiation[J].
J Cell Physiol,2016, 231 (3) : 623-9.
DOI: 10.1002/jcp.v231.3. ( 0) 0)
|
| [11] |
Abreu FA, Ferreira CL, Silva GA, et al. Effect of PDGF-BB, IGF-I growth factors and their combination carried by liposomes in tooth socket healing[J].
Braz Dent J,2013, 24 (4) : 299-307.
DOI: 10.1590/0103-6440201302238. ( 0) 0)
|
| [12] |
Zhao Y, Zhang S, Zeng D, et al. rhPDGF-BB promotes proliferation and osteogenic differentiation of bone marrow stromal cells from streptozotocin-induced diabetic rats through ERK pathway[J].
Biomed Res Int,2014 : 637415.
( 0) 0)
|
| [13] |
Gupta V1, Mohan N2, Berkland CJ, et al. Microsphere-Based scaffolds carrying opposing gradients of chondroitin sulfate and tricalcium phosphate[J].
Front Bioeng Biotechnol,2015 : 96.
( 0) 0)
|
| [14] |
Chow LC. Next Generation Calcium phosphate-based biomaterials[J].
Dent Mater J,2009, 28 (1) : 1-10.
DOI: 10.4012/dmj.28.1. ( 0) 0)
|
| [15] |
Zara JN, Siu RK, Zhang X, et al. High doses of bone morphogenetic protein 2 induce structurally abnormal bone and inflammation in vivo[J].
Tissue Eng Part A,2011, 17 (9/10) : 1389-99.
( 0) 0)
|
| [16] |
Tannoury CA, An HS. Complications with the use of bone morphogenetic protein 2(BMP-2) in spine surgery[J].
Spine J,2014, 14 (3) : 552-9.
DOI: 10.1016/j.spinee.2013.08.060. ( 0) 0)
|
| [17] |
Kim SE1, Yun YP1, Shim KS, et al. Fabrication of a BMP-2-immobilized porous microsphere modified by heparin for bone tissue engineering[J].
Colloids Surf B Biointerfaces,2015 : 453-60.
( 0) 0)
|
| [18] |
Yamano S, Haku K, Yamanaka T, et al. The effect of a bioactive collagen membrane releasing PDGF or GDF-5 on bone regeneration[J].
Biomaterials,2014, 35 (8) : 2446-53.
DOI: 10.1016/j.biomaterials.2013.12.006. ( 0) 0)
|
| [19] |
Kaipel M, Schuetzenberger S, Schultz AA, et al. BMP-2 but not VEGF or PDGF in fibrin matrix supports bone healing in a delayed-union rat model[J].
J Orthopaedic Res,2012, 30 (10) : 1563-9.
DOI: 10.1002/jor.v30.10. ( 0) 0)
|
| [20] |
Chen W, Liu J, Manuchehrabadi N, et al. Umbilical cord and bone marrow mesenchymal stem cell seeding on macroporous Calcium phosphate for bone regeneration in rat cranial defects[J].
Biomaterials,2013, 34 (38) : 9917-25.
DOI: 10.1016/j.biomaterials.2013.09.002. ( 0) 0)
|
| [21] |
David L, Feige JJ, Bailly S. emerging role of bone morphogenetic proteins in angiogenesis[J].
Cytokine Growth Factor Rev,2009, 20 (3) : 203-12.
DOI: 10.1016/j.cytogfr.2009.05.001. ( 0) 0)
|
| [22] |
Santo VE, Frias AM, Carida M, et al. Carrageenan-based hydrogels for the controlled delivery of PDGF-BB in bone tissue engineering applications[J].
Biomacromolecules,2009, 10 (6) : 1392-401.
DOI: 10.1021/bm8014973. ( 0) 0)
|
| [23] |
Xie H, Cui Z, Wang L, et al. PDGF-BB secreted by preosteoclasts induces angiogenesis during coupling with osteogenesis[J].
Nat Med,2014, 20 (11) : 1270-8.
DOI: 10.1038/nm.3668. ( 0) 0)
|
| [24] |
Li X, Lin Z, Duan Y, et al. Repair of large segmental bone defects in rabbits using BMP and FGF composite xenogeneic bone[J].
Genet Mol Res,2015, 14 (2) : 6395-400.
DOI: 10.4238/2015.June.11.15. ( 0) 0)
|
| [25] |
Hwang HD, Lee JT, Koh JT, et al. Sequential treatment with SDF-1 and BMP-2 potentiates bone formation in calvarial defects[J].
Tissue Eng Part A,2015, 21 (13/14) : 2125-35.
( 0) 0)
|
| [26] |
Cooley MA, Harikrishnan K, Oppel JA, et al. Fibulin-1 is required for bone formation and Bmp-2-mediated induction of Osterix[J].
Bone,2014 : 30-8.
( 0) 0)
|
| [27] |
Elangovan S, D'mello SR, Hong L, et al. The enhancement of bone regeneration by gene activated matrix encoding for platelet derived growth factor[J].
Biomaterials,2014, 35 (2) : 737-47.
DOI: 10.1016/j.biomaterials.2013.10.021. ( 0) 0)
|
| [28] |
Ansari S, Freire MO, Pang EK, et al. Immobilization of murine anti-BMP-2 monoclonal antibody on various biomaterials for bone tissue engineering[J].
Biomed Res Int,2014 : 940860.
( 0) 0)
|
| [29] |
Buehrer G, Balzer A, Arnold I, et al. Combination of BMP2 and MSCs significantly increases bone formation in the rat arteriovenous loop model[J].
Tissue Eng Part A,2015, 21 (1/2) : 96-105.
( 0) 0)
|
| [30] |
Haversath M, Hülsen T, B?ge C, et al. Osteogenic differentiation and proliferation of bone marrow-derived mesenchymal stromal cells on PDLLA+BMP-2-coated Titanium alloy surfaces[J].
J Biomed Mater Res A,2016, 104 (1) : 145-54.
DOI: 10.1002/jbm.a.35550. ( 0) 0)
|
| [31] |
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
