全身炎症反应综合症(SIRS)是创伤、软组织伤、心血管等手术后的常见并发症,创伤激活炎症细胞释放TNF-α、IL-1等促炎因子,造成内皮细胞损伤,血小板粘附,释放氧自由基和脂质代谢产物等在体内形成“瀑布效应”,导致炎症介质数量不断增加、炎症反应不断扩大。SIRS以诊断困难和预后严重等特点成为围手术期的危险因素,在无抗生素治疗情况下可急剧进展至严重败血症、休克、多器官衰竭综合症(MOF)甚至死亡[1-2]。研究发现,循环白细胞的募集和黏附是炎症反应中的关键步骤,它黏着于细静脉壁、嵌塞毛细血管,造成微循环缺血缺氧,是炎症导致的重症休克治疗后微循环灌流量不易恢复的重要原因。
黏附分子是介导细胞间相互作用或细胞与细胞外基质相互作用的糖蛋白,其可在全身炎症反应综合症中由TNF-α和IL-8以及其他炎性介质诱导上调[3]。而其中的选择素家族是最初介导白细胞沿血管壁滚动、边集和黏附的重要黏附因子[4-5],在正常免疫应答和多种血管疾病中起关键作用[6],引起多器官功能障碍综合征(MODS)与多器官功能衰竭(MOF)[7]。有研究发现[8],胞膜表达性或可溶性的p-selectin可通过与其配体的结合促进中性粒细胞的胞外聚集,并进一步导致炎性或血栓性疾病。我室的微循环观察研究表明,应用p-selec-tin阻断性抗体能够明显地抑制创伤引起的外周血管白细胞黏附,揭示了p-selectin的表达在创伤诱导的全身炎症反应综合征中起重要作用,是治疗炎症性疾病的理想靶点[9]。
因此,为了更进一步探索炎症因子诱导p-selectin转录活性增强的信号通路,创造早期阻断p-selectin表达的可行性,为临床治疗SIRS患者提供有效的药物靶点,从而提高患者术后生存率,本研究通过构建p-selectin基因启动子的荧光素酶报告基因重组质粒pGL3-p-selectin-promoter,并在人胚肾上皮细胞293F中验证其启动子转录活性,用海肾荧光素酶质粒pRL-SV40平衡组间差距取得可信结果,旨在利用该报告基因探究炎症发生机制,并为研究临床抗炎药物的分子生物学机制奠定基础。
1 材料和方法 1.1 主要材料与试剂293F细胞株、293A细胞株、载体质粒pGL3-Basic、内参质粒pRL-SV40、脂多糖LPS、肿瘤坏死因子TNF-α、蛋白酶体抑制剂MG-132、砷化物As2O3本科室保留。大肠杆菌感受态细胞DH5α、人血基因组DNA纯化试剂盒购自天根生化科技公司。DNA片段凝胶回收试剂盒购自Promega;白色96孔平底板购自Corning;Q5高保真DNA聚合酶、限制性内切酶KpnⅠ和XhoⅠ购自NEB;Ligase high酶购自TOYOBO;DNA marker购自Takara;质粒提取试剂盒购自Omega;转染脂质体Lipofectamine2000购自Invitrogen;胰蛋白酶、新生牛血清、DMEM培养基购自Gibco;琼脂粉(Agar)、胰蛋白胨(Tryptone)、酵母浸出粉(Yeast Extract)购自英国Oxoid;离心柱型血液/细胞/组织基因组DNA提取试剂盒DR303购自北京天根生化科技有限公司;双荧光素酶报告基因检测试剂盒(Dual-Luciferase Reporter Assay System)购自美国Promega。所用仪器:PCR仪(美国Bio-Rad);电泳仪(北京百晶);凝胶图像分析仪Tanon-2500(上海天能公司);Spectra MAX M5酶标仪(Molecular Device公司);超微量蛋白核酸分析仪Biodrop(英国柏楉有限公司)。
1.2 实验方法 1.2.1 细胞培养和DNA提取将293A细胞接种至35 mm培养皿,待细胞密度达95%,处理成细胞悬液,按照DNA试剂盒说明提取基因组DNA,用超微量蛋白核酸分析仪测定产物在260 nm/280 nm处吸收值,浓度为101 ng/μL。
1.2.2 p-selectin启动子的PCR扩增和回收纯化应用UCSC基因组浏览器查找人p-selectin基因启动子序列。根据参考文献[10],确定本实验研究p-selectin基因SELP启动子(L01574.1)长度为1888 bp(-1826 bp~+ 62 bp),根据软件Primer Premier 5.0分析启动子序列上的限制性内切酶位点。设计其两端引物(PCR引物合成由上海英骏生物技术有限公司完成)如下:上游引物(其中斜线加粗序列GGTACC为Kpn Ⅰ酶切位点,TAACGG为保护性碱基):5'-TAACGGGGTACCTAA CAGCGTGATAGGTATTGTTCCA-3'。下游引物(其中斜线加粗序列CTCGAG为Xho Ⅰ酶切位点,ACT CCG为保护性碱基):5'-ACTCCGCTCGAGCTCTGTGACTCTGCTGGTTTTCTG-3'。产物大小1888 bp。以基因组DNA为模板,用Q5聚合酶进行PCR扩增反应:在PCR反应管中加入基因组DNA 10 μL,dNTP(10 mmol/L)1 μL,5×buffer 10 μL,上游引物(10 μmol/L)2.5 μL,下游引物(10 μmol/L)2.5 μL,ddH2O 23.5 μL,Q5高保真聚合酶0.5 μL。PCR反应条件如下:98 ℃预变性30 s 98 ℃变性10 s 58 ℃退火30 s 72 ℃延伸60 s,共35个循环,72 ℃后延伸2 min。反应结束后,将PCR产物于1%琼脂糖胶电泳。利用凝胶回收试剂盒回收PCR产物。
1.2.3 pGL3-basic质粒的抽提采用pGL3-basic载体质粒转化氯化钙感受态细胞DH5α,挑单克隆进行大量扩增;用质粒抽提试剂盒制备扩增pGL3-basic质粒,用超微量蛋白核酸分析仪测定纯度和浓度。所得质粒用分光光度计测定浓度后,于1%琼脂糖凝胶电泳。pGL3-basic空载体的序列特征见图 1A。
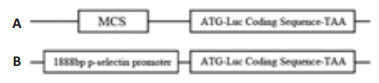
|
图 1 pGL3-basic和pGL3-p-selectin-promoter载体的部分结构图 Figure 1 Structures of partial pGL3-basic (A) and pGL3-p-selectin-promoter (B) plasmids. MCS: Multiple cloning sites; LUC: Luciferase gene. The locations of the ATG and TAA are indicated. |
先后用限制性内切酶KpnⅠ和XhoⅠ对回收的p-selectin启动子PCR产物和pGL3-basic载体质粒进行双酶切,电泳后切胶回收酶切产物。酶切条件分别如下:pGL3-basic质粒/promoterDNA:2.3 μL/8.2 μL(各1 μg),KpnⅠ(10 U/μL):1 μL,XhoⅠ(20 U/μL):1 μL,10×NEBuffer 1.1:5 μL,ddH2O 40.7 μL/34.8 μL,共50 μL。37 ℃酶切4 h完成后,1%琼脂糖凝胶电泳,并分别回收酶切后的promoter DNA和pGL3-basic质粒。
1.2.5 连接和转化用Ligase high连接酶将酶切回收后的promoter DNA双酶切产物和pGL3-basic质粒进行连接反应,分别取promoter DNA双酶切回收产物(47 ng/μL)2.5 μL,pGL3-basic质粒双酶切回收产物(14.8 ng/μL)2.5 μL,Ligase high 5 μL,共10 μL。16 ℃连接16 h。并将此重组的pGL3-p-selectin-promoter质粒转化DH5α感受态,获得重组质粒克隆。10 μL连接产物与100 μL DH5α感受态混匀冰上放置30 min,42 ℃ 90 s,冰上2 min,然后加入700 μL LB培养基(无抗性),于37.0 ℃、220 r/min培养1 h后,涂于Amp+抗性的LB固体培养基平板,37 ℃培养过夜,平板上有克隆长出,挑取一些克隆进行阳性鉴定。构建好的pGL3-p-selectin-promoter表达载体的序列特征见图 1B。
1.2.6 阳性克隆鉴定、测序挑取15个平板克隆,接种于LB(Amp+抗性)培养基中,37.0 ℃、220 r/min振摇培养,8 h后取1 μL做菌液PCR克隆鉴定菌液PCR,于1%琼脂糖凝胶电泳,其余的液体继续震荡培养至14 h,直至菌液混浊。对菌液PCR显示阳性的菌液,用质粒小提试剂盒提取质粒后作KpnⅠ和XhoⅠ双酶切鉴定。挑选阳性克隆于上海英骏生物技术有限公司测序。
1.2.7 p-selectin启动子报告基因转染细胞将293F细胞用含10%胎牛血清的高糖DMEM培养基培养。在转染的前1 d将293F细胞以2×105/mL的密度接种于24孔板并换用无抗生素的含10%胎牛血清培养基,在37 ℃,5% CO2培养箱中培养,直至细胞密度达到90%。按照Lipofectamine 2000试剂盒操作说明,分别以每孔0.8 μg的剂量瞬时转染pGL3-basic质粒(对照组)和构建好的pGL3-p-selectin-promoter质粒(实验组)于培养的293F细胞中,同时以每孔0.01 μg转染pRL-SV40荧光素酶表达质粒作为转染效率内参照,每组设3个复孔。6 h后换液成含有10%胎牛血清的完全培养基,并根据参考文献设置浓度梯度在实验组中分组加入相应浓度的LPS[11]、TNF-α[12]、MG-132[13]或者As2O3[14]。
1.2.8 p-selectin启动子活性测定转染24 h后,每孔细胞用PBS洗涤1次。按照Promega公司的双荧光素酶报告基因检测试剂盒(Dual-Luciferase Reporter Assay System)说明书,每孔加入100 μL的1×PLB(被动裂解液Passive Lysis Buffer)裂解细胞,于室温下在摇床上震摇15 min,收集细胞裂解液,10 000 r/min 4 ℃离心5 min。取20 μL细胞裂解液上清,加入白色96孔平底板,先用M5多功能酶标仪读取背景值。每孔加入100 μL的LARⅡ工作液,读取萤火虫荧光素酶发光值。再加入100 μL的Stop&Glo® Reagent(萤火虫荧光素酶终止液和海肾荧光素酶的底物),读取海肾荧光素酶发光值,按Promega说明书要求在2 min内完成每单个样品的检测过程,每组细胞重复检测3次。以萤火虫荧光素酶活性与海肾荧光素酶活性的比值作为衡量p-selectin启动子活性的依据,pRL-SV40作为内参可以消除由于细胞数目及转染效率等不同所带来的组间差异。
1.2.9 统计学方法所有实验结果均已重复3次。应用SPSS 20.0统计软件,数据用均数±标准差表示。两组间显著性检验采用两独立样本t检验,多组间显著性检验采用单因素方差分析,P < 0.05为差异有统计学意义。
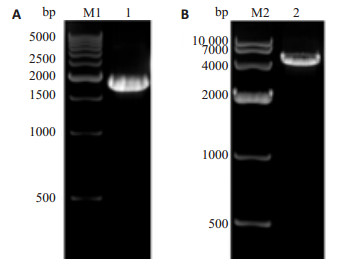
2 结果 2.1 p-selectin启动子片段的扩增以正常人基因组DNA为模板,克隆p-selectin启动子片段,1%琼脂糖胶电泳在2000 bp附近可见一条带(图 2A),与1888 bp的p-selectin基因启动子大小相符。回收产物采用Biodrop超微量蛋白核酸分析仪测定浓度为122.0 ng/μL。
|
图 2 p-selectin PCR产物电泳及空载体酶切产物电泳图 Figure 2 Electrophoresis of the PCR product of p-selectin promoter (A) and digestion of pGL3-Basic plasmid (B). M1: 500 bp DNA ladder; 1: PCR product of p-selectin promoter (1888 bp); M2: DNA marker DL10000; 2: Digestion product (4791 bp) of pGL3-Basic plasmid with endonucleases KpnⅠand XhoⅠ. |
胶回收后的p-selectin启动子片段和pGL3-Basic双酶切后(图 2B)。分别回收酶切后的promoter DNA和pGL3-basic质粒,得到的浓度分别为47.0 ng/μL和14.8 ng/μL。连接、转化、构建pGL3-p-selectin-promot-er重组质粒。挑取15个平板克隆,接种于LB(Amp+抗性)培养基中,37.0 ℃、220 r/min振摇培养,8 h后取1 μL做菌液PCR克隆鉴定,于1%琼脂糖凝胶电泳,结果如图 3,可见有5个克隆均为阳性。提取1,2,3号阳性克隆质粒作KpnⅠ和XhoⅠ双酶切鉴定,酶切产物电泳可在2000 bp和5000 bp附近处出现2个条带,这与插入的1888 bp的p-selectin启动子目的片段和4791 bp的线性pGL3-Basic大小完全一致。挑选阳性克隆于上海英骏生物技术有限公司测序,测序结果显示p-selectin基因启动子成功插入到pGL3-basic载体中,所构建质粒与设计相符(图 4),且未发现碱基突变。
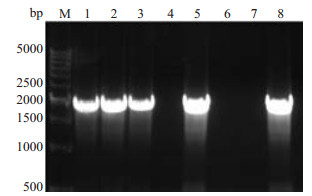
|
图 3 pGL3-p-selectin-promoter报告基因载体菌落PCR筛选的电泳图 Figure 3 Electrophoretic profile of PCR screening of pGL3-p-selectin-promoter reporter gene carrier colony. M: 500 bp DNA ladder; Lanes 1-8: PCR screening of pGL3-p-selectin-promoter reporter gene carrier colony; Lanes 1, 2, 3, 5, 8: p-selectin promoter (1888 bp) amplified with primers. |
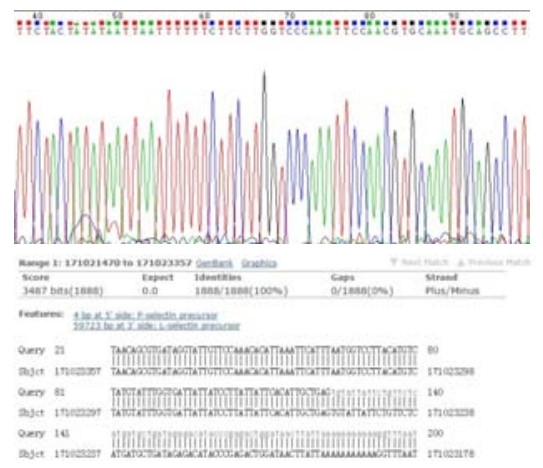
|
图 4 p-selectin启动子的测序峰图及BLAST比对结果 Figure 4 Sequence peaks of p-selectin promoter and results of BLAST. |
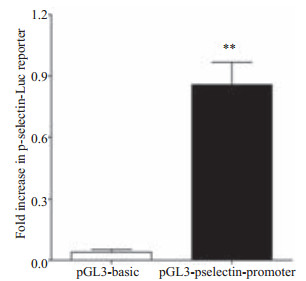
pGL3-basic质粒和构建的pGL3-p-selectin-pro-moter质粒分别转染细胞后,经海肾萤火虫荧光素酶标准化后的萤火虫荧光素酶表达情况(图 5),构建的pGL3-p-selectin-promoter质粒转染组0.8573±0.4703,比pGL3-basic空质粒转染组0.03955±0.05894的荧光素酶活性高21.7倍,差异有统计学意义(t=7.424,df=4,P=0.0018 < 0.01)。说明p-selectin启动子已经准确插入到了荧光素酶基因上游,并在细胞内启动了荧光素酶基因的表达。
|
图 5 报告基因载体转染细胞后荧光素酶相对表达量 Figure 5 Quantification of luciferase expression in cells cotransfected with reporter vector and internal reference plasmid pRL-SV40. **P < 0.01 vs pGL3-basic group. |
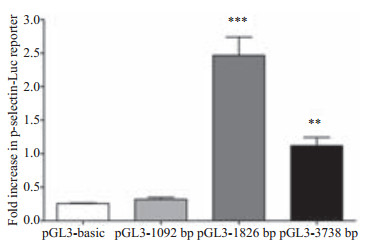
笔者同时在实验室构建了插入-1092 bp~+62 bp的p选择素启动子片段的pGL3-1092 bp和插入-3738 bp~+ 62 bp启动子片段的pGL3-3738 bp,设置了4个组别分别转染pGL3-basic、pGL3-1092 bp、pGL3-1826 bp、pGL3-3738 bp,使用One-way ANOVA分析,4组之间有统计学差异(F=46.80,P < 0.0001)。经Dunnett-t检验,除了pGL3-basic组与pGL3-1092 bp组相比没有统计学差异,其余任意两组之间均有统计学差异。
由图 6可见,取质粒pGL3-1826 bp可以达到最大的荧光素酶表达量,可知在p选择素的转录起始位点上游-1826~-1092的位置的基因片段在P选择素的组成性转录表达中起重要作用,而-3738~-1826这一区域会对转录造成抑制,这与McEver, R.P.在其实验室对P选择素启动子报告基因进行截短检测的文献报道[10]类似,且是对其实验的补充和完善,确证了P选择素转录起始位点上游-1500区域在组成性转录表达中的核心作用。
|
图 6 不同长度的启动子片段构建的报告基因荧光素酶表达量 Figure 6 Quantification of luciferase expression in serially truncated segments of the 5'-flanking region of p-selectin promoter. **P < 0.01 and ***P < 0.001 vs pGL3-basic group. |
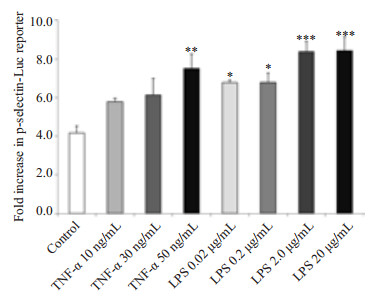
我们使用炎症因子LPS和TNF-α刺激转染了pGL3-p-selectin-promoter报告基因质粒的293F细胞,结果如图 7所示,可见LPS和TNF-α在不同浓度下均对P选择素启动子的转录活性有激活作用,以LPS的激活作用更为显著。
|
图 7 pGL3-p-selectin-promoter报告基因筛选炎症因子对P选择素启动子活性的影响 Figure 7 pGL3-p-selectin-promoter reporter gene luciferase screening of the effects of inflammatory factors on p-selectin promoter transcriptional activity. *P < 0.05, **P < 0.01 and ***P < 0.001 vs control group. |
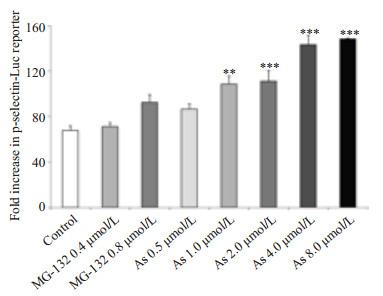
蛋白酶体抑制剂MG-132和砷化物As2O3设置浓度梯度刺激转染表达载体的293F细胞(图 8),可见As2O3可对pGL3-p-selectin-promoter报告基因起转录上调作用,当其浓度达到4~8 μmol/L有最大转录激活效果。
|
图 8 pGL3-p-selectin-promoter报告基因筛选药物对P选择素启动子活性的影响 Figure 8 pGL3-p-selectin-promoter reporter gene luciferase screening of the effects of drugs on p-selectin promoter transcriptional activity. **P < 0.01 and ***P < 0.001 vs control group. |
P-选择素是选择素家族的重要黏附分子,作为血小板/内皮细胞活化标志和细胞黏附受体,其可通过介导血小板、内皮细胞黏附及与白细胞的相互作用,启动参与了包括炎症和血栓形成等多种病理生理起始过程,是炎症/血栓的重要介质和靶分子[15-16]。在急性炎症情况下,p-selectin因内皮细胞接受一系列炎症介质如终末补体C5b-9复合物[17]、活性氧和凝血酶等刺激而在细胞表面出现高表达[18],介导内皮细胞和白细胞黏附并在急性炎症中促进内皮细胞黏附分子表达上调[19]。文献报道p-selectin可介导内皮细胞-白细胞相互作用,诱导下调p-selectin可减少血管内血栓形成[20-21],或通过介导血小板黏附造成子宫内膜异位[22],介导单核细胞-血小板聚集(MPA)、白细胞-血小板聚集(NPA)造成动脉粥样硬化血栓性疾病[23]。可见p-selectin在各病理生理过程中扮演极其重要的作用。然而大部分文献以ELISA、qPCR、FACS、基因敲除动物等实验手段开展研究,却忽略了通过双荧光素酶报告基因的构建,可以更高效、简捷地达到分析启动子转录活性、定位转录因子的目的。
报告基因技术广泛地应用于监测细胞的信号转导和基因表达,通过把转录控制元件剪接到报告基因,可以直观地“报道”细胞内与基因表达有关的信号级联。这种检测具有敏感性高、方便、可靠而且适用于大规模检测等优点[24]。与EMSA检测相比,该方法具有操作简便,灵敏度高,结果真实准确的特点[25]。而本文采用的双荧光素酶报告基因检测系统为单管双报告酶的分析体系,在单荧光素酶报告基因的基础上增加了内参照系统。其原理是,Firefly和Renilla是两个不同来源的荧光素酶,两者的酶结构不同,Firefly虫荧光素酶是一个61 000大小的单体蛋白,Renilla是一个36 000大小的单体蛋白。它们的作用底物也不一样,双报告基因系统就是利用两者的不同,先加入Firefly荧光素酶的底物检测其活性,然后加入终止液,同时加入Renilla荧光素酶的底物检测Renilla荧光素酶活性。然后计算两者的比值,从而排除转染效率和加样量的差异,真实可靠地反映pGL3-p-selectin-promoter的转录活性[26]。但是双荧光素酶报告基因也有其局限性。我们在实验研究中发现,细胞裂解液的荧光读数在一定程度上受到细胞状态、培养条件、内参质粒和检测方法的干扰,在实验中需严格按照说明书操作谨慎排除以细胞状态影响为主的系统误差方能获得可靠结论。
本文采用PCR方法从人基因组中扩增出了1888 bp的p-selectin启动子序列,将其克隆到空载体pGL3-Ba-sic的多克隆位点(MCS)中,其下游为Luciferase的表达序列,成功地构建了pGL3-p-selectin-promoter表达载体,并与含海肾荧光素酶的内参质粒pRL-SV40共转染到293F细胞中,通过检测荧光素酶的表达量反映启动子序列的活性,间接反映p-selectin基因在细胞中的转录表达水平,并验证其活性。荧光素酶启动子区域的截短表达实验证实了pGL3-1826 bp表达载体构建的重要性。pGL3-p-selectin-promoter对于LPS和TNF-α刺激的上调应答符合既往研究报道[27-28],且从基因转录的层面深入解释了P选择素在炎症反应中的转录上调作用,进一步说明该报告基因的构建成功且功能正常。McEve, R.P.实验室研究证明[13],蛋白酶体抑制剂可通过激活转录因子NF-kappaB提高P选择素的转录活性,然而根据我们的实验结果并未证实这一结论。图 8数据反映了砷化物诱导P选择素表达与文献报道一致[14, 29-30],且在体外实验条件下在8 μmol/L时作用效果最强,说明砷化物可从基因转录层面增加P选择素表达,有促进血栓形成的毒性作用。炎症因子与药物的诱导刺激实验均证明,我们构建的P选择素报告基因具有快速筛选有效药物、鉴别药物活性的功能。
后续我们将以此报告基因质粒为基础通过设立多组对照实验,通过构建腺病毒显负性突变体和过表达突变体模拟信号通路激活和抑制等,研究炎症因子和信号通路蛋白在p-selectin启动子活性的表达上调/下调中的作用,探索在炎症因子诱导下p-selectin表达的具体机制。亦可通过报告基因启动子区域的截短实验探索反式作用因子在启动子区域的具体作用位点。
| [1] |
Stoppelkamp S, Veseli K, Stang K, et al. Identification of predictive early biomarkers for Sterile-SIRS after cardiovascular surgery[J].
PLoS One,2015, 10 (8) : e0135527.
DOI: 10.1371/journal.pone.0135527. ( 0) 0)
|
| [2] |
Stubljar D, Skvarc M. Effective strategies for diagnosis of systemic inflammatory response syndrome (SIRS) due to bacterial infection in surgical patients[J].
Infect Disord Drug Targets,2015, 15 (1) : 53-6.
DOI: 10.2174/1871526515666150320161804. ( 0) 0)
|
| [3] |
Rosenbloom AJ, Pinsky MR, Bryant JL, et al. Leukocyte activation in the peripheral blood of patients with cirrhosis of the liver and SIRS. Correlation with serum interleukin-6 levels and organ dysfunction[J].
JAMA,1995, 274 (1) : 58-65.
DOI: 10.1001/jama.1995.03530010072037. ( 0) 0)
|
| [4] |
Angiari S. Selectin-mediated leukocyte trafficking during the development of autoimmune disease[J].
Autoimmun Rev,2015, 14 (11) : 984-95.
DOI: 10.1016/j.autrev.2015.06.006. ( 0) 0)
|
| [5] |
Nwariaku FE, Mileski WJ, Lightfoot E, et al. Alterations in leukocyte adhesion molecule expression after burn injury[J].
J Trauma,1995, 39 (2) : 285-8.
DOI: 10.1097/00005373-199508000-00016. ( 0) 0)
|
| [6] |
Mondal N, Buffone A, Stolfa G, et al. ST3Gal-4 is the primary sialyltransferase regulating the synthesis of E-, P-, and l-selectin ligands on human myeloid leukocytes[J].
Blood,2015, 125 (4) : 687-96.
DOI: 10.1182/blood-2014-07-588590. ( 0) 0)
|
| [7] |
Muller WA. Migration of leukocytes across endothelial junctions:some concepts and controversies[J].
Microcirculation,2001, 8 (3) : 181-93.
DOI: 10.1111/micc.2001.8.issue-3. ( 0) 0)
|
| [8] |
Etulain J, Martinod K, Wong SL, et al. P-selectin promotes neutrophil extracellular trap formation in mice[J].
Blood,2015, 126 (2) : 242-6.
DOI: 10.1182/blood-2015-01-624023. ( 0) 0)
|
| [9] |
Tong H, Song J, Zhang Z, et al. Inhibitory function of P-selectin-mediated leukocyte adhesion by the polysaccharides from Sanguisorba officinalis[J].
Pharm Biol,2015, 53 (3) : 345-9.
DOI: 10.3109/13880209.2014.919597. ( 0) 0)
|
| [10] |
Pan J, Mcever RP. Characterization of the promoter for the human P-selectin gene[J].
J Biol Chem,1993, 268 (30) : 22600-8.
( 0) 0)
|
| [11] |
Li K, Li Y, Ma Z, et al. Crocin exerts anti-inflammatory and anti-catabolic effects on rat intervertebral discs by suppressing the activation of JNK[J].
Int J Mol Med,2015, 36 (5) : 1291-9.
( 0) 0)
|
| [12] |
Miyagawa T, Fujita T, Yumoto H, et al. Azithromycin recovers reductions in barrier function in human gingival epithelial cells stimulated with tumor necrosis factor-α[J].
Arch Oral Biol,2016, 62 (7) : 64-9.
( 0) 0)
|
| [13] |
Xia L, Pan J, Yao L, et al. A proteasome inhibitor, an antioxidant, or a salicylate, but not a glucocorticoid, blocks constitutive and cytokine-inducible expression of P-selectin in human endothelial cells[J].
Blood,1998, 91 (5) : 1625-32.
( 0) 0)
|
| [14] |
Lee MY, Bae ON, Chung SM, et al. Enhancement of platelet aggregation and thrombus formation by Arsenic in drinking water:a contributing factor to cardiovascular disease[J].
Toxicol Appl Pharmacol,2002, 179 (2) : 83-8.
DOI: 10.1006/taap.2001.9356. ( 0) 0)
|
| [15] |
Burns AR, Bowden RA, Abe Y, et al. P-selectin mediates neutrophil adhesion to endothelial cell Borders[J].
J Leukoc Biol,1999, 65 (3) : 299-306.
( 0) 0)
|
| [16] |
Vandendries ER, Furie BC, Furie B. Role of P-selectin and PSGL-1 in coagulation and thrombosis[J].
Thromb Haemost,2004, 92 (3) : 459-66.
( 0) 0)
|
| [17] |
Fosbrink M, Niculescu F, Rus V, et al. C5b-9-induced endothelial cell proliferation and migration are dependent on Akt inactivation of forkhead transcription factor FOXO1[J].
J Biol Chem,2006, 281 (28) : 19009-18.
DOI: 10.1074/jbc.M602055200. ( 0) 0)
|
| [18] |
Takano M, Meneshian A, Sheikh E, et al. Rapid upregulation of endothelial P-selectin expression via reactive Oxygen species Generation[J].
Am J Physiol Heart Circ Physiol,2002, 283 (5) : H2054-61.
DOI: 10.1152/ajpheart.01001.2001. ( 0) 0)
|
| [19] |
Fialkow L, Wang Y, Downey GP. Reactive Oxygen and Nitrogen species as signaling molecules regulating neutrophil function[J].
Free Radic Biol Med,2007, 42 (2) : 153-64.
DOI: 10.1016/j.freeradbiomed.2006.09.030. ( 0) 0)
|
| [20] |
Jin H, Gebska MA, Blokhin IO, et al. Endothelial PPAR-γ protects against vascular thrombosis by downregulating P-selectin expression[J].
Arterioscler Thromb Vasc Biol,2015, 35 (4) : 838-44.
DOI: 10.1161/ATVBAHA.115.305378. ( 0) 0)
|
| [21] |
Diaz JA, Wrobleski SK, Alvarado CM, et al. P-selectin inhibition therapeutically promotes thrombus resolution and prevents vein wall fibrosis better than enoxaparin and an inhibitor to von Willebrand factor[J].
Arterioscler Thromb Vasc Biol,2015, 35 (4) : 829-37.
DOI: 10.1161/ATVBAHA.114.304457. ( 0) 0)
|
| [22] |
Guo SW, Ding D, Geng JG, et al. P-selectin as a potential therapeutic target for endometriosis[J].
Fertil Steril,2015, 103 (4) : 990-1000.
DOI: 10.1016/j.fertnstert.2015.01.001. ( 0) 0)
|
| [23] |
Gremmel T, Koppensteiner R, Kaider A, et al. Impact of variables of the P-selectin-P-selectin glycoprotein ligand-1 axis on leukocyte-platelet interactions in cardiovascular disease[J].
Thromb Haemost,2015, 113 (4) : 806-12.
( 0) 0)
|
| [24] |
刘志锋, 姜勇. 报告基因技术的理论基础及其应用[J].
生理科学进展,2002, 33 (4) : 361-3.
( 0) 0)
|
| [25] |
龚梦嘉, 周建武, 毕杨. AP2α荧光素酶报告基因的构建及在BMPs诱导成骨分化研究中的应用[J].
南方医科大学学报,2013 (11) : 1571-6.
( 0) 0)
|
| [26] |
高兴, 蔡云, 辛海明, 等. 人Bax启动子荧光素酶报告基因的构建和鉴定[J].
肿瘤学杂志,2009, 15 (1) : 46-9.
( 0) 0)
|
| [27] |
Griffin GK, Newton G, Tarrio ML, et al. IL-17 and TNF-α sustain neutrophil recruitment during inflammation through synergistic effects on endothelial activation[J].
J Immunol,2012, 188 (12) : 6287-99.
DOI: 10.4049/jimmunol.1200385. ( 0) 0)
|
| [28] |
Pircher J, Merkle M, W?rnle M, et al. Prothrombotic effects of tumor necrosis factor alpha in vivo are amplified by the absence of TNF-alpha receptor subtype 1 and require TNF-alpha receptor subtype 2[J].
Arthritis Res Ther,2012, 14 (5) : R225.
DOI: 10.1186/ar4064. ( 0) 0)
|
| [29] |
Mukherjee B, Bindhani B, Saha H, et al. Platelet hyperactivity, neurobehavioral symptoms and depression among Indian women chronically exposed to low level of Arsenic[J].
Neurotoxicology,2014, 45 (9) : 159-67.
( 0) 0)
|
| [30] |
Ma Y, Niu R, Sun Z, et al. Inflammatory responses induced by fluoride and Arsenic at toxic concentration in rabbit aorta[J].
Arch Toxicol,2012, 86 (6) : 849-56.
DOI: 10.1007/s00204-012-0803-9. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
