2. 暨南大学附属第一医院肿瘤科,广东 广州 510630
2. Department of Oncology, First Affiliated Hospital of Jinan University, Guangzhou 510630, China
骨肉瘤是一种常见的骨原发恶性肿瘤,起源于间叶组织恶性程度高[1]。好发于青少年,约75%的患者年龄在15~25岁之间,男性比女性发病率略高;骨肉瘤多发于长骨干,80%~90%发生与股骨、腔骨等,发生在手和足等四肢末端的不到1%[2-3]。骨肉瘤最主要的治疗方式包括外科切除结合放化疗[1, 4]。但是骨肉瘤患者预后很差,转移或者复发的患者长期生存率仍低于20%[5]。因此,了解骨肉瘤侵袭和转移的分子机制将有助于开发新的预后分子生物标记物和靶向治疗药物。
MicroRNA(miRNA)是一类存在于多种生物体中可调控基因表达的内源性非编码小分子RNA,长约19~25个核苷酸,其和骨肉瘤的发生发展以及耐药性有着密切的关系[6-7]。miR-181b是miRNA的一种,在骨肉瘤中高表达且和骨肉瘤的转移有着密切关系[8],但是其具体作用以及机制还不清楚。为了更好的确定miR-181b在骨肉瘤发展中的作用,我们将研究miR-181b在骨肉瘤细胞中的表达以及通过抑制miR-181b的表达对骨肉瘤细胞迁移以及侵袭的影响,并对miR-181b调控骨肉瘤细胞迁移以及侵袭的机制进行初步的探讨,为骨肉瘤的靶向治疗提供新的理论依据。
1 材料和方法 1.1 细胞培养以及转染人正常成骨细胞系hFOB 1.19和骨肉瘤细胞系MG-63、Saos2和HOS均购自中科院上海细胞研究所。人正常成骨细胞系hFOB 1.19采用F12培养基与无酚红的DEME按1 :1混合并加入10%胎牛血清和0.3 mg/mL的G418培养,培养条件为34 ℃,5% CO2。骨肉瘤细胞MG-63、Saos2和HOS细胞在含有10%胎牛血清、100 U/mL penicillin G和100 μg/mL streptomy-cin的RPMI-1640培养基中进行培养;培养条件为37 ℃,5% CO2。当细胞融合度大约为80%时用胰酶消化传代。将对数生长期骨肉瘤细胞种植于6孔培养板中(每孔大约1X105细胞),第2天观察细胞融合度大约为50%并开始进行转染。miR-181b抑制剂(miR-181b inhibitor)和miR-NC购自上海吉玛制药技术有限公司。NDRG2(NM_016250)干扰小RNA(si-NDRG2)以及对照组(si-NC)购自Santa Cruz Biotechnology。NDRG2野生型3'-UTR和突变型3'-UTR由苏州金唯智合成并连接到psi-CHECK-2载体。采用Lipo-fectamine 2000分别转染300 nMmiR-NC、miR-181b inhibitor到骨肉瘤细胞,或者共转染300 nM miR-375 mimics和10 μM si-NDRG2或者si-NC到骨肉瘤细胞,转染步骤参照Invitrogen说明书。
1.2 实时荧光定量PCR检测mRNA表达(qRT-PCR)收集细胞样品,加入1 mL Trizol提取液提取细胞总RNA。颈环法反转录得到cDNA,取1 μL cDNA样品用于miR-210检测;SYBR Green法进行PCR检测。miR-210及内参U6 PCR引物购自广州锐博生物科技有限公司,PCR扩增条件为: 94 ℃预变性5 min,然后94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min 30 s进行40个循环。每个样重复3次。检测引物如表 1。
| 表 1 qRT-PCR检测引物序列 Table 1 Primer sequence of qRT-PCR |
培养的细胞吸净培养液后,直接加入细胞裂解液,在冰上充分裂解后吸出裂解液。BCA法测定总蛋白浓度,SDS-PAGE电泳分离蛋白,电泳结束后取出分离胶,转膜夹内从正极到负极依次是海绵-滤纸-PVDF膜-分离胶-滤纸-海绵,排出干扰气泡,加入转膜缓冲液,恒定电流0.5A转膜2 h。室温下,将PVDF膜放入5%脱脂奶粉中封闭1 h。然后将PVDF膜放入10 mL稀释过的一抗(1 : 2000)中4 ℃过夜。去除一抗,30 mL 1×TBST洗膜3次,每次5 min。加入10 mL稀释的辣根过氧化物酶标记的二抗(1 : 5000),室温孵育2 h。30 mL 1×TBST洗膜3次,每次5 min。暗室曝光。
1.4 迁移和侵袭检测骨肉瘤细胞迁移检测:将Transwell侵袭小室置入24孔板中,在Transwell小室的下室加入含10% FBS的DMEM高糖培养液,收集转染后的骨肉瘤细胞重悬,加入200 μL重悬液共5×104细胞到Transwell小室的上室;细胞培养24 h,取出小室,用棉签将上室内部擦干净,小室的下表面用PBS浸泡清洗。首先以4%多聚甲醛溶液固定细胞,然后0.1%结晶紫染色液染色,自来水冲洗3次,显微镜下拍照,并随机选取6个不同区域,计算每个视野内穿过滤膜的细胞数量的细胞数,取平均数为侵袭细胞数。骨肉瘤的侵袭检测:首先在孔径为8 μm的Transwell侵袭小室微孔膜表面均勾涂抹20 μL浓度为0.5 g/L Matrigel人工基质胶,37 ℃放置30 min使其聚成凝胶状。其余操作步骤同迁移检测。
1.5 生物信息学分析miR-181b使用预测软件Targetscan(http://www. targetscan.org)和miRanda(http://www.microrna.org/ microrna/home.do)进行靶基因预测。为了确定NDRG2 mRNA的3'-UTR是否为miR-181b的直接靶蛋白,NDRG2 mRNA的野生型全长3'-UTR以及突变型3'-UTR扩增并连接到psi-CHECK-2载体(Promega,美国),分别命名为NDRG2-WT和NDRG2-MUT。引物序列表 2所示。MG-63细胞共转染200 nmol/L miR-NC或者miR-181b模拟物和100 ng质粒(NDRG2-WT或者NDRG2-MUT),24孔板培养48 h。收集细胞裂解,海肾(Renilla)和萤火虫(firefly)荧光素酶荧光强度使用Dual-Luciferase报告分析系统(Promega)进行分析。
1.6 统计学分析采用SPSS 19.0统计软件进行分析,计数资料以%表示,采用χ2检验;计量资料采用均数±标准差表示,组间对比采用配对t检验,非正态分布资料或方差不齐,采用秩和检验。以P < 0.05为差异具有统计学意义。
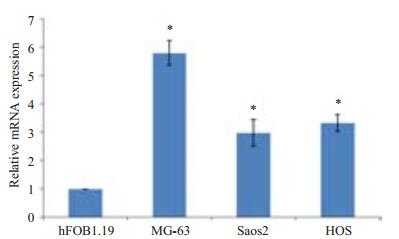
2 结果 2.1 miR-181b在骨肉瘤细胞中的表达采用qRT-PCR检测细胞中miR-181b的mRNA表达水平,结果发现hFOB 1.19、MG-63、Saos2和HOS细胞中miR-181b的相对表达量为1.00±0.00,5.80±0.44,2.98±0.47和3.33±0.30。和人正常成骨细胞系hFOB 1.19相比,骨肉瘤细胞系MG-63、Saos2和HOS中miR-181b的mRNA表达差异显著,具有统计学意义(P < 0.05,图 1)。其中MG-63中miR-181b的mRNA表达水平最高,后续实验采用MG-63细胞进行实验。
|
图 1 MiR-181b mRNA相对表达量 Figure 1 miR-181b mRNA expression in 3 osteosarcoma cell lines relative to that in a normal ostoblast cell line. *P < 0.05 vs hFOB 1.19 cells. |
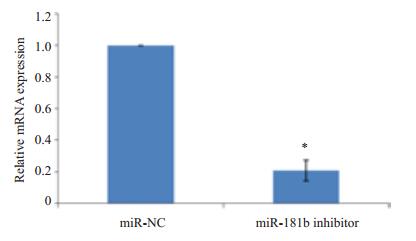
miR-NC和miR-181b inhibitor转染24 h后采用qRT-PCR检测miR-181b的相对表达量(图 2)。MiR-NC组和miR-181b inhibitor组miR-181b的相对表达量分别为1.00±0.00和0.21±0.07。和miR-NC组相比,miR-181b inhibitor组miR-181b的相对表达明显减少,差异显著具有统计学意义(P < 0.05,图 2)。miR-181b inhibitor能够显著抑制miR-181b的表达,转染成功,可以用于后续实验。
|
图 2 miR-181b inhibitor对miR-181b表达的影响 Figure 2 Effect of miR-181b inhibitor on miR-181b expression in MG-63 cells. *P < 0.05 vs miR-NC. |
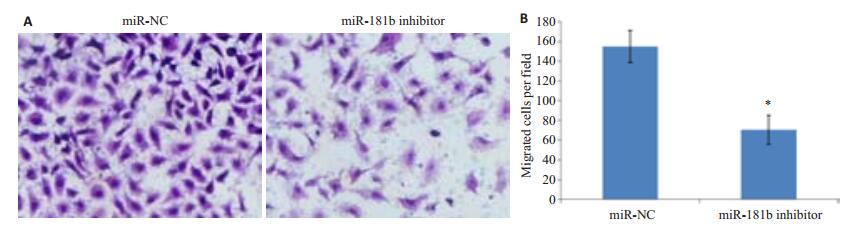
MiR-NC和miR-181b inhibitor转染48 h后采用Transwell检测MG-63细胞的迁移能力,代表图如图 3A所示。miR-NC组和miR-181b inhibitor组miR-181b的迁移细胞数分别155±16和71±15。和miR-NC组相比,miR-181b inhibitor组迁移细胞数明显减少,差异显著具有统计学意义(P < 0.05,图 3)。抑制miR-181b的表达能够抑制骨肉瘤细胞的迁移。
|
图 3 抑制miR-181b表达能够抑制MG-63细胞的迁移 Figure 3 Inhibition of miR-181b expression suppresses migration of MG-63 cells. A: Microscopic observation of MG-63 cell migration; B: Statistics of migrating cell number per field. *P < 0.05 vs miR-NC. |
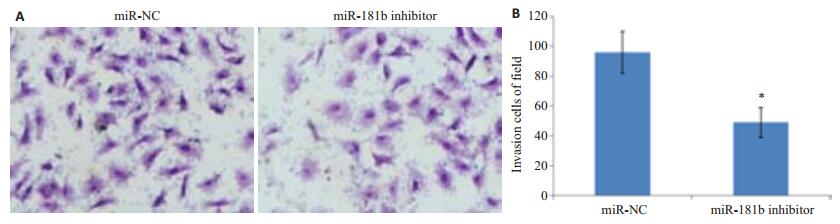
MiR-NC和miR-181b inhibitor转染48 h后采用Transwell检测MG-63细胞的侵袭能力,代表图如图 4A所示。MiR-NC组和miR-181b inhibitor组的侵袭细胞数分别96±14和49±10。和miR-NC组相比,miR-181b inhibitor组的侵袭细胞数明显减少,差异显著具有统计学意义(P < 0.05,图 4)。抑制miR-181b的表达能够抑制骨肉瘤细胞的侵袭。
|
图 4 miR-181b inhibitor对MG-63细胞侵袭的影响 Figure 4 Inhibition of miR-181b expression suppresses invasion of MG-63 cells. A: Microscopic observation of MG-63 cell invasion; B: Statistics of invading cells per field. *P < 0.05 vs miR-NC. |
通过软件预测发现NDRG2可能是miR-181b的一个靶基因(图 5A)。通过Western Blotting检测发现NDRG2在hFOB 1.19、MG-63、Saos2和HOS的相对表达量分别为1.00±0.00、0.14±0.02、0.33±0.05和0.22±0.04,(图 5B、C)。miR-181b和NDRG2的表达趋势相反,在MG-63细胞中表达量最小。所以假设在骨肉瘤细胞中NDRG2为miR-181b靶基因。
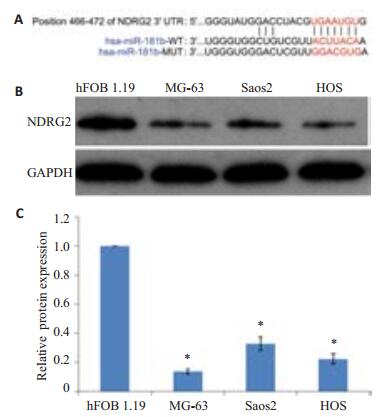
|
图 5 NDRG2在骨肉瘤细胞中的表 Figure 5 Expression of NDRG2 in the osteosarcoma cells. A: A predicted duplex formation between wild-type or mutant NDRG2 3'-UTR and miR-181b; B, C: Western blot results showing NDRG2 protein expression levels in osteosarcoma cell lines. *P < 0.05 vs hFOB 1.19 cells. |
为了证明NDRG2是否为miR-181b的靶基因,采用双荧光素酶报告基因检测(图 6A)。NDRG2-WT+ miR-NC组和NDRG2-WT+ miR 181b组的荧光活性变化倍数分别为1.54±0.23和0.44±0.12,两者相比差异显著具有统计学意义(P < 0.05)。NDRG2-MUT+miR-NC以及NDRG2-MUT+miR 181b组的荧光活性变化倍数分别为1.33±0.23和1.30±0.26,两者相比无统计学差异(P>0.05)。同时采用qRT-PCR检测NDRG2-WT+miR-NC组和NDRG2-WT+ miR 181b组的NDRG2 mRNA分别为1.00±0.00和0.93±0.12,两者相比差异不显著没有统计学意义(P>0.05)。同时采用Western blotting检测检测NDRG2-WT + miR-NC组和NDRG2-WT+ miR 181b组的NDRG2 mRNA发现两者相比差异显著具有统计学意义(P < 0.05,图 6B,C)。以上数据说明NDRG2的3'-UTR区上的位点都可以与miR-181b结合,miR-181b与其靶基因NDRG2存在直接调控关系。
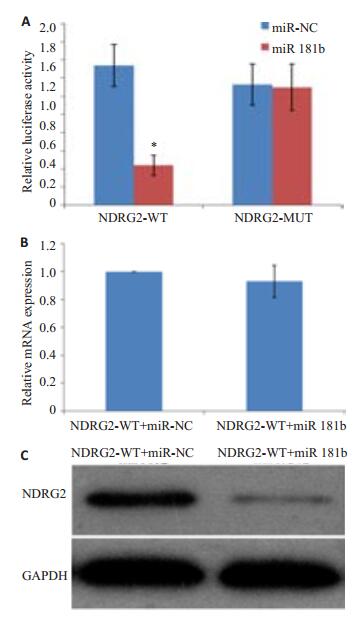
|
图 6 验证NDRG2是miR-181b直接作用的靶基因 Figure 6 NDRG2 is a direct target of miR-181b. A: Luciferase activity of wild-type (3'-UTR-Wild) or mutant (3'-UTR-Mutant) NDRG2 3'-UTR containing reporters in MG-63 cells transfected with miR-181b mimics or miR-NC; B: qRT-PCR of PDGF-A mRNA in UM1 cells transfected with miR-375 mimics or miR-NC; C: Western blotting results. *P < 0.05 vs miR-NC. |
miR-181b inhibitor和si-NDRG2(或者si-NC)共转染48 h后采用Transwell检测MG-63细胞的迁移()图 7A)。miR-181b inhibitor+si-NC组和miR-181b inhibi-tor+si-NDRG2组的迁移细胞数分别49±9和117±21。和miR-181b inhibitor+si-NC组相比,miR-181b inhibi-tor+si-NDRG2组miR-181b的迁移细胞数明显减少,差异显著具有统计学意义(P < 0.05,图 7B)。抑制NDRG2的表达能够逆转miR-181b inhibitor造成的迁移抑制。
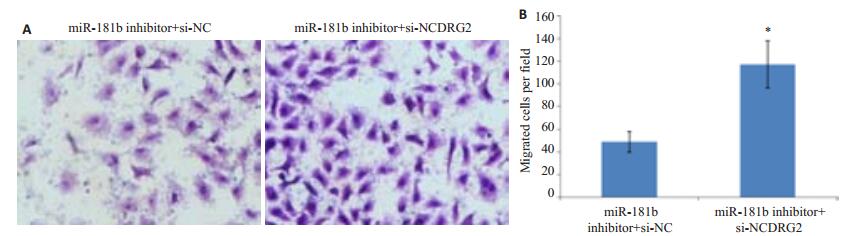
|
图 7 抑制NDRG2的表达对MG-63细胞迁移的影响 Figure 7 Effects of PDGF-A silencing on MG-63 cell migration after transfection with miR-181b. A: MG-63 cell migration measured using a transwell assay 48 h after transfection with miR-181b inhibitor plus si-NC or si-NDRG2; B: Average number of migrating cells per field. *P < 0.05 vs miR181b inhibitor+si-NC. |
miR-181b inhibitor和si-NDRG2(或者si-NC)共转染48 h后采用Transwell检测MG-63细胞的迁移()图 8A)。miR-181b inhibitor+si-NC组和miR-181b inhib-itor+si-NDRG2组侵袭细胞数分别155±16和71±15。和miR-181b inhibitor+si-NC组相比,miR-181b inhibi-tor+ si-NDRG2组的侵袭细胞数明显减少,差异显著具有统计学意义(P < 0.05,图 8B)。抑制NDRG2的表达能够逆转miR-181b inhibitor造成的侵袭抑制。
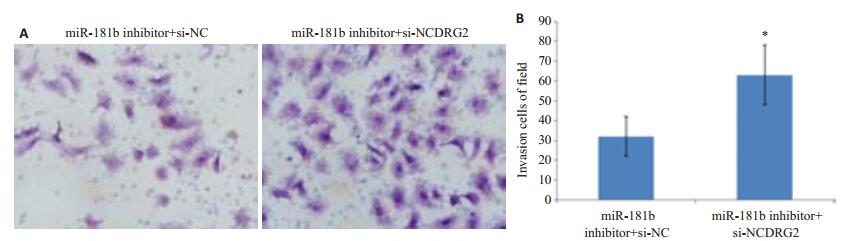
|
图 8 抑制NDRG2的表达对MG-63细胞侵袭的影响 Figure 8 Effect of PDGF-A silencing on MG-63 cell invasion after the transfection with miR-181b. A: MG-63 invasion measured by Matrigel invasion assay 48 h after transfection with miR-181b inhibitor plus si-NC or si-NDRG2; B: Average number of invading cells per field. *P < 0.05 vs miR181b inhibitor+si-NC. |
miR-181在小鼠胸腺、脑、肺等器官中高表达,骨髓和脾脏中也可检测到它的表达[9]。miR-181b属于miR-181家族,其在非小细胞肺癌(NSCLC)、星形细胞瘤中表达量了显著降低[10-11];但是在甲状腺乳头状腺癌,乳腺癌中表达量显著升高[12-13]。本研究结果表明在骨肉瘤细胞中miR-181b的表达显著提高,和Jones等研究结果相似,Jones KB研究结果表明miR-181b在骨肉瘤组织中高表达[8]。
miR-181b在肿瘤的发生发展以及耐药中有着广泛的作用。研究表明,Bresin等[14]研究表明在慢性淋巴细胞白血病(CLL),过表达miR-181b能够减少降低TCL1,Bcl2和Mcl1抗凋亡蛋白的表达,降低Akt和Erk1/2蛋白的磷酸化,显著诱导CLL细胞凋亡,从而抑制白血病细胞扩张和提高治疗小鼠的生存。Li等[12]研究发现miR-181b在甲状腺乳头状腺癌中表达显著升高,下调miR-181b的表达能够显著上调靶基因CYLD的表达,从而抑制甲状腺乳头状腺癌的增殖,促进其凋亡。Wang等[10]研究发现miR-181 b在NSCLC中A549/DDP细胞表达水平低与在A549细胞中的表达水平,miR-181b能够通过靶向调控TGFβR1/Smad信号通路抑制NSCLC的化学耐药性。Sochor等[15]研究表明miR-181b在乳腺癌组织以及血清中高表达,和预后不良密切相关,具有促癌作用。Zheng等[13]发现miR-181b在乳腺癌患者的血清以及乳腺癌细胞系中过表达,在乳腺癌阿霉素耐药株中表达量更高,研究发现miR-181b通过靶向直接调节Bim的表达促进乳腺癌的发展以及化疗耐药性。以上结果表明在不同的肿瘤中miR-181b发挥不同的作用,但是miR-181b的差异表达和肿瘤的发生发展以及耐药中有着广泛的联系。本研究表明抑制miR-181b的表达能够显著降低骨肉瘤细胞的迁移和侵袭,说明miR-181b在这里发挥促癌基因的作用,和在乳腺癌以及甲状腺乳头状腺癌的作用类似[12-13]。
本研究通过生物信息学分析发现NDRG2为miR-181b的靶基因。NDRG2为抑癌基因,在肿瘤中的表达显著下调,与肿瘤的发生、发展和转归密切相关。研究表明NDRG2能够作为星形细胞瘤、胃癌等预后的标志[16-17]。Golestan等[18]研究发现过表达NDRG2能够抑制MMP-9的表达从而结肠癌细胞的增殖、迁移和侵袭。Kim MJ等[19]研究表明NDRG2过表达能够下调cox-2表达,抑制NF-κB信号通路乳腺癌细胞的抑制细胞迁移和入侵。本研究通过WB分析NDRG2在骨肉瘤中的表达显著下调,说明NDRG2在骨肉瘤中表达异常,同时通过qRT-PCR和WB分析发现抑制miR-181b能够提高NDRG2的表达。进一步研究发现,抑制miR-181b的同时抑制NDRG2的表达能够显著提高骨肉瘤细胞的迁移和侵袭,该结果表明抑制miR-181b表达对骨肉瘤迁移和侵袭造成显著的抑制,而抑制miR-181b的同时抑制NDRG2的表达能够逆转该影响。该结果说明NDRG2发挥抑癌作用,和前人的研究结果类似[20]。而miR-181b能够抑制NDRG2的表达,发挥促癌作用。
总之,本研究表明miR-181b在骨肉瘤细胞中高表达,NDRG2为miR-181b直接作用的靶基因,抑制miR-181b能够促进NDRG2的表达从而抑制骨肉瘤的迁移和侵袭,该研究为骨肉瘤的治疗提供新的靶点和思路。
| [1] |
Picci P. Osteosarcoma (osteogenic sarcoma)[J].
Orphanet J Rare Dis,2007 (4) : 618-32.
( 0) 0)
|
| [2] |
Mirabello L, Troisi RJ, Savage SA. Osteosarcoma incidence and survival rates from 1973 to 2004: data from the Surveillance, Epidemiology, and End Results Program[J].
Cancer,2009, 115 (7) : 1531-43.
DOI: 10.1002/cncr.v115:7. ( 0) 0)
|
| [3] |
Ottaviani G, Jaffe N. The epidemiology of osteosarcoma[J].
Cancer Treat Res,2009 (152) : 3-13.
( 0) 0)
|
| [4] |
Heare T, Hensley M. Dell'orfanoS.bonetumors:osteosarcoma and ewing's sarcoma[J].
CurrOpinPediatr,2009, 21 (3) : 365-72.
( 0) 0)
|
| [5] |
Weeden S, Grimer RJ, Cannon SR, et al. The effect of local recurrence on survival in resected osteosarcoma[J].
Eur J Cancer,2001, 37 (1) : 39-46.
DOI: 10.1016/S0959-8049(00)00362-2. ( 0) 0)
|
| [6] |
Li X, Chen L, Wang W, et al. MicroRNA-150 Inhibits Cell Invasion and Migration and Is Downregulated in Human Osteosarcoma[J].
Cytogenet Genome Res,2015, 146 (2) : 124-35.
DOI: 10.1159/000437379. ( 0) 0)
|
| [7] |
Lu T, Zhang C, Chai MX, et al. miR-374a promotes the proli-feration of osteosarcoma cell proliferation by targeting Axin2[J].
Int J Clin Exp Pathol,2015, 8 (9) : 10776-83.
( 0) 0)
|
| [8] |
Jones KB, Salah Z, Del Mare S, et al. miRNA signatures associate with pathogenesis and progression of osteosarcoma[J].
Cancer Res,2012, 72 (7) : 1865-77.
DOI: 10.1158/0008-5472.CAN-11-2663. ( 0) 0)
|
| [9] |
Chen CZ, Li L, Lodish HF, et al. MicroRNAs modulate hemato-poietic lineage differentiation[J].
Science,2004, 303 (5654) : 83-6.
DOI: 10.1126/science.1091903. ( 0) 0)
|
| [10] |
Wang X, Chen X, Meng Q, et al. MiR-181b regulates cisplatinc-hemosensitivity and metastasis by targeting TGFβR1/Smad signaling pathway in NSCLC[J].
Sci Rep,2015, 5 : 17618.
DOI: 10.1038/srep17618. ( 0) 0)
|
| [11] |
Zhi F, Wang Q, Deng D, et al. MiR-181b-5p downregulates NOVA1 to suppress proliferation, migration and invasion and promote apoptosis in astrocytoma[J].
PLoS One,2014, 9 (10) : e109124.
DOI: 10.1371/journal.pone.0109124. ( 0) 0)
|
| [12] |
Li D, Jian W, Wei C, et al. Down-regulation of miR-181b promotes apoptosis by targeting CYLD in thyroid papillary cancer[J].
Int J Clin Exp Pathol,2014, 7 (11) : 7672-80.
( 0) 0)
|
| [13] |
Zheng Y, Lv X, Wang X, et al. miR-181b promotes chemoresistance in breast cancer by regulating Bim expression[J].
Oncol Rep,2016, 35 (2) : 683-90.
( 0) 0)
|
| [14] |
Bresin A, Callegari E, D'abundo L, et al. miR-181b as a therapeutic agent for chronic lymphocytic leukemia in the Eμ-TCL1 mouse model[J].
Oncotarget,2015, 6 (23) : 19807-18.
DOI: 10.18632/oncotarget. ( 0) 0)
|
| [15] |
Sochor M, Basova P, Pesta M, et al. Oncogenic microRNAs: miR-155, miR-19a, miR-181b, and miR-24 enable monitoring of early breast cancer in serum[J].
BMC Cancer,2014, 14 : 448.
DOI: 10.1186/1471-2407-14-448. ( 0) 0)
|
| [16] |
Li L, Wang J, Shen X, et al. Expression and prognostic value of NDRG2 in human astrocytomas[J].
J Neurol Sci,2011, 308 (1-2) : 77-82.
DOI: 10.1016/j.jns.2011.06.007. ( 0) 0)
|
| [17] |
Ling ZQ, Ge MH, Lu XX, et al. Ndrg2 promoter hypermethylation triggered by helicobacter pylori infection correlates with poor patients survival in human gastric carcinoma[J].
Oncotarget,2015, 6 (10) : 8210-25.
DOI: 10.18632/oncotarget. ( 0) 0)
|
| [18] |
Golestan A, Mojtahedi Z, Ghalamfarsa G, et al. The effects of NDRG2 overexpression on cell proliferation and invasiveness of SW48 colorectal cancer cell line[J].
Iran J Med Sci,2015, 40 (5) : 430-9.
( 0) 0)
|
| [19] |
Kim MJ, Kim HS, Lee SH, et al. NDRG2 controls COX-2/PGE2-mediated breast cancer cell migration and invasion[J].
Mol Cells,2014, 37 (10) : 759-65.
( 0) 0)
|
| [20] |
Hu W, Fan C, Jiang P, et al. Emerging role of N-myc downstream-regulated gene 2 (NDRG2) in cancer[J].
Oncotarget,2015 .
DOI: 10.18632/oncotarget.6228. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
