2. 新乡医学院三全学院,河南 新乡 453003
2. Sanquan College, Xinxiang Medical University, Xinxiang 453003, China
二噁英是一类毒性极高、结构和性质相似的持久性环境污染物的总称,包括多氯代二苯并二噁英和多氯代二苯并呋喃,其极难溶于水,易在环境中及生物体内富集[1]。二噁英因其生殖毒性、致癌性、肝毒性、免疫毒性等对人类的健康造成很大的威胁而备受关注,在这些毒性效应中,生殖毒性已成为近年来人们关注的研究热点[2-4]。二噁英能够影响睾丸的发育、精子的活力及子代发育等[5-7]。
2,3,7,8-四氯代二苯并二噁英是迄今为止人类已知的毒性最强的化合物,有“毒中之王”的称号,因此受到人们的高度关注,且对其毒性效应的研究较多。虽然八氯代二苯并二噁英(1,2,3,4,6,7,8,9-Octachlorodibenzo-p-dioxin,简称OCDD)的毒性较小,但其环境分布更为广泛,含量更多,逐渐成为危害人类的潜在杀手。目前,对其研究的报道较少,本课题组研究了OCDD对肝脏及心脏的影响[8-9]。随着环境污染越来越严重,男性精子数量和质量明显下降,不育症的发病率在逐年增加,类雌激素作用的二噁英类化合物在其中所产生的影响不容忽视。
因此,本研究利用基因芯片技术分析不同浓度OCDD暴露后引起基因表达谱的变化,为探讨OCDD对雄性生殖毒性的机制及毒性分子靶标的探寻提供了重要的依据。
1 材料和方法 1.1 试剂OCDD标准品(批号为3268-87-9,浓度为98.2%,美国Accu Standard公司)。
1.2 仪器小鼠全基因表达谱芯片(包含全部小鼠基因组信息,共41 253条小鼠基因,美国安捷伦公司)、2100型芯片生物分析仪(美国安捷伦公司)、G2545A型扫描仪(美国安捷伦公司)。
1.3 实验动物及分组7~8周龄SPF级C57BL/6j雄性小鼠20只,体质量为(25±3)g,购自苏州爱尔麦科技有限公司,动物合格证号SCXK(苏)2009-0001。随机分为低(1.25×10-6 g/mL)、中(1.25×10-5 g/mL)、高剂量(1.25×10-4 g/mL)OCDD组和对照组(每组5只),对照组只给予玉米油。每天进行染毒1次,染毒容量为8 mL/kg,灌胃染毒连续30 d。动物饲养在河南省生物精神病学重点实验室,动物房合格证号SYXK(豫)2009-0002,分笼饲养,光照和黑暗各12 h,自由饮水和摄食,观察其饮食量活动、饮水量、毛发、大便等情况。
1.4 样品的制备染毒结束后,采用颈椎脱臼的方法处死试验小鼠并快速取出睾丸组织,用灭菌的DEPC水进行冲洗并放入已编号的冻存管中,然后在液氮中速冻1 h后置于-80 ℃冰箱保存备用。
1.5 基因芯片检测从睾丸组织中采用Trizol法抽提总RNA,按照试剂盒说明书的要求进行。使用QIAGENRN easy® Kit纯化总RNA。然后,使用NanodropND-1000及AgilentBioAnalyzer 2100进行总RNA质检。芯片杂交: cDNA的合成、cRNA的制备、Cy3单色荧光标记、标记产物的片段化等均按照美国安捷伦公司的基因芯片杂交标准流程进行。芯片杂交过程与数据采集由上海伯豪生物技术有限公司芯片杂交平台完成。
1.6 统计学处理基因表达信号经归一化后,各处理与对照信号值进行比对,若fold change变化的比值≥2.0为该基因表达上调,比值≤-2.0则该基因表达下调,以此筛选出每组对比中的差异表达基因。登陆上海伯豪生物公司的SAS分析系统(http://www.shanghaibiotech.com)进行数据分析。差异基因的表达趋势分析采用STEM(ShortTimeseries Expression Miner)软件进行。自组织映射聚类(self-organizing maps, SOM)分析采用Gene Spring 11.02(美国安捷伦公司)软件完成。
1.7 实时荧光定量PCR随机选择6个差异表达基因进行实时荧光定量PCR(Quantitative Real-time PCR)以验证基因芯片实验结果。所选基因及其引物详见表 1。以总RNA为模板,利用SuperScript Ⅲ reverse transcriptase(Invitrogen Corp,Carlsbad,CA,美国)合成cDNA第一条链。Quantitative Real-time PCR(qRT-PCR)按照SYBR Green Real-time PCR Master Mix试剂盒的说明操作(TAKARA)。反应程序如下:95 ℃ 5 min进行预变性;95 ℃ 10 s,58 ℃ 10 s,72 ℃ 20 s,进行40个循环。反应在ABI 7300荧光定量PCR仪上进行,设cDNA样品3次重复,利用2-△△Ct相对定量法计算相对表达量。
| 表 1 qRT-PCR所用引物 Table 1 Primers used for qRT-PCR |
研究发现,在染毒的前期,各组小鼠的饮水、进食、毛色、活动及大便等都没有明显的异常,但在染毒的中后期,发现在中、高剂量OCDD组中的部分小鼠的毛发杂乱并失去光泽,但在饮食、活动和体重等均没有明显改变(表 2)。
| 表 2 OCDD染毒对小鼠体质量的影响 Table 2 Effect of sub-chronic exposure to OCDD on body weight of the mice (g, n=20, Mean±SD) |
OCDD染毒对雄性小鼠睾丸基因表达谱的影响(表 3)。
| 表 3 OCDD染毒对雄性小鼠睾丸基因表达谱的影响 Table 3 Effect of sub-chronic exposure to OCDD on testicular gene expression profiles in male mice |
不同浓度OCDD染毒组和对照组共同的2倍以上差异表达基因为385个。生物信息学分析显示与7类功能密切相关:与分子结合(binding)相关的有203个,与催化活性(catalytic activity)相关的有78个,与分子转导活性(molecular transducer activity)相关的有34个,与运输活性(transporter activity)相关的有23个,与酶调节活性(enzyme regulator activity)相关的有17个,与转录调控因子(transcription regulator)相关的有17个,与分子结构活性(structural molecule activity)相关的有13个。根据与对照组相比,低、中、高OCDD组的基因表达变化一致,列出5个上调基因和5个下调基因(表 4)。ANKRD42、KRT78、RRAD、FAF1及芳香烃受体(aryl hydrocarbon receptor,AhR)相关的基因(Cyp2e1、Cyp2c29、Cyp11a)均上调,而CEACAM10、GPX3、Lum、TIE1及IGFBP-5发生下调。另外,还发现部分基因如脂肪细胞型脂肪酸结合蛋白基因(FABP4)、脂蛋白脂酶(LPL)及钙粘蛋白16(CDH16)等,在低浓度OCDD时表达发生下调,在中浓度和高浓度时表达上调。
| 表 4 差异表达基因 Table 4 Differentially expressed genes |
为检验基因芯片检测结果的准确性,在差异表达基因中,随机挑选了3个上调和3个下调基因作为验证基因,进行qRT-PCR的验证。结果表明基因芯片技术对基因表达检测的准确性较高(图 1)。
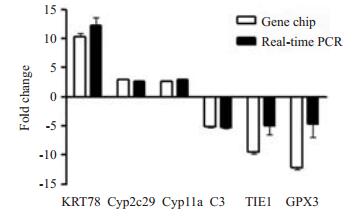
|
图 1 Real-time PCR鉴定的结果 Figure 1 Real-time PCR results. |
本研究发现,OCDD各个浓度组均可导致睾丸基因改变,各实验组与对照组共同差异基因2倍以上达385个,说明OCDD对小鼠睾丸有一定影响,和先前报道的OCDD为一种无毒性的化合物结果不一致[10],但这种影响是OCDD直接作用于睾丸所致,或有其它旁分泌路径还不清楚。与对照组相比,低剂量组基因数量改变较多,改变基因数量多达1133个,而在中、高剂量组中,基因的改变数量减少,我们推测有可能是由于毒物的兴奋效应所致,现在普遍认为毒物兴奋效应是生物体的一种适应性反应[10],即在致毒因素的不同剂量或强度范围,生物具有不同的剂量-反应关系。一般将毒物兴奋效应定义为化学物对生物体在高剂量时表现负面影响,但在低剂量时却表现为有益作用的现象[11]。因此,研究有毒有害因素对基因组表达谱的影响,对于深入探讨环境因素毒性作用的分子机理及其防护有重要价值。
采用基因芯片技术研究OCDD暴露引起的小鼠睾丸基因表达谱的变化,发现了大量的差异表达基因。结果显示,OCDD对小鼠睾丸基因表达的影响是复杂的。目前为止,已知的二噁英等芳香烃化合物对机体的作用机制主要是通过细胞质内的芳香烃受体(AhR)介导。当芳香烃类化合物作用于细胞后,其通过被动扩散的方式进入胞浆,并和AhR结合后进入细胞核,同芳香烃受体核转位蛋白(Arnt)共同作用于DNA共有序列外源性反应元件序列(XRE),从而上调下游目的基因的表达,如细胞色素P4501A1和谷胱甘肽-S-转移酶[4]等。芳香烃类化合物对机体的毒性作用可能是由于AhR-Arnt复合物改变了基因的转录。先前研究TCDD的心脏影响发现,TCDD可增加胎鼠心肌中AhR下游基因Cyp1A1、Cyp1B1、AhR阻抑物(Ahrr)、UDP葡萄糖转移酶(Ugt1a6)和乙醛还原酶3(Adh-3)的表达[12],但受AhR调节的Cyp1a2、谷胱甘肽-S-转移酶Ya(Gstal)和NAD(P)H醌氧化还原酶(Nqol)基因表达没有改变[13]。在本研究中发现OCDD慢性暴露使AhR下游的P450相关的基因如Cyp2e1、Cyp2c29、Cyp11a均上调,而谷胱甘肽过氧化物酶GPX3发生下调,说明OCDD慢性暴露影响以P450相关基因为核心的代谢通路。
顶体反应是精子的发生过程中非常重要的一个环节。要使精子受精是必须先发生顶体反应。脂类和脂肪酸的变化是影响顶体反应的重要因素[14]。FABP4是脂肪酸结合蛋白家族成员之一,LPL是调控脂类代谢的关键基因。FABP4、LPL在精子发生、发育过程的脂肪酸动态变化中及顶体反应发挥一定的作用,从而影响精子发生和发育[15-16]。在本研究中发现FABP4、LPL在OCDD低剂量时呈下调表达,在中、高剂量时这两个基因的表达呈现上调。众所周知,TCDD毒性较强,对精子发生的危害较大,而OCDD毒性较弱,长时间低剂量暴露对生殖器官引起的毒性反应更应得到更大的关注。
OCDD暴露影响大量与精原细胞生长分化相关的基因,发现这些基因主要是涉及信号转导、基因转录及细胞凋亡等不同层次、不同功能的基因。这些基因参与多种生物学过程,具有分子结合、催化活性及运输活性等功能,形成分子调控网络。正常生理状况下,体内性激素水平维持动态平衡对维持正常生殖功能具有非常重要的作用。进一步分析数据发现,生长激素受体(GHR)、促性腺激素释放激素(GnRH)、甲状腺激素应答Spot14基因(THRSP)及绒毛膜生长激素2(CSH2)的表达在本研究中呈现差异表达。生长激素受体(GHR)、及绒毛膜生长素(CSH)、促性腺激素释放激素(GnRH)和甲状腺激素应答Spot14基因(THRSP)的表达在本研究中呈现差异表达。正常生理状况下,体内性激素水平维持动态平衡对维持正常生殖功能具有非常重要的作用。生长激素(GH)和CSH是同源激素,促进促性腺激素分泌,增加性腺对促性腺激素的敏感性[17-19]。GHR基因敲除的雄性小鼠繁殖力降低,睾酮分泌下降[20]。睾丸的功能受垂体前叶促性腺激素的调控,GnRH刺激垂体产生的LH可促进睾丸间质细胞分泌雄性激素;FSH主要作用于生精细胞和支持细胞[21-22]。提示OCDD慢性暴露可能扰乱了下丘脑-垂体-睾丸性腺轴的正常调节机制,性激素水平紊乱可能是OCDD所致异常生殖功能障碍的主要原因之一。
总之,OCDD亚慢性暴露影响了小鼠睾丸组织相关基因的表达,不同浓度的OCDD导致基因表达的差异从而有助于生殖毒性机制的理解,对毒性靶标的确定也提供了重要的科学依据。
| [1] |
杨志军, 张青, 倪余文, 等. 牡蛎和贻贝中二噁英及多氯联苯含量的对比[J].
生态环境,2004, 13 (4) : 512-4.
( 0) 0)
|
| [2] |
赵力军, 汤乃军, 刘静, 等. 亚慢性暴露于2, 3, 7, 8-四氯二苯并二噁英对Wistar雌性大鼠生殖系统的影响[J].
中国预防医学杂志,2007, 8 (4) : 374-7.
( 0) 0)
|
| [3] |
Chen X, Ma XM, Ma SW, et al. Proteomic analysis of the rat ovary following chronic low-dose exposure to 2, 3, 7, 8-tetrachloro-dibenzo-p-dioxin (TCDD)[J].
J Toxicol Environ Health A,2009, 72 (11/12) : 717-26.
( 0) 0)
|
| [4] |
Magre S, Rebourcet D, Ishaq M, et al. Gender differences in transcriptional signature of developing rat testes and ovaries following embryonic exposure to 2, 3, 7, 8-TCDD[J].
PLoS One,2012, 7 (7) : e40306.
DOI: 10.1371/journal.pone.0040306. ( 0) 0)
|
| [5] |
Dhanabalan S, Mathur PP, Latha P. TCDD and corticosterone on testicular steroidogenesis and antioxidant system of epididymal sperm in rats[J].
Toxicol Ind Health,2015, 31 (9) : 811-22.
DOI: 10.1177/0748233713475501. ( 0) 0)
|
| [6] |
Foster WG, Maharaj-Briceño S, Cyr DG. Dioxin-induced changes in epididymal sperm count and spermatogenesis[J].
Cieência saúde coletiva,2011, 16 (6) : 2893-905.
DOI: 10.1590/S1413-81232011000600027. ( 0) 0)
|
| [7] |
Dhanabalan S, Jubendradass R, Latha P, et al. Effect of restraint stress on 2, 3, 7, 8 tetrachloro dibenzo-p-dioxin induced testicular and epididymal toxicity in rats[J].
Hum Exp Toxicol,2011, 30 (7) : 567-78.
DOI: 10.1177/0960327110376548. ( 0) 0)
|
| [8] |
王耀峰, 马全祥, 袁向山, 等. 八氯代二苯并二噁英致小鼠肝脏病理损伤及Caspase-3的影响[J].
毒理学杂志,2011, 25 (5) : 350-2.
( 0) 0)
|
| [9] |
王耀峰, 陶春燕, 马全祥, 等. 八氯代二苯并二噁英对C57BL/6j雄性小鼠心肌基因表达谱的影响[J].
环境与健康杂志,2011, 28 (9) : 779-82, 封3.
( 0) 0)
|
| [10] |
Birnbaum LS, Couture LA. Disposition of octachlorodibenzo-p-dioxin (OCDD) in male rat[J].
Toxicol Appl Pharmacol,1988, 93 (1) : 22-30.
DOI: 10.1016/0041-008X(88)90022-1. ( 0) 0)
|
| [11] |
Calabrese EJ. Hormesis: changing view of the dose-response, a personal account of the history and current status[J].
Mutat Res,2002, 511 (3) : 181-9.
DOI: 10.1016/S1383-5742(02)00013-3. ( 0) 0)
|
| [12] |
Mimura J, Ema M, Sogawa K, et al. Identification of a novel mechanism of regulation of Ah (dioxin) receptor function[J].
Genes Dev,1999, 13 (1) : 20-5.
DOI: 10.1101/gad.13.1.20. ( 0) 0)
|
| [13] |
Thackaberry EA, Jiang Z, Johnson CD, et al. Toxicogenomic profile of 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin in the murine fetal heart: modulation of cell cycle and extracellular matrix genes[J].
Toxicol Sci,2005, 88 (1) : 231-41.
DOI: 10.1093/toxsci/kfi301. ( 0) 0)
|
| [14] |
金建远, 倪崖, 郑晓春, 等. 气相色谱-质谱联用分析人精子顶体反应后质膜脂肪酸的变化[J].
实用医学杂志,2008, 24 (10) : 1671-3.
( 0) 0)
|
| [15] |
Liu RZ, Li X, Godbout R. A novel fatty acid-binding protein (FABP) gene resulting from tandem gene duplication in mammals: transcription in rat retina and testis[J].
Genomics,2008, 92 (6) : 436-45.
DOI: 10.1016/j.ygeno.2008.08.003. ( 0) 0)
|
| [16] |
Nielsen JE, Lindegaard ML, Friis-Hansen L, et al. Lipoprotein lipase and endothelial lipase in human testis and in germ cell neoplasms[J].
Int J Androl,2010, 33 (1) : e207-15.
DOI: 10.1111/j.1365-2605.2009.00988.x. ( 0) 0)
|
| [17] |
Männik J, Vaas P, Rull K, et al. Differential expression profile of growth hormone/chorionic somatomammotropin genes in placenta of small-and large-for-gestational-age newborns[J].
J Clin Endocrinol Metab,2010, 95 (5) : 2433-42.
DOI: 10.1210/jc.2010-0023. ( 0) 0)
|
| [18] |
Herrera-Luna CV, Budik S, Aurich C. Gene expression of ACTH, glucocorticoid receptors, 11βHSD enzymes, LH-, FSH-, GH receptors and aromatase in equine epididymal and testicular tissue[J].
Reproduc Domest Anim,2012, 47 (6) : 928-35.
DOI: 10.1111/rda.2012.47.issue-6. ( 0) 0)
|
| [19] |
Keene DE, Suescun MO, Bostwick MG, et al. Puberty is delayed in male growth hormone receptor gene-disrupted mice[J].
J Androl,2002, 23 (5) : 661-8.
( 0) 0)
|
| [20] |
Chandrashekar V, Bartke A, Coschigano KT, et al. Pituitary and testicular function in growth hormone receptor gene knockout mice[J].
Endocrinology,1999, 140 (3) : 1082-8.
( 0) 0)
|
| [21] |
Petermann TS, Cartes A, Maliqueo M, et al. Patterns of hormonal response to the GnRH agonist leuprolide in brothers of women with polycystic ovary syndrome: a pilot study[J].
Hum Reprod,2004, 19 (12) : 2742-7.
DOI: 10.1093/humrep/deh512. ( 0) 0)
|
| [22] |
Chi X, Zhou W, Cheng J, et al. In vivo characterization of a novel GnRH (gonadotropin-releasing hormone) antagonist, LXT-101, in normal male rats[J].
Regul Pept,2006, 136 (1/3) : 122-9.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
