尽管近十年来肺结核的发病率在全球范围内有所下降,肺外结核的发病率却有逐渐上升的趋势。骨与关节结核是最主要的肺外结核类型,约占所有肺外结核的10%~11%[1-2]。目前,修复骨缺损与维持抗结核药物在病灶的有效浓度仍然是骨与关节结核治疗的两大主题。由于硬化壁等特殊结构的存在,传统的口服抗结核药物很难渗入病灶并维持有效的药物浓度。长期大量口服抗结核容易导致一系列的全身毒副作用,这也成为传统疗法所需要面对的一大难题[3-4]。
药物缓释体系作为一种新型的给药方式能在局部保持长效而稳定的药物释放,在骨与关节结核等慢性感染性疾病的治疗领域有广阔的应用前景。近年来国内外对聚乳酸(PLA)及其与羟基乙酸的共聚物(PLGA)进行了广泛而深入的研究,证明它们能有效地延长药物作用时间,提高定向性并降低毒副作用,是理想的药物缓释载体[5-7]。
骨与关节结核的患者在外科手术治疗后通常会留下残腔缺损,清创后在残腔内植入自体骨或骨替代材料有助于局部力学结构的重建并促进新生骨形成。虽然临床上最为常用的植骨材料是自体骨,但是取自体骨带来的二次手术损伤、取骨区术后的顽固性疼痛以及无法事先与抗结核缓释材料结合等原因都使得自体骨无法成为骨与关节结核理想的植入材料。传统的钙磷材料虽然可以在体内被完全降解且可以事先与抗结核缓释材料结合,但是它只有骨传导性而无诱导成骨的作用,这也限制了它在血供不丰富的区域的应用[8-9]。研究表明可吸收成骨材料相对于传统的不可吸收植入材料具有在体内逐步降解的优势,这既保证了植入缺损区的成骨材料在一开始能保证一定的机械支撑强度,又保证它在后期又不会妨碍新生组织的生长[10]。带负电荷硫酸钙/β-磷酸三钙复合骨水泥genex®是英国百赛公司生产的新型骨填充材料。相对于传统的钙磷材料,其表面独有的负电荷能对异种电荷产生定向吸附的作用,这有利于吸附聚集体液和血浆中的各种分子、蛋白和骨形成相关因子如骨形态发生蛋白等物质从而诱导骨形成[11-14]。由于其具有无毒性,易于塑形,可诱导成骨以及在生物体内能完全降解等优点[15],genex®骨粉已经被应用于临床的骨修复手术治疗[8, 11, 16-17]。考虑到genex®骨粉可以事先与抗结核药物缓释体系结合,它对骨与关节结核的治疗而言可以成为一种理想的局部植入支架材料。
本实验首次将利福平(RIF)/PLGA药物缓释系统与带负电荷硫酸钙/β-磷酸三钙复合骨水泥支架结合起来,旨在构建一种新型的局部植入抗结核成骨材料,并在验证其在体内外的缓释性能以及生物安全性,为后续的实验奠定基础。
1 材料与方法 1.1 实验动物用国内培育繁殖健康成年雄性Sprague Dawley(SD)大鼠21只,3月龄,由南方医科大学实验动物中心提供,平均体质量350~400 g。
1.2 主要材料PLGA(丙交酯/乙交酯=50:50)购买于山东省医疗器械研究所;带负电荷硫酸钙/β-磷酸三钙复合骨水泥genex®购买于英国百赛公司;利福平(RIF)粉剂购买于美国Sigma公司;甲醇及乙腈为市售色谱纯;二氯甲烷、磷酸二氢钾、枸椽酸均为市售分析纯;戊巴比妥钠由南方医科大学实验动物中心提供。
1.3 仪器设备高效液相色谱仪(SHIMADZU),HRC-C8色谱柱(shim-pack,250 mm×4.6 mm,5 μm),智能恒温磁力搅拌器(ZNCL),电动匀浆机(IKA),高速离心机(Termo),涡旋混匀器(Silent shake),扫描电子显微镜(HITACHI S-3700N),光学显微镜(Leica DM400B),电子式万能试验机(中国广州澳金工业自动化系统有限公司)。
1.4 实验方法 1.4.1 RIF/PLGA载药微球的制备采用文献介绍的单乳-溶媒挥发法制备微球并稍加改良[18]。具体方法如下:1 g PLGA与500 mg RIF充分溶于7 mL二氯甲烷后形成油相,在4 ℃下将油相缓慢滴入质量分数为2%的聚乙烯醇水溶液中并以3000 r/min搅拌3 min形成O/W乳液。常温下以900 r/min搅拌过夜挥发有机相,固化微球。将获得的悬浮液以12 000 r/min离心10 min获取微球并用PBS洗涤3次洗去微球表面药物后冷冻干燥,微球称质量后4 ℃避光保存。
1.4.2 微球包封率及载药率测定取10 mg微球溶于1 mL乙腈中并涡旋混匀10 min后静置20 min,待微球内药物充分溶解释放后以离心取上清液于紫外分光光度仪检测药物浓度,检测波长为254 nm。重复3次实验后计算微球的平均包封率及载药率。
1.4.3 缓释载药支架材料的构建分别以0%、2.5%、5%、7.5%以及10%的质量比将缓释微球与带负电荷双相骨水泥充分混合后以一定比例加入固化液,在骨水泥开始固化时将其填入高为6 mm,直径为3mm的圆柱体模具中,待缓释载药支架材料完全干燥固化后取出于4 ℃避光保存。用万能压力测试机测试各个比例的材料的抗压强度和最大压缩力并得出最佳混合比例。
1.4.4 体外缓释性能测定准确称取500 mg的RIF、RIF/PLGA微球以及复合支架材料并分别放置于分子截留量为7000~12 000的透析袋中,加入1 mL PBS后两端扎紧。将透析袋放入含有10 mL PBS的50 mL离心管中,室温下以200 r/min水平震荡并定时取样10 mL,每次取样后加入等量缓释介质。用紫外分光光度仪计算3个组中的RIF药物浓度并绘制图表。
1.4.5 动物模型的构建植入用复合支架材料均经过伽马射线消毒处理。将21只雄性SD大鼠用戊巴比妥钠(60 mg/kg)腹腔注射麻醉,待麻醉效果满意后左下肢外侧局部去毛、消毒。在无菌条件下将500 mg复合支架材料置于左侧股四头肌袋中,植入完成后逐步缝合肌肉、筋膜以及皮肤,其中3只假手术组仅做切开及肌袋造模处理而不植入复合支架材料作为对照组。在缓释材料植入后的1、3、7、14、21 d和28 d分别以腹主动脉过量取血法处死3只SD大鼠并取肌袋周围1 g肌肉以及肝脏留待后续实验使用。对照组大鼠于术后28 d处死,肌肉组织及血液样品取出后作为空白对照。
1.4.6 体内缓释性能测定将血液样本在4 ℃以4000 r/min离心10 min取血浆备用。取1 mL血浆与1 mL乙腈充分涡旋混匀1 min后离心并取上清置于高效液相色谱仪计算血药浓度。将1 g肌肉样品加入2 mL生理盐水后电动匀浆5 min,取1 mL匀浆与1 mL乙腈充分涡旋混匀后离心并取尽上清液定容至5 mL并于高效液相色谱仪计算局部药物浓度。色谱条件:流动相为甲醇:乙腈:0.075 mol/L磷酸二氢钾溶液:1 mol/L枸椽酸溶液=30:30:36:4,检测波长254 nm,流速1 mL/min,柱温25 ℃,进样量为20 μL。
1.4.7 生物相容性检测取出的肝脏用10%多聚甲醛固定后脱水石蜡包埋,HE染色后光学显微镜下观察肝脏的组织学变化。取术后不同时间点以及对照组的血清样本行血液生化指标检查,检测它们的谷丙转移酶(ALT)、谷草转移酶(AST)、血清白蛋白(ALB)和血清球蛋白(GLB)的含量变化。
1.4.8 统计学分析测定指标采用均数±标准差表示,采用SPSS 13.0统计学软件,多组间比较采用LSD-t或SNK-q检验,选用P < 0.05为统计学显著性界值。
2 结果 2.1 微球包封率及载药率本文采用直接测定法测定微球制作的包封率与载药率。首先通过紫外分光光度法以光度值(A)对药物浓度(C)进行线性回归,RIF的典型回归方程为:A=0.03549C + 0.01854,R2=0.99768,在5~80 μg/mL范围内线性良好。微球的包封率与载药率的计算公式分别是:包封率=微球中总的药物重量/制作微球时投入的药物总重量×100%,载药率=微球中药物的重量/微球的总重量×100%。经3次重复实验后计算得微球的包封率为(56.05±5.33)%,载药率为(29.80±2.88)%。
2.2 复合材料最佳混合比例当微球质量占总混合粉末质量的比例不大于7.5%时复合支架材料的抗压强度以及最大压缩力均与单纯的带负电荷硫酸钙/β-磷酸三钙复合骨水泥无统计学差异(表 1),但是当混合比例达到10%时抗压强度和最大压缩力开始下降。因此我们将制作复合支架材料的最佳混合比例定为微球:总粉末=7.5:100(m:m)。
| 表 1 不同混合比例下复合支架材料的力学性能结果 Table 1 Mechanical property of composite scaffold materials with different constituent ratios (n=6) |
单纯RIF组在第1天的累积释放率就达到87.22%,到第3天时药物基本完全释放(图 1A)。微球组与复合支架材料组的体外缓释情况较为接近,在前3 d可见药物突释,到第3天时累积释率放分别达到(51.35±2.75)%和(50.58±1.91)%,第7天开始两组的RIF释放进入平缓期。在第28天时两组的体外累积释放率分别为(94.19±5.40)%和(82.23±6.28)%。
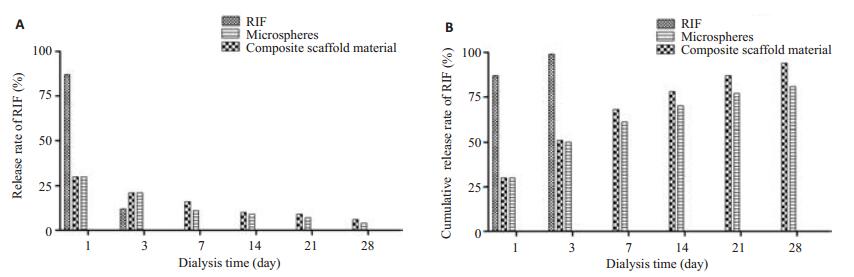
|
图 1 单纯RIF、 RIF/PLGA微球以及复合支架材料的体外缓释情况 Figure 1 In vitro release of RIP in PBS from pure RIF, RIF/PLGA microspheres and the composite scaffold material. |
在本实验的色谱条件下RIF在血浆及肌肉组织中均具有良好的分离度以及对称的峰型(图 2),出峰时间约为12 min。血浆及肌肉组织中杂峰不干扰样品测定,有较高专属性。以色谱吸收峰面积(A)对药物浓度(C)进行线性回归,RIF的典型回归方程为:A=5140.9×C-1916.4,R2=0.9997,RIF在0.625~10 μg/mL范围内线性良好。回收率及精密度分别为108.12%和8.4%(n=5)。
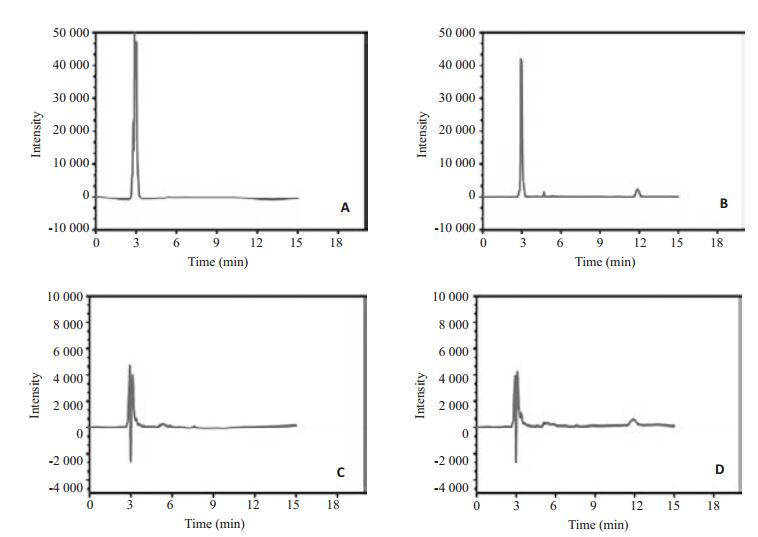
|
图 2 RIF肌肉及血浆HPLC测定色谱图 Figure 2 High-performance liquid chromatograms of RIF in the local muscular tissue and peripheral blood of rats. A: Blank muscle tissue; B: Local muscle tissue after implantation; C: Blank plasma; D: Blank plasma after implantation. |
在SD大鼠肌袋模型局部植入复合支架材料后局部药物浓度在第3天达到最高值80.40 μg/g(表 2),随后逐渐下降。在术后28 d局部药物浓度仍可达到15.29 μg/g。全身血药浓度在第1天达到最高值5.86 μg/mL并且在第1周维持较高浓度,血药浓度在第2周逐渐降低并保持在较低水平。
| 表 2 不同时间点局部肌肉组织及全身血液的RIF浓度 Table 2 Changes of RIF concentration in rat peripheral blood and the local muscular tissue after implantation of the composite material (n=3) |
对照组大鼠的肝脏病理切片肝细胞排列整齐,细胞内未见空泡。肝细胞以中央静脉为中心呈放射状分布(图 3A)。实验组大鼠在局部植入复合支架材料后第1天肝脏病理切片未出现明显异常(图 3B)。术后第3天少量肝细胞内开始出现空泡(图 3C)而在术后第7天的病理切片中可见大量的肝细胞肿胀以及水样变性(图 3D)。肝细胞的变性和水肿在第14天开始好转(图 3E),在28 d时肝细胞的形态及结构基本恢复正常(图 3G)。所有组别的肝脏病理切片均未见肝小叶结构的破坏。
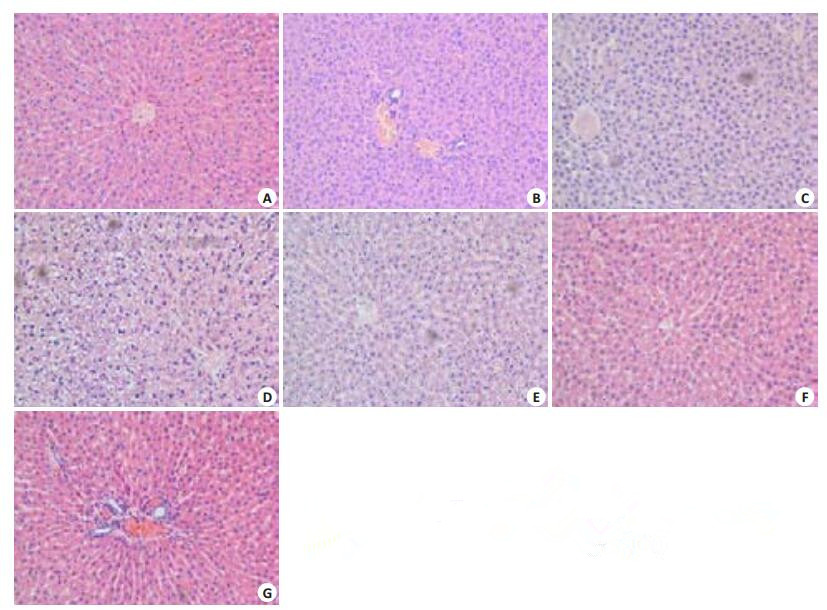
|
图 3 局部植入材料后不同时间点的肝脏病理切片 Figure 3 Hepatotoxicity evaluation of the composite scaffold material at different time points after its local embedment (Original magnification: ×200). A: Control group; B: 1 day; C: 3 days; D: 7 days; E: 14 days; F: 21 days; G: 28 days. |
局部植入复合支架材料后血浆的ALT及AST水平在前3 d呈一过性升高(表 3),AST升高的程度较ALT更为明显,ALB从术后第1天开始降低,在14 d开始逐步上升。GLB各个时间点的数值均与对照组无统计学差异。
| 表 3 不同时间点肝功能指标变化情况 Table 3 Liver function of the rats at different time points after implantation of the composite material(n=3) |
与传统的口服用药相比,局部植入缓释药物对于慢性感染性疾病的治疗效果更加直接确切[19]。但是目前临床上常用的方法是直接在病灶放置抗结核药粉,它存在如药物浓度波动大,药物溶解快以及持续作用时间短等缺点。药物缓释体系的出现恰好弥补了局部植入抗最为广泛以及深入研究的药物缓释体系材料之一,基于其各项优异的物理特性已经被美国食品及药品监督局列为医用材料并广泛应用于临床治疗[20-21]。
载药率和缓释时间是载药缓释微球最为重要的两项属性。更高的载药率可以减少所需植入微球的量而足够的缓释时间意味着对残留结核菌更长时间的抑制甚至杀灭。本研究制作的载药微球包封率和载药率分别为(56.05±5.33)%和(29.80±2.88)%,结果令人满意。
就体外缓释实验而言,单纯RIF组的药物在第3天基本完全释放。微球组与复合支架材料组的缓释情况在前3 d较为接近,均有一定的突释情况。随后两组的体外释放均进入平稳释放期。与微球组相比,复合支架材料组的体外缓释性能更为优异。研究表明缓释微球中药物的释放主要为扩散以及降解这两种机制[22-24]。微球及复合支架材料在前3 d的药物突释可能是由于微球表面药物的溶解以及进入微球的溶液溶解后经微球孔隙将微球孔隙内的药物扩散到介质中。突释期后微球组以及复合支架材料组都进入RIF的平稳释放期,这个阶段的药物释放主要是通过微球在体内代谢成为代谢产物从而释放出微球中的药物的过程。微球与带负电荷硫酸钙/β-磷酸三钙复合骨水泥结合后具有更为优秀的体外缓释表现的原因可能是形成复合材料后微球与介质的接触面积减少,延缓了微球的降解过程。
植入复合支架材料后局部肌肉的药物浓度与体外缓释情况相似。前3 d为突释期局部的药物浓度较高,随后进入平稳释放期且局部浓度逐渐下降。前3 d的药物突释形成的局部药物高浓度对于早期控制感染、灭杀细菌以及预防耐药均有重要意义[25]。通常认为RIF对结核杆菌的最小抑菌浓度和最小灭菌浓度分别为0.005~0.5 μg/mL和5 μg/mL[26-27]。根据高效液相的检测结果,在植入复合支架材料后第28天局部的药物浓度仍达到(14.96±0.33)μg/g,高于最小灭菌浓度。这也证明了这种新型的复合植入材料能在较长的时间内保持有效的灭菌浓度,体内缓释效果令人满意。
利福平作为临床上不可替代的一线药物之一在抗结核治疗中有确切的疗效。然而大剂量、长期应用利福平可引起一系列的毒副作用,其中以肝毒性最为明显[1, 3, 28-29]。目前对于局部植入材料药物浓度要求一般为不超过一次静脉注射的最大量,根据实验动物给药剂量的计算结果大鼠的局部RIF植入剂量的安全阈值为60.5 mg/kg[30]。本实验的局部植入剂量约为27 mg/kg,并未超过安全范围。血生化指标的水平是临床上诊断肝损伤程度的重要指标。其中ALT、AST以及ALB作为几个最为常见的指标常被用来衡量急性肝损伤的严重程度,通常来说ALT、AST的升高以及ALB的降低都是急性肝损伤的表现,而GLB升高则主要用于慢性肝炎的诊断[31-32]。ALT和AST均在前3 d有一过性升高,而ALB则在术后第1天开始降低随后缓慢上升。结合肝脏病理切片可知局部植入复合支架材料会对SD大鼠造成一过性肝损伤,但是在第28天损伤基本修复。GLB未见升高也提示局部植入复合支架材料并未造成肝脏的慢性损伤。因此局部植入复合支架材料只会对实验动物造成暂时性的影响,长远来看对实验对象并不会造成永久性损伤。对比于传统的全身长期大剂量规律口服用药,在术中使用局部植入的新型抗结核复合支架材料无疑能得到更好的局部药物释放效果以及受到更小的全身毒副作用。
本实验存在一些不足之处,比如动物实验样本量偏小、缓释微球包裹药物单一以及体内实验观察时间较短等。随着实验的进展我们会进一步优化RIF/PLGA微球-带负电荷硫酸钙/β-磷酸三钙复合骨水泥的制作工艺并验证其在生物体内的成骨性能,为它在临床骨与关节结核的治疗的应用奠定基础。
| [1] |
Singh A, Budhraj A, Shrivastava A, et al. Current status of anti-tuberculosis therapy: a patent analysis[J].
Recent Pat Antiinfect Drug Discov,2014, 9 (1) : 25-40.
DOI: 10.2174/1574891X09666140711111800. ( 0) 0)
|
| [2] |
Zumla A, George A, Sharma V, et al. The WHO 2014 global tuberculosis report--further to go[J].
Lancet,2015, 3 (1) : e10-2.
( 0) 0)
|
| [3] |
Schaberg T. The dark side of antituberculosis therapy: adverse events involving liver function[J].
Eur Respir J,1995, 8 (8) : 1247-9.
DOI: 10.1183/09031936.95.08081247. ( 0) 0)
|
| [4] |
Zhu M, Li K, Zhu Y, et al. 3D-printed hierarchical scaffold for localized isoniazid/rifampin drug delivery and osteoarticular tuberculosis therapy[J].
Acta Biomater,2015, 16 (16) : 145-55.
( 0) 0)
|
| [5] |
Dutt M, Khuller GK. Sustained release of isoniazid from a single injectable dose of poly (DL-lactide-co-glycolide) microparticles as a therapeutic approach towards tuberculosis[J].
Int J Antimicrob Agents,2001, 17 (2) : 115-22.
DOI: 10.1016/S0924-8579(00)00330-7. ( 0) 0)
|
| [6] |
Wu J, Zuo Y, Hu Y, et al. Development and in vitro characterization of drug delivery system of rifapentine for osteoarticular tuberculosis[J].
Drug Des Devel Ther,2015, 9 : 1359-66.
( 0) 0)
|
| [7] |
Ma G. Microencapsulation of protein drugs for drug delivery: strategy, preparation, and applications[J].
J Control Release,2014, 193 : 324-40.
DOI: 10.1016/j.jconrel.2014.09.003. ( 0) 0)
|
| [8] |
孙辉, 臧学慧, 高立华, 等. 可吸收人工骨粉修复跟骨粉碎性骨折[J].
中国组织工程研究,2014, 39 : 6375-80.
( 0) 0)
|
| [9] |
Whang PG, Wang JC. Bone graft substitutes for spinal fusion[J].
Spine J,2003, 3 (2) : 155-65.
DOI: 10.1016/S1529-9430(02)00539-9. ( 0) 0)
|
| [10] |
Ciccone WJ, Motz C, Bentley C, et al. Bioabsorbable implants in orthopaedics: new developments and clinical applications[J].
J Am Acad Orthop Surg,2001, 9 (5) : 280-8.
DOI: 10.5435/00124635-200109000-00001. ( 0) 0)
|
| [11] |
Smeets R, Kolk A, Gerressen M, et al. A new biphasic osteo-inductive Calcium composite material with a negative Zeta potential for bone augmentation[J].
Head Face Med,2009, 5 : 13.
DOI: 10.1186/1746-160X-5-13. ( 0) 0)
|
| [12] |
Nakamura S, Kobayashi T, Nakamura M, et al. Electrostatic surface charge acceleration of bone ingrowth of porous hydroxyapatite/ beta-tricalcium phosphate ceramics[J].
J Biomed Mater Res A,2010, 92 (1) : 267-75.
( 0) 0)
|
| [13] |
王鹏, 张晓周, 杨平, 等. 生物压电复合陶瓷TCPLNK对大鼠成骨细胞生物相容性的体外研究[J].
华西口腔医学杂志,2008, 26 (2) : 133-6.
( 0) 0)
|
| [14] |
Tan F, Xu X, Deng T, et al. Fabrication of positively charged poly (ethylene glycol)-diacrylate hydrogel as a bone tissue engineering scaffold[J].
Biomed Mater,2012, 7 (5) : 055009.
DOI: 10.1088/1748-6041/7/5/055009. ( 0) 0)
|
| [15] |
Stein JM, Fickl S, Yekta SS, et al. Clinical evaluation of a biphasic Calcium composite grafting material in the treatment of human periodontal intrabony defects: a 12-month randomized controlled clinical tria[J].
J Periodontol,2009, 80 (11) : 1774-82.
DOI: 10.1902/jop.2009.090229. ( 0) 0)
|
| [16] |
占蓓蕾, 叶舟. Genex椎体成形在胸腰椎爆裂性骨折治疗中的意义[J].
中国骨伤,2011, 24 (3) : 223-6.
( 0) 0)
|
| [17] |
杨惠光, 张云庆, 刘勇, 等. Genex骨水泥结合短节段椎弓根内固定治疗骨质疏松性骨折伴真空征[J].
实用骨科杂志,2012, 18 (7) : 583-6.
( 0) 0)
|
| [18] |
Mo L, Hou L, Guo D, et al. Preparation and characterization of teniposide PLGA nanoparticles and their uptake in human glioblastoma U87MG cells[J].
Int J Pharm,2012, 436 (1/2) : 815-24.
( 0) 0)
|
| [19] |
Haerdi-Landerer MC, Habermacher J, Wenger B, et al. Slow release antibiotics for treatment of septic arthritis in large animals[J].
Vet J,2010, 184 (1) : 14-20.
DOI: 10.1016/j.tvjl.2009.02.013. ( 0) 0)
|
| [20] |
Danhier F, Ansorena E, Silva JM, et al. PLGA-based nanoparticles: an overview of biomedical applications[J].
J Control Release,2012, 161 (2) : 505-22.
DOI: 10.1016/j.jconrel.2012.01.043. ( 0) 0)
|
| [21] |
Mundargi RC, Babu VR, Rangaswamy V, et al. Nano/micro technologies for delivering macromolecular therapeutics using poly (D, L-lactide-co-glycolide) and its derivatives[J].
J Control Release,2008, 125 (3) : 193-209.
DOI: 10.1016/j.jconrel.2007.09.013. ( 0) 0)
|
| [22] |
李像, 魏坤, 罗云, 等. 聚乳酸羟基乙酸/纳米羟基磷灰石-5-氟尿嘧啶复合微球的制备及体外释放[J].
中国组织工程研究与临床康复,2009, 13 (47) : 9282-6.
( 0) 0)
|
| [23] |
Schnieders J, Gbureck U, Thull R, et al. Controlled release of gentamicin from Calcium phosphate-poly(lactic acid-co-glycolic acid) composite bone cement[J].
Biomaterials,2006, 27 (23) : 4239-49.
DOI: 10.1016/j.biomaterials.2006.03.032. ( 0) 0)
|
| [24] |
叶向阳, 孙湘, 贾会文, 等. 利福平/聚乳酸-聚羟基乙酸缓释微球的制备及特性[J].
中国组织工程研究与临床康复,2011, 15 (51) : 9608-12.
( 0) 0)
|
| [25] |
Kasahara K, Nakagawa T, Kubota T. Neuronal loss and expression of neurotrophic factors in a model of rat chronic compressive spinal cord injury[J].
Spine (Phila Pa 1976),2006, 31 (18) : 2059-66.
DOI: 10.1097/01.brs.0000231893.21964.f2. ( 0) 0)
|
| [26] |
Bemer-Melchior P, Bryskier A, Drugeon HB. Comparison of the in vitro activities of rifapentine and rifampicin against Mycobacterium tuberculosis complex[J].
J Antimicrob Chemother,2000, 46 (4) : 571-6.
DOI: 10.1093/jac/46.4.571. ( 0) 0)
|
| [27] |
Zhu M, Wang H, Liu J, et al. A mesoporous silica nanoparticulate/ β-TCP/BG composite drug delivery system for osteoarticular tuberculosis therapy[J].
Biomaterials,2011, 32 (7) : 1986-95.
DOI: 10.1016/j.biomaterials.2010.11.025. ( 0) 0)
|
| [28] |
廖艳, 彭双清, 颜贤忠, 等. 利福平致肝脏毒性的代谢组学特征研究[J].
中国新药杂志,2007, 16 (16) : 1260-5.
( 0) 0)
|
| [29] |
廖艳, 彭双清, 颜贤忠, 等. 抗结核药物利福平肝毒性时效关系的代谢组学[J].
中国医学科学院学报,2008, 30 (6) : 696-702.
( 0) 0)
|
| [30] |
徐华梓, 应小樟, 吴银生, 等. 利福平硫酸钙植入剂的活体内药代动力学研究[J].
脊柱外科杂志,2007, 5 (5) : 290-2, 297.
( 0) 0)
|
| [31] |
Dufour DR, Lott JA, Nolte FS, et al. Diagnosis and monitoring of hepatic injury. I. Performance characteristics of laboratory tests[J].
Clin Chem,2000, 46 (12) : 2027-49.
( 0) 0)
|
| [32] |
Dufour DR, Lott JA, Nolte FS, et al. Diagnosis and monitoring of hepatic injury. II. Recommendations for use of laboratory tests in screening, diagnosis, and monitoring[J].
Clin Chem,2000, 46 (12) : 2050-68.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
