再生障碍性贫血(再障)是一种细胞免疫异常引起造血干/组细胞及外周血三系细胞减少的获得性骨髓衰竭性疾病[1]。免疫抑制疗法(IST)是一种基于抗人胸腺/淋巴细胞球蛋白(ATG/ALG)联合环孢素A(CSA)的治疗。它适应于缺少人白细胞抗原相合同胞供者的重型再障患者[2-3],可使2/3的患者受益[4-6]。
目前认为ATG/ALG治疗再障的机制是清除循环池中异常活化的T细胞[7]。补体依赖的细胞溶解或活化相关的凋亡作用是其主要清除途径。除此之外,近期大量研究表明ATG/ALG对免疫系统还有多种调节功能:(1)调节细胞表面分子介导的白细胞/内皮细胞相互作用;(2)诱导B细胞系凋亡;(3)干预树突状细胞功能以及(4)诱导产生调节性T细胞及自然杀伤性T细胞。
根据免疫动物的不同,ATG/ALG分为马ALG、兔ATG及猪ALG[8]。迄今为止,对于ATG/ALG种属选择尚无定论。目前国内可获得猪ALG和兔ATG治疗重型再障。由于Miao Chen[9]的研究猪ALG总应答率达74.5%,且其治疗费用仅为兔的1/3,越来越多的临床医生将猪ALG作为首选。但是这多为经验性用药,缺乏临床试验支持。因此,本研究对2004~2013年在我科接受猪ALG的43例及兔ATG 32例重型再障患者进行回顾性分析,比较两种ATG/ALG在6个月血液学应答、5年生存及安全性方面的数据,为临床工作中ATG/ALG选择及进一步探讨其治疗机制提供依据。
1 资料和方法 1.1 资料 1.1.1 病例的纳入与剔除研究对象是2004~2013年在西安交通大学医学院第二附属医院血液内科接受IST的75例(猪ALG组43例,兔ATG组32例)重型再障患者。再障诊断及分度分型严格按照指南[10]。纳入患者在治疗前均未接受骨髓移植或IST。纳入患者年龄≥4岁。剔除标准:存在(1)骨髓增生异常综合征的临床证据;(2)阵发性睡眠性血红蛋白尿症(PNH)特征性溶血或其相关的血栓病史,流式细胞仪检测PNH克隆大于50%;(3)严重的、不能控制的感染或不能解释的、体温>38 ℃的发热。
本研究获得我院医学专业学术委员会和伦理委员会批准。在参加本研究前,均取得患者及/或其法定监护人的知情同意。
1.1.2 随访第一随访终点是治疗后6个月有效,第二随访终点是2014年12月生存或死亡。治疗后6月每2~3天行血常规1次,6~12月每周1次,1年后每月1次。治疗后1月每周行T细胞亚群检测1次,6月内每月1次。治疗后3月行骨髓穿刺及活检检查、染色体核型、GPI-AP缺失1次,如情况稳定每半年复查1次,如随访期间血常规出现异常立即复查。上述实验室检查用以观察血象应答、细胞免疫变化及有无复发或转化。
1.2 治疗方案与评价标准 1.2.1 治疗方案猪ALG组:猪ALG(武汉生物制品研究所),25 mg(/kg•d),静滴,连用5 d;兔ATG组:兔ATG(Thymoglobulin, Genzyme),2.5 mg(/ kg•d),维持12~18 h,静滴,连用5 d。为预防变态反应,ATG/ALG注射前口服抗组胺剂。为预防血清病,第1~15天,泼尼松1 mg(/ kg•d)静滴,第16天起减量,每5 d减为原量的一半,第30天停药。第6天起,CSA(诺华制药公司)成人3 mg(/ kg•d),儿童5 mg(/ kg•d),2~3次/d,口服,维持血CSA谷浓度为150~250 ng/mL,持续6~12个月,后在三系细胞稳定的情况下逐渐减量。所有患者在雄激素、造血生长因子及输血,抗感染及其他支持治疗上无差异。
1.2.2 评价标准疗效是通过至少间隔4周的2次或2次以上血常规确定,患者在采血时已停用造血生长因子至少1周。评价标准严格按照指南[10]。
1.3 统计学处理方法所有结果采用SPSS18.0统计软件分析。组间计量资料比较采用t检验或Mann-Whitney非参数检验;组间率比较采用Pearson χ2检验或连续性校正χ2检验;生存曲线采用Kaplan-Meier法,组间比较采用log-rank检验。预后多因素分析采用Cox回归分析法。P值均取双侧,且当P < 0.05时,认为差异有统计学意义。
2 结果 2.1 患者特征两组患者的基本临床特征组间无显著性差异(P>0.05,表 1)。猪ALG组随访中位时间为34.5(0.3~103)月,兔ATG组为26(0.37~125)月,组间无显著差异(P> 0.05)。所有患者随访至第1终点,73例患者随访至第2终点,失访2例(2.67%),失访患者至最后一次随访均持续无效。PNH克隆阳性指GPI-AP细胞阳性率小于 < 95%。仅2012年后治疗的部分患者行PNH克隆(13例猪ALG,12例兔ATG)和染色体(16例猪ALG,14例兔ATG)检查。CSA治疗时间指初次获得最佳疗效至停药的间隔时间。
| 表 1 患者临床基本特征 Table 1 PBaseline clinical characteristics of the patients |
早期死亡(治疗后90 d内死亡)患者被认为IST无效。猪ALG组6个月有效率为79.07%,高于兔ATG组(56.25%),有统计学意义(P=0.034,表 2)。此外,猪ALG组初次获得有效的中位时间为94(17~265)d,短于兔ATG组146(31~334)d,差异有统计学意义(P < 0.05)。
| 表 2 两组血液学应答率比较 Table 2 Comparison of overall response rate |
猪ALG组与兔ATG组ANC>1.0×109/L的中位时间分别为12(0~27)d、16(0~36)d,差异不显著(P=0.87);脱离红细胞输注为35(0~131)d、56(27~167)d,无统计学意义(P=0.62);脱离血小板输注为82(16~265)d、106(29~334)d,也无明显差异(P=0.41)。
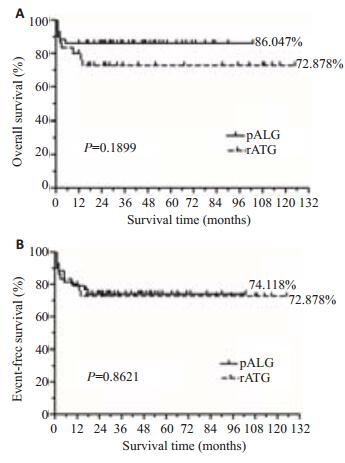
2.3 生存情况 2.3.15 年生存率猪ALG组5年总生存率为86.047%,高于兔ATG组的72.878%,但差异不显著(P=0.1899);无事件生存率(除发生转化或复发的生存患者)为74.118%,与兔ATG组(72.878%)相近(P=0.8621)。至第2随访终点,1例猪ALG和4例兔ATG患者仍未达到有效,这些患者未行第2次IST或骨髓移植术,均依赖输血存活(图 1)。
|
图 1 两组生存曲线比较 Figure 1 Comparison of survival curves. There was no significant difference (P>0.05) in the overall survival (A) or event-free survival (B). |
猪ALG组与兔ATG组的早期死亡患者均为5例,早期死亡率为11.63% vs. 15.63%(P=0.873);总死亡患者分别为6例和8例,死亡率为13.95% vs. 25%(P=0.225)。所有死亡患者未达有效。感染是其主要死因,85%死亡病例与感染直接相关(表 3)。
| 表 3 2组死因分析 Table 3 Cause of death of the patients in the two groups |
至第2随访终点,兔ATG组未观察到复发;猪ALG组有3例(6.98%,P=0.353)患者分别于治疗的第147、283、540天复发。3例患者均未行第2次IST或骨髓移植术,通过延长CSA用药,分别于第262、570、433天再次获得部分缓解,其中2例最终获得完全治愈。
2.3.4 转化至第2随访终点,兔ATG组未观察到转化;猪ALG组有2例发生转化,组间转化率无显著差异(P=0.609)。其中,1例于第125天诊断为骨髓增生异常综合征伴5q31缺失;1例于第455天诊断为PHN。2例患者在转化前均未达有效,依赖输血存活。
2.4 预后多因素分析多因素分析显示,性别、年龄、治疗前血象、IST前治疗及ATG/ALG种属差异并不影响预后,而极重型再障、重Ⅱ型再障及6个月无应答是预后的独立危险因素(表 4)。其中,极重型患者5年死亡率是重型的2.5倍(P=0.04,95%可信区间1.03-5.68);重Ⅱ型患者是重Ⅰ型的3.6倍(P=0.01,95%可信区间1.50-10.10);6个月无应答患者是有应答的3.75倍(P=0.01,95%可信区间1.03-6.04)。
| 表 4 预后的多因素分析 Table 4 Analysis of factors associated with overall survival at 5 years after IST |
两组变态反应、血清病、感染、出血、肝肾功能损害、高血压、糖耐量异常或空腹血糖受损发生率均无明显差异(P>0.05,表 5)。所有出现的不良反应在给予对症治疗后恢复,不良反应轻微而可控,未出现治疗相关死亡。
| 表 5 不良反应与毒性 Table 5 Side effects and toxicity |
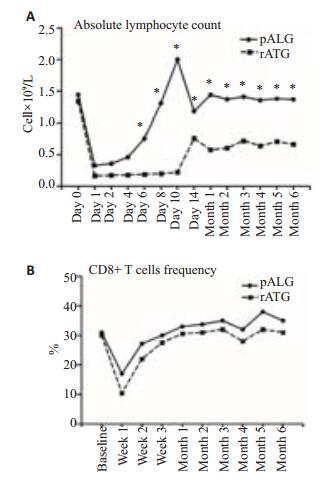
为探讨猪ALG与兔ATG疗效差异的机制,我们绘制了IST前后外周血淋巴细胞计数变化曲线(图 2)。IST前两组患者淋巴细胞绝对计数及CD8+ T细胞百分百无统计学差异。治疗后第6、8、10、14天及第1~6个月,猪ALG组淋巴细胞绝对计数均大于兔ATG组,且差异显著(P < 0.05);而CD8+T细胞百分百始终无显著差异(P>0.05)
|
图 2 外周血淋巴细胞计数变化曲线 Figure 2 Kinetics of lymphocyte count after each ATG administration. A: Absolute lymphocyte count; B: CD8+ T cell frequency. |
对于缺少人白细胞抗原相合同胞供者的重型再障患者,基于ATG/ALG联合CSA的IST是其一线治疗方案[2-3]。自2011年起,发表的大量临床研究表明[12-14],不同种属来源的ATG/ALG疗效存在差异。因此,临床医生对于种属剂型的决策可能影响到再障患者的预后。目前,除兔ATG外,我国临床医生普遍使用猪ALG治疗重型再障,但是文献中有关猪ALG疗效的报道极少。基于上述原因,比较猪ALG与兔ATG在再障临床治疗中的疗效具有重要意义。
本研究回顾性比较猪ALG与兔ATG的疗效,得到如下结果:猪ALG组与兔ATG组6个月有效率分别为79.07%和56.25%,起效中位时间分别为94(17~265)d和146(31~334)d。其中,猪ALG的应答情况与国内Chen[9]及Wei[11]报道结果基本一致,而兔ATG也同EBMT[12]、NIH[13]、Cleveland诊所[14]及国内Li Zhang[15]报道结果相近。两组比较显示,猪ALG 6个月有效率及起效中位时间均明显优于对照组。但是在唯一可获得的同类文献中,Liu[16]报道两组应答率并无明显差异。分析两项研究结果,我们发现本研究中兔ATG组的应答与Liu Limin研究相近,而猪ALG组疗效优于其研究。为排除选择偏倚及实施偏倚,我们进一步比较了两项研究的样本基线资料及治疗策略。两项研究在患者年龄、极重型及重Ⅱ型再障(37.50%)比例上基本相近,然而Liu Limin使用ALG剂量[30 mg(/ kg•d)]高于本研究[25 mg(/ kg•d)]。既往研究表明,由于免疫抑制作用加重,ATG大剂量组疗效低于中等剂量组[17],因此我们猜想这种剂量差异是导致疗效结论不同的原因。
对两组患者的生存情况分析,我们发现猪ALG组5年总生存率为86.047%,无事件生存率为74.118%,兔ATG组均为72.878%。组间比较表明,猪ALG组5年生存情况优于兔ATG组,但差异不显著。为了明确组间差异是否受其他混杂因素影响,我们进一步进行了预后的多因素分析。Cox回归分析显示,兔ATG并不是5年累计生存率的独立危险因素。综合上述单因素及多因素分析结果,我们得出:猪ALG组与兔ATG组患者的生存情况近似。此外,预后的多因素分析还表明,极重型、重Ⅱ型再障及6个月对治疗无反应是其独立危险因素,这与既往同类研究结果一致[12-14]。
此外,我们还对其治疗机制进行了初步探究。通过组内纵向比较发现,治疗后两组淋巴细胞绝对计数均较前下降。体内外研究显示[7],通过补体依赖的细胞溶解作用介导循环池中T淋巴细胞的清除是ATG/ALG最重要的治疗机制。两组患者较治疗前淋巴细胞均明显降低,说明猪ALG和兔ATG治疗再障有效。且T细胞亚群分析显示两组间CD8+T细胞作用相似更进一步支持了上述结论。然而,组间横向比较发现,兔ATG组淋巴细胞缺乏的时间更持久,绝对数值更低。这表明:兔ATG对于非CD8+T细胞(如Treg细胞)的作用强于猪ALG。既往观察到的兔ATG对于移植物抗宿主病有更好的疗效,病毒感染发生率较高[17-19];药物代谢动力学研究观察到兔ATG体内清除速率慢,治疗后1月的兔ATG浓度仍具有捕获T细胞的能力[20]:这些研究都从不同方面支持兔ATG有更强更持久的免疫抑制活性。于是,我们推测:不同程度的免疫抑制活性可能是疗效差异的重要机制。如果说,适当的免疫抑制消除活化CD8+T细胞对骨髓造血的负调节;那么,过度过长的淋巴细胞缺乏可能阻碍骨髓恢复并且增加感染发生率。
综上,我们得出结论:在生存情况和安全性上,猪ALG与兔ATG相似,在血液学应答上优于兔ATG。机制可能与猪ALG免疫抑制适度,促进骨髓造血恢复有关。这为临床工作中ATG/ALG种属选择提供依据。但由于方法学限制可能受到偏倚影响,要得到更加可靠的结论仍需多中心随机对照双盲试验。
| [1] |
Young NS, Calado RT, Scheinberg P. Current concepts in the pathophysiology and treatment of aplastic anemia[J].
Blood,2006, 108 (8) : 2509-19.
DOI: 10.1182/blood-2006-03-010777. ( 0) 0)
|
| [2] |
Marsh J, Bacigalupo A, Schrezenmeier H, et al. Treatment of aplastic anaemia with Antithymocyte globulin (ATG): current situation regarding horse vs rabbit ATG; a report from the EBMT Severe Aplastic Anaemia Working Party[J].
Bone Marrow Transplant,2013, 48 (2) : s9.
( 0) 0)
|
| [3] |
Scheinberg P, Young NS. How I treat acquired aplastic anemia[J].
Blood,2012, 120 (6) : 1185-96.
DOI: 10.1182/blood-2011-12-274019. ( 0) 0)
|
| [4] |
Kadia TM, Borthakur G, Garcia-Manero G, et al. Final results of the phase II study of rabbit anti-thymocyte globulin, ciclosporin, methylprednisone, and granulocyte colony-stimulating factor in patients with aplastic anaemia and myelodysplastic syndrome[J].
Br J Haematol,2012, 157 (3) : 312-20.
DOI: 10.1111/bjh.2012.157.issue-3. ( 0) 0)
|
| [5] |
Jeong DC, Chung NG, Cho B, et al. Long-term outcome after immunosuppressive therapy with horse or rabbit antithymocyte globulin and cyclosporine for severe aplastic anemia in children[J].
Haematologica,2014, 99 (4) : 664-71.
DOI: 10.3324/haematol.2013.089268. ( 0) 0)
|
| [6] |
Tichelli A, Schrezenmeier H, Socie G, et al. A randomized controlled study in patients with newly diagnosed severe aplastic anemia receiving antithymocyte globulin (ATG), cyclosporine, with or without G-CSF: a study of the SAA Working Party of the European Group for Blood and Marrow Transplantation[J].
Blood,2011, 117 (17) : 4434-41.
DOI: 10.1182/blood-2010-08-304071. ( 0) 0)
|
| [7] |
Mohty M. Mechanisms of action of antithymocyte globulin: T-cell depletion and beyond[J].
Leukemia,2007, 21 (7) : 1387-94.
DOI: 10.1038/sj.leu.2404683. ( 0) 0)
|
| [8] |
Gomez AD, Jaime JC, Ruiz GJ. Antibodies in the treatment of aplastic anemia[J].
Arch Immunol Ther Exp (Warsz),2012, 60 (2) : 99-106.
DOI: 10.1007/s00005-012-0164-3. ( 0) 0)
|
| [9] |
Chen M, Liu C, Zhuang J, et al. Long-term follow-up study of porcine anti-human thymocyte immunoglobulin therapy combined with cyclosporine for severe aplastic anemia[J].
Eur J Haematol,2016, 96 (3) : 291-6.
DOI: 10.1111/ejh.2016.96.issue-3. ( 0) 0)
|
| [10] |
Marsh JC, Ball SE, Cavenagh JA, et al. Guidelines for the diagnosis and management of aplastic anaemia[J].
Br J Haematol,2009, 147 (1) : 43-70.
DOI: 10.1111/bjh.2009.147.issue-1. ( 0) 0)
|
| [11] |
Wei J, Huang Z, Guo J, et al. Porcine antilymphocyte globulin (p-ALG) plus cyclosporine A (CsA) treatment in acquired severe aplastic anemia: a retrospective multicenter analysis[J].
Ann Hematol,2015, 94 (6) : 955-62.
DOI: 10.1007/s00277-015-2308-0. ( 0) 0)
|
| [12] |
Marsh JC, Bacigalupo A, Schrezenmeier H, et al. Prospective study of rabbit antithymocyte globulin and cyclosporine for aplastic anemia from the EBMT severe aplastic anaemia working party[J].
Blood,2012, 119 (23) : 5391-6.
DOI: 10.1182/blood-2012-02-407684. ( 0) 0)
|
| [13] |
Scheinberg P, Nunez O, Weinstein B, et al. Horse versus rabbit antithymocyte globulin in acquired aplastic anemia[J].
N Engl J Med,2011, 365 (5) : 430-8.
DOI: 10.1056/NEJMoa1103975. ( 0) 0)
|
| [14] |
Afable MG, Shaik M, Sugimoto Y, et al. Efficacy of rabbit anti-thymocyte globulin in severe aplastic anemia[J].
Haematologica,2011, 96 (9) : 1269-75.
DOI: 10.3324/haematol.2011.042622. ( 0) 0)
|
| [15] |
Zhang L, Jing L, Zhou K, et al. Rabbit antithymocyte globulin as first-line therapy for severe aplastic anemia[J].
Exp Hematol,2015, 43 (4) : 286-94.
DOI: 10.1016/j.exphem.2014.12.002. ( 0) 0)
|
| [16] |
Liu L, Ding L, Hao L, et al. Efficacy of porcine antihuman lymphocyte immunoglobulin compared to rabbit antithymocyte immunoglobulin as a first-line treatment against acquired severe aplastic anemia[J].
Ann Hematol,2015, 94 (5) : 729-37.
DOI: 10.1007/s00277-014-2279-6. ( 0) 0)
|
| [17] |
Li X, Shi J, Ge M, et al. Outcomes of optimized over standard protocol of rabbit antithymocyte globulin for severe aplastic an-emia: a single-center experience[J].
PLoS One,2013, 8 (3) : e56648.
DOI: 10.1371/journal.pone.0056648. ( 0) 0)
|
| [18] |
Brennan DC. A randomized, double-blinded comparison of Thymo-globulin versus Atgam for induction immunosuppressive therapy in adult renal transplant recipients[J].
Transplantation,1999, 67 (10) : 1386.
DOI: 10.1097/00007890-199905270-00020. ( 0) 0)
|
| [19] |
Gaber AO, First MR, Tesi RJ, et al. Results of the double-blind, randomized, multicenter, phase III clinical trial of Thymoglobulin versus Atgam in the treatment of acute graft rejection episodes after renal transplantation[J].
Transplantation,1998, 66 (1) : 29-37.
DOI: 10.1097/00007890-199807150-00005. ( 0) 0)
|
| [20] |
Feng X, Scheinberg P, Biancotto A, et al. In vivo effects of horse and rabbit antithymocyte globulin in patients with severe aplastic anemia[J].
Haematologica,2014, 99 (9) : 1433-40.
DOI: 10.3324/haematol.2014.106542. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
