2. 辽宁医学院附属第一医院变态反应与临床免疫研究中心,辽宁 锦州 121001
2. 2 Allergy and Clinical Immunology Research Center, First Affiliated Hospital of Liaoning Medical University, Jinzhou 121001, China
口腔癌是头颈部常见的恶性肿瘤,其中舌癌又是最常见的口腔癌,多数为鳞癌。近年来舌癌的发病率有增高趋势,但患者的生存率却无明显改善。大部分患者确诊时已经是晚期,处于第Ⅲ期或第Ⅳ期,这是降低患者生存率的一个重要因素[1-2]。因此,预防舌癌的发生,探索其发病机制,发现新的早期诊断标志物成为目前研究的重点。Ki-67、p53、HOX基因和Ⅳ型胶原酶等是近年来发现的较新的口腔鳞癌的生物学标志物,对诊断和治疗口腔鳞癌意义重大[3]。有研究表明富亮氨酸α2糖蛋白1(LRG-1)在肝癌[4]、胰腺癌[5]、卵巢癌[6]、肺癌[7]和结直肠癌[8]等多种肿瘤中的表达较正常人高。又有研究发现LRG-1表达升高与血管生成有密切关系[9]。血管生成是指在原有的毛细血管和(或)微静脉基础上通过血管内皮细胞的迁移和增殖,从已存在的血管处以芽生或非芽生形式形成新的、以毛细血管为主的血管系统过程。内皮细胞活化增殖是血管生成的起始阶段[10]。故研究血管内皮细胞的增值情况即可大致反应血管生成的情况。但LRG-1在舌癌中的表达情况及其参与舌癌发生、发展的相关机制尚不清楚。本实验旨在体外检测LRG-1在舌癌组织及细胞系的表达,以及LRG-1对人血管内皮细胞增殖及小管形成的影响,初步探讨其在舌癌组织中的表达变化及其对肿瘤血管生成的影响,为进一步研究其生物学作用及可能存在的致病机制提供实验依据。
1 资料和方法 1.1 主要试剂RPMI 1640培养基:美国Corning。胎牛血清:美国Gibco。兔抗人LRG-1单抗、HRP标记的驴抗兔IgG、PE标记的鼠抗兔IgG:美国LifeSpan BioSciences。重组人LRG-1:上海江莱生物科技有限公司。噻唑蓝(MTT):美国Sigma进口分装。Matrigel:美国BD。
1.2 细胞株人舌癌细胞株Tca8113细胞由上海拜力生物公司购得;人脐静脉内皮细胞HUVEC由ATCC细胞库购得。
1.3 临床资料收集2005~2015年辽宁医学院附属第一医院病理科保存的浸润性舌癌标本40例,舌部不典型性增生组织20例、舌原位癌组织20例,患者术前均未接受化疗及放疗。其中浸润性舌癌中男性28例,女性12例,年龄40~75岁,平均52岁。组织学分类:高分化15例,中低分化25例。有淋巴结转移22例,无淋巴结转移18例。根据国际抗癌联合会(UICC)分期:Ⅰ期17例,Ⅱ期12例,Ⅲ期6例,Ⅳ期5例。所有标本均经镜下病理检查证实。40例癌旁正常组织均采用距离肿瘤至少2 cm且术中病理证实切缘为阴性的舌体组织。临床病理资料包括性别、年龄、分化程度、淋巴结转移、肿瘤分期。
1.4 方法 1.4.1 免疫组织化学染色选取与HE染色一致的典型蜡块做4 μm厚连续切片。切片脱蜡至水,3% H2O2消除内源性过氧化物酶,组织抗原微波加热修复,5% BSA封闭非特异性抗原,加入兔抗人LRG-1单抗,4 ℃过夜,滴加HRP标记的驴抗兔IgG工作液,37 ℃孵育1 h,PBS冲洗3次,5 min/次;DAB显色,苏木素复染,常规脱水、透明、中性树胶封片。染色结果判读:镜下观察以肿瘤细胞中出现清晰棕黄色颗粒判定为阳性细胞。根据反应强度和范围分为:阴性(-):未见阳性细胞;阳性(+):阳性细胞未超过半数且染色较浅;强阳性(++):阳性细胞超过半数且染色较深。
1.4.2 细胞培养舌癌细胞株Tca8113、人脐静脉内皮细胞HUVEC均采用含10%胎牛血清的RPMI 1640培养液(内含青霉素100 U/mL、链霉素100 mg/L)培养,置于含5% CO2、37 ℃恒温培养箱中。每1~2 d传代1次,取对数生长期细胞进行实验。
1.4.3 流式细胞技术检测舌癌细胞系(Tca8113)中LRG-1的表达取对数生长期细胞,常规胰酶消化后,制成单细胞悬液,离心弃上清,再经PBS缓冲液洗涤两次。BD破膜试剂盒进行破膜,重悬细胞,在实验组细胞悬浮液中加入5 μL兔抗人LRG-1单抗,同型组加入同型一抗,轻轻混匀后于2~8 ℃避光条件下孵育30 min,洗涤,再加入5 μL PE标记的鼠抗兔IgG后轻轻混匀于2~8 ℃避光条件下孵育30 min,洗涤,200 μL PBS重悬,上机行流式细胞仪检测。实验重复3次。
1.4.4 Westernblotting检测临床标本及细胞系中LRG-1的表达临床上所取新鲜舌癌组织及癌旁组织冲洗后剪碎,匀浆,裂解后抽提蛋白并定量;Tca8113细胞预冷PBS冲洗,裂解后抽提蛋白并定量。取50 μg总蛋白经10%聚丙烯酰胺凝胶电泳分离后,转至硝酸纤维素膜上,5%脱脂牛奶封闭1 h,加兔抗人LRG-1单抗及β-actin单抗4 ℃孵育过夜、洗膜,加辣根过氧化物酶标记的二抗,室温孵育2 h,洗膜,ECL法显色后GIS凝胶图像分析系统拍照并分析处理。以上实验重复3次。1.4.5 MTT法检测内皮细胞增殖情况将处于生长对数期的HUVEC细胞经胰酶消化、重悬、按每孔100 μL种于96孔板,每孔含1000个细胞,设4个复孔,5% CO2、37 ℃恒温培养箱中培养24 h,弃去培养液。加入LRG-1浓度为5、10、20、40、50 μg/mL的培养液,另设置不加LRG-1的阴性对照组和阳性对照组血管内皮生长因子-VEGF(10 ng/mL)。继续培养6 h后,每孔加入15 μL MTT,4 h后吸弃孔中液体,每孔加入100 μL DMSO,摇床震荡10 min,使结晶物溶解。酶标仪在570 nm波长下检测每孔的吸光度(A)值,以上实验重复3次。
1.4.6 LRG-1对人脐静脉内皮细胞HUVEC小管生成的影响Matrigel基质胶4 ℃过夜冻融,次日,在预冷的96孔板中加入50 μL融化的Matrigel基质胶溶液,在37 ℃放置30 min成胶。按细胞悬液2×104/孔加入板中,放入CO2培养箱培养24 h。分为阴性对照组和实验组,实验组分别是LRG-1浓度为5、10、20、40、50 μg/mL,每组设置5个复孔。CO2培养箱培养6 h。光学显微镜下观察内皮细胞小管的形成情况,每孔随机取5个视野,数码相机拍照,计数形成的小管的个数。
1.5 统计学处理采用SPSS 17.0统计软件处理数据,计数资料组间比较采用χ2检验;计量资料以均数±标准差表示,两组间比较采用t检验,多组间比较采用方差分析;计数资料与计量资料的统计分析均以P < 0.05为有统计学意义。
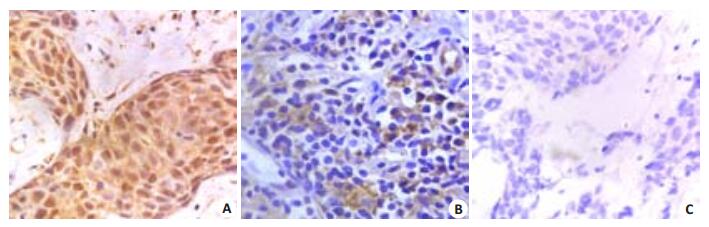
2 结果 2.1 免疫组织化学检测LRG-1的表达结果显示,LRG-1在舌癌组织中呈不同程度的表达(图 1)。LRG-1的表达主要定位于胞浆中,细胞核亦可见染色,各标本LRG-1着色深浅不一。癌旁组织不表达LRG-1或仅在上皮基底细胞层显弱阳性着色。40例浸润性舌癌组织中,34例LRG-1呈阳性表达,阳性表达率为85%;癌旁正常组织中,4例LRG-1阳性表达,阳性表达率为10%;χ2=45.113,P < 0.05,差异有统计学意义。因此得出:舌癌组LRG-1阳性率高于癌旁组。20例舌部不典型性增生组织中LRG-1的阳性表达率为30%;20例舌原位癌组织中LRG-1的阳性表达率为50%;二者与浸润性舌癌组织比较,差异均有统计学意义(P < 0.05,表 1)。另外,LRG-1在浸润性舌癌组织中的表达与患者年龄、性别等不相关,而与组织分化程度、临床分期及淋巴结转移有相关性(P < 0.05),组织分化程度越低和临床分期越高的舌癌组织中LRG-1的表达越高。发生淋巴结转移的舌癌组织中LRG-1的表达较未转移者高(表 2)。
|
图 1 LRG-1在舌癌组织中呈不同程度的表达 Figure 1 Expression of LRG-1 in human TSCC tissue (Original magnification: × 400). A: Strong positive expression (++); B: Weak positive expression (+); C: Negative expression (-). |
| 表 1 LRG-1在不同类型舌组织中的表达 Table 1 Expression of LRG-1 in different tongue tissues |
| 表 2 LRG-1表达的强弱与舌癌临床病理参数的关系 Table 2 Relationship between LRG-1 expression and clinicopathological parameters of tongue cancer |
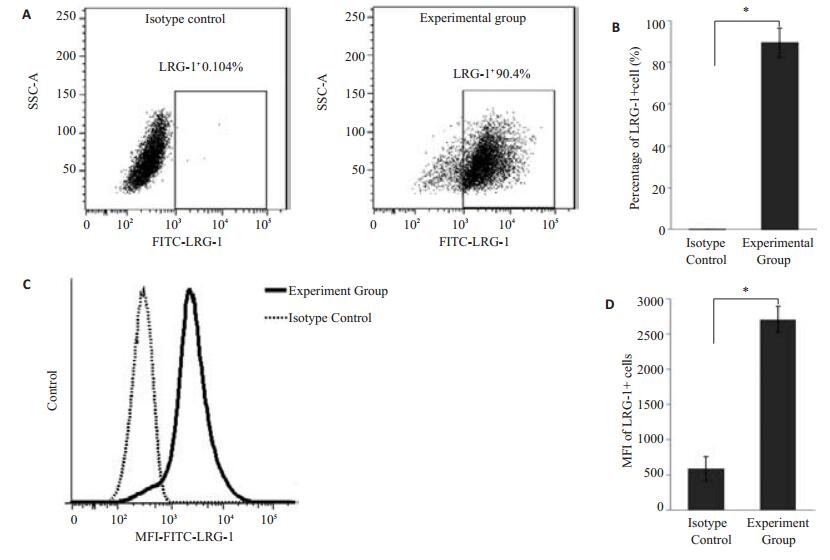
用流式分析软件分析得出,实验组LRG-1呈阳性表达(图 2)。Tca8113细胞中LRG-1阳性细胞的百分数:同型对照组为0.15±0.04,实验组为89.37±7.00,实验组与同型对照组相比,差异有统计学意义(P < 0.05);Tca8113细胞中LRG-1阳性细胞的平均荧光强度:同型对照组为587±171.67;实验组为2708±184.19,实验组与同型对照组相比,差异有统计学意义(P < 0.05)。
|
图 2 Tca8113细胞中LRG-1的表达情况 Figure 2 Expression of LRG-1 in Tca8113 cells. A: Flow cytometric analysis of the percentage of LRG-1+ cells in Tca8113 cells; B: Comparison of the percentage of LRG-1+ cells (*P < 0.05); C: Analysis of the mean fluorescence intensity of LRG-1+ cells by flow cytometry; D: Comparison of the MFI of LRG-1+ cells (*P < 0.05). |
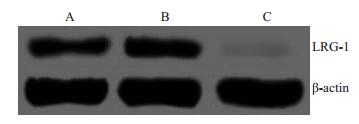
结果显示在舌癌组织及舌癌细胞Tca8113中可以看到明显条带,而在癌旁正常组织中条带较浅,说明舌癌组织及舌癌细胞Tca8113中LRG-1表达水平高于癌旁正常组织(图 3)。
|
图 3 Western blotting检测舌癌组织及Tca8113中LRG-1的表达 Figure 3 Western blotting for detecting the expression of LRG-1 in the human TSCC tissue and Tca8113 cells. A: Tca8113 cells; B: Tongue squamous cell carcinoma (TSCC) tissue; C: Adjacent tissues of TSCC. |
实验中使用不同浓度的LRG-1(0、5、10、20、40、50 μg/mL)及VEGF(10 ng/mL)处理HUVEC细胞6 h后,MTT法检测LRG-1对HUVEC细胞活力的影响。结果表明,随着LRG-1浓度的升高,内皮细胞的活性及数量不断增高(表 3)。不同浓度的LRG-1组与阴性对照组比较,差异有统计学意义(P < 0.05);不同浓度的LRG-1组间比较差异也有统计学意义(P < 0.05)。且LRG-1浓度为50 μg/mL时,血管内皮细胞的活性高于阳性对照组-VEGF(10 ng/mL)处理组(P < 0.05)。结果表明LRG-1能明显促进HUVEC细胞生长。
2.5 LRG-1对HUVEC小管生成的影响体外小管形成实验结果表明LRG-1能够促进HUVEC的体外小管形成。且随着LRG-1浓度的升高,小管数目逐渐增多,且结构也变得紧密完整(图 4)。
| 表 3 LRG-1对HUVEC细胞增殖的影响 Table 3 Effect of LRG-1 on proliferation of HUVECs (absorbance) |

|
图 4 LRG-1对HUVEC小管形成的影响 Figure 4 Effect of LRG-1 on tube formation of HUVECs (Original magnification: ×400). A: LRG-1 (50 μg/mL); B: LRG-1 (40 μg/mL); C: LRG-1 (20 μg/mL); D: LRG-1 (10 μg/mL); E: LRG-1 (5 μg/mL); F: Negative control. |
1977年Haupt和Baundner从人血清中分离出LRG1,并在1985年又决定了它的氨基酸序列。LRG-1是富亮氨酸重复序列(LRR)家族的一员[11],LRRs通常在细胞黏附、生存、信号转导及基因修复、重组、转录等过程中发挥重要作用[12]。它在骨髓造血时表达,尤其在中性粒细胞系分化时表达较高[13]。LRG-1在正常人血浆中的浓度为21~50 μg/mL[14-15]。近年来,有研究发现,LRG-1的异常表达与多种组织恶性肿瘤的发病有关,如肝癌[4]、胰腺癌[5]、卵巢癌[6]、肺癌[16]和结直肠癌[8]等,并且LRG-1在这些肿瘤中表达均上调最新研究发现,LRG-1能够促进血管生成,尤其是异常血管的生长[9]。LRG-1通过结合到其辅助受体endoglin(ENG),从而激活TGF-β血管生成的开关,这使得TGF-β信号远离维持正常血管的信号通路,转向了促进有害血管生成的方向, 活化了促血管生成信号TGF-β R -Ⅱ,进而招募内皮TGF-β R-I激活素受体样激酶-1(ALK-1),而ALK-1反过来又能够启动激活转录因子Smad 1,5和8,从而发挥其促进血管生成的作用[17]。众所周知,血管生成是一个重要的生物学过程,是发育、生殖以及损伤组织修复的必要条件。然而,异常的血管生成在多种疾病如肿瘤中发挥着重要的作用。以肿瘤中的血管生成为例,良性肿瘤血管生成稀少,血管生长缓慢;而大多数恶性肿瘤的血管生成密集且生长迅速。因此,血管生成在肿瘤的发生、发展以及转移的过程中发挥着极为关键的作用[18]。以此推测LRG-1在肿瘤的发生、发展中发挥重要作用。
舌癌是口腔颌面部最为常见的恶性肿瘤,有研究表明口腔鳞癌中约为61.4%为舌癌。尽管采用了扩大根治性手术和辅助放射治疗,但治疗效果欠佳,最常见的情况是局部、区域性复发和远处转移。有研究表明舌癌一旦复发,预后很差,3年生存率不足25%[19]。目前多数学者认为,舌癌的发生、发展与肿瘤细胞中的基因表达调控异常有关。在目前现有的治疗方法基础上,探索安全有效的基因治疗,有望进一步提高口腔鳞癌的综合治疗效果。
本研究发现LRG-1在浸润性舌癌组织及舌癌细胞系Tca8113中呈高表达,在舌部不典型性增生组织及舌原位癌中的表达较浸润性舌癌组织低,LRG-1在浸润性舌癌组织中的表达与患者年龄、性别等不相关,而与组织分化程度、临床分期及淋巴结转移有相关性,组织分化程度越低和临床分期越高的舌癌组织中LRG-1的表达越高,发生淋巴结转移的舌癌组织中LRG-1的表达较未转移的高。Kakisaka等[5]发现胰腺癌患者血浆中LRG-1浓度较正常人高,故推测LRG-1对胰腺癌的临床诊断有重大意义。Smith等[6]研究发现女性卵巢癌患者血清及肿瘤组织中LRG-1含量较正常女性高,故推测卵巢癌细胞分泌LRG-1致使卵巢癌患者血清LRG-1浓度升高,进一步的研究将证明LRG-1可能作为诊断卵巢癌的一个生物标志。因此,我们可以得出:LRG-1可能在舌癌的发生过程中发挥重要作用,可作为诊断舌癌的一个辅助指标。本研究还发现,LRG-1能够促进血管内皮细胞的增殖和小管形成,因此可以初步推测LRG-1可能促进血管生成。
综上所述,LRG-1在舌癌组织中表达升高,推测其可作为诊断舌癌的一个辅助指标。LRG1能够促进血管内皮细胞的增殖和小管形成,推测其可能促进肿瘤血管的形成。血管生成在肿瘤的发生、发展及转移的过程中发挥着极为关键的作用,故推测LRG-1在肿瘤的发生、发展中意义重大,具体机制有待于进一步研究。研究舌癌中LRG-1的表达及其生物学作用,可为舌癌的生物治疗提供依据,并为其治疗提供新的靶点。
| [1] |
Jung DW, Che ZM, Kim J, et al. Tumor-stromal crosstalk in invasion of oral squamous cell carcinoma: a pivotal role of CCL7[J].
Int J Cancer,2010, 127 (2) : 332-44.
( 0) 0)
|
| [2] |
Seo BY, Lee CO, Kim JW. Changes in the management and survival rates of patients with oral cancer: a 30-year single-institution study[J].
J Korean Assoc Oral Maxillofac Surg,2016, 42 (1) : 31-7.
DOI: 10.5125/jkaoms.2016.42.1.31. ( 0) 0)
|
| [3] |
Rivera C, Venegas B. Histological and molecular aspects of oral squamous cell carcinoma (Review)[J].
Oncol Lett,2014, 8 (1) : 7-11.
( 0) 0)
|
| [4] |
He X, Wang Y, Zhang W, et al. Screening differential expression of serum proteins in AFP-negative HBV-related hepatocellular carcinoma using iTRAQ-MALDI-MS/MS[J].
Neoplasma,2013, 61 (1) : 17-26.
( 0) 0)
|
| [5] |
Kakisaka T, Kondo T, Okano T, et al. Plasma proteomics of pancreatic cancer patients by multi-dimensional liquid chro-matography and two-dimensional difference gel electrophoresis (2D-DIGE): up-regulation of leucine-rich alpha-2-glycoprotein in pancreatic cancer[J].
J Chromatogr B Analyt Technol Biomed Life Sci,2007, 852 (1/2) : 257-67.
( 0) 0)
|
| [6] |
Smith CR, Batruch I, Bauça JM, et al. Deciphering the peptidome of urine from ovarian cancer patients and healthy controls[J].
Clin Proteomics,2014, 11 (1) : 23.
DOI: 10.1186/1559-0275-11-23. ( 0) 0)
|
| [7] |
Guergova-Kuras M, Kurucz I, Hempel W, et al. Discovery of lung cancer biomarkers by profiling the plasma proteome with monoclonal antibody libraries[J]. Mol Cell Proteomics, 2011, 10 (12): M111.010298.
( 0) 0)
|
| [8] |
Ladd JJ, Busald T, Johnson MM, et al. Increased plasma levels of the APC-interacting protein MAPRE1, LRG1, and IGFBP2 preceding a diagnosis of colorectal cancer in women[J].
Cancer Prev Res (Phila),2012, 5 (4) : 655-64.
DOI: 10.1158/1940-6207.CAPR-11-0412. ( 0) 0)
|
| [9] |
Wang X, Abraham S, Mckenzie JA, et al. LRG1 promotes angiogenesis by modulating endothelial TGF-β signalling[J].
Nature,2013, 499 (7458) : 306-11.
DOI: 10.1038/nature12345. ( 0) 0)
|
| [10] |
Ucuzian AA, Greisler HP. In vitro models of angiogenesis[J].
World J Surg,2007, 31 (4) : 654-63.
DOI: 10.1007/s00268-006-0763-4. ( 0) 0)
|
| [11] |
Ng AC, Eisenberg JM, Heath RJ, et al. Human leucine-rich repeat proteins: a genome-wide bioinformatic categorization and func-tional analysis in innate immunity[J].
Proc Natl Acad Sci USA,2011, 108 (Suppl 1) : 4631-8.
( 0) 0)
|
| [12] |
Kobe B, Deisenhofer J. Proteins with leucine-rich repeats[J].
Curr Opin Struct Biol,1995, 5 (3) : 409-16.
DOI: 10.1016/0959-440X(95)80105-7. ( 0) 0)
|
| [13] |
O'donnell LC, Druhan LJ, Avalos BR. Molecular characterization and expression analysis of leucine-rich alpha2-glycoprotein, a novel marker of granulocytic differentiation[J].
J Leukoc Biol,2002, 72 (3) : 478-85.
( 0) 0)
|
| [14] |
Haupt H, Baudner S. Isolation and characterization of an unknown, leucine-rich 3.1-S-alpha2-glycoprotein from human serum (author's transl)[J].
Hoppe Seylers Z Physiol Chem,1977, 358 (6) : 639-46.
( 0) 0)
|
| [15] |
Weivoda S, Andersen JD, Skogen A, et al. ELISA for human serum leucine-rich alpha-2-glycoprotein-1 employing cytochrome c as the capturing ligand[J].
J Immunol Methods,2008, 336 (1) : 22-9.
DOI: 10.1016/j.jim.2008.03.004. ( 0) 0)
|
| [16] |
习臻畅, 张坚松. LRG1基因在肝细胞癌中的表达情况研究[J].
湖南师范大学学报:医学版,2015, 12 (2) : 24-7.
( 0) 0)
|
| [17] |
刘兆国, 范方田, 赵林钢, 等. 肿瘤血管生成新靶点LRG1研究进展[J].
中国药理学通报,2014, 30 (1) : 6-9.
( 0) 0)
|
| [18] |
Treps L, Gavard J. Tumor angiogenesis: when the Tree of Life turns bad[J].
Med Sci (Paris),2015, 31 (11) : 989-95.
DOI: 10.1051/medsci/20153111013. ( 0) 0)
|
| [19] |
Sun GW, Tang EY, Yang XD, et al. Salvage treatment for recurrent oral squamous cell carcinoma[J].
J Craniofac Surg,2009, 20 (4) : 1093-6.
DOI: 10.1097/SCS.0b013e3181abb307. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
