骨质疏松性椎体压缩骨折(OVCFs)是老年人群中最常见的骨折[1]。OVCFs会导致疼痛、脊柱畸形和功能障碍,成为影响当今社会老年人群公众健康的重大问题。经皮椎体成形术(PVP)因具有微创及迅速缓解疼痛等优点成为近年来临床上治疗疼痛性OVCFs的最常用方法[2-5]。但随着时间推移及临床上该手术的广泛开展,PVP术后再发腰背部疼痛呈逐年增多趋势,研究发现这多数是由于相邻节段新发椎体的骨折所致[6-8]。PVP术后相邻节段骨折风险增加已被许多研究所证实并引起了临床医师的高度重视。但是,近年来有文献报道,PVP术后骨水泥强化椎也会出现再发骨折[8-10],其发生率报道不一,但相对处于较低水平。本研究回顾性分析应用保守方法治疗PVP术后骨水泥强化椎再骨折,观察治疗前后不同时间点疼痛视觉模拟评分(VAS)和Oswestry功能障碍指数(ODI)评价疗效并观察有无褥疮、坠积性肺炎、下肢静脉血栓等并发症发生,以此评估保守治疗的临床疗效及安全性。
1 资料和方法 1.1 一般资料2012年1月~2014年8月我院采用PVP治疗老年OVCFs患者324例(381椎体),其中12例(14椎体)患者再次出现腰背疼痛并经影像学检查证实为骨水泥强化椎再骨折。7例(9椎体)接受保守治疗。患者全部为女性,年龄60~78(70.9±6.3)岁,再发骨折时间为首次PVP术后2~20(8±6.7)周;前次PVP术后患者腰疼症状均有明显缓解,其7 d的VAS评分平均(1.0±0.5)分,ODI值平均(8.4%±1.6%)。
骨水泥强化椎再骨折病例纳入标准[11]:手术椎体再发骨折主要通过临床表现及影像学诊断,(1)老年OVCFs患者PVP术后症状缓解或消失后再次出现相同部位腰背部疼痛及活动受限;(2)侧位X线片检查发现椎体高度较术后降低,椎体前缘高度较术后降低1 mm以上;(3)MRI证实骨水泥灌注椎体出现骨髓水肿,T1加权像呈低信号,T2加权像骨水泥周围出现高信号区域(图 1),排除相邻其他椎体压缩性骨折。排除标准:(1)肿瘤等导致的椎体病理性骨折;(2)PVP穿刺导致的细菌感染性脊椎炎及脊髓、神经根损伤;(3)其他因素引起的腰背部疼痛。
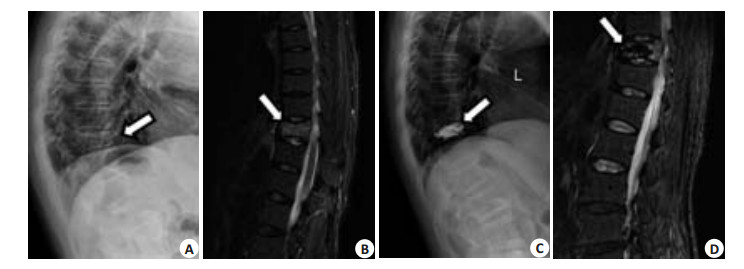
|
图 1 T10椎体PVP术后再骨折 Figure 1 T10 vertebrae refracture after PVP. A: χ-ray showing compression fracture of T10 vertebrae before PVP; B: T2WI showing bone marrow edema and compression fracture in T10 vertebra; C: The height of T10 vertebra was restored after PVP; D: Back pain recurrence at 2 weeks after PVP due to refracture in T10 vertebra shown by T2WI. |
(1)药物治疗:洛索洛芬钠片,盐酸乙哌立松片,鲑鱼降钙素鼻喷剂共3周;钙制剂及活性维生素D共6个月;(2)支具保护及功能锻炼:卧床休息3周,期间根据患者疼痛缓解情况佩戴腰背支具保护行走,并鼓励在床上进行腰背肌功能锻炼及下肢肌肉功能训练。
1.3 随访方法及疗效评价指标治疗后7 d、1、3、12个月电话随访或门诊复诊,记录疼痛VAS评分和ODI值以及有无褥疮、坠积性肺炎、下肢静脉血栓等并发症出现。
1.4 统计学处理采用SPSS 18.0统计软件(PASW,Statistics,IBM,美国)进行统计学分析。数据以均数±标准差表示。术前及术后随访疼痛VAS评分及ODI值得比较采用单因素重复测量资料方差分析,不同时间点的比较采用Bonferroni多重比较,检验水准α值取双侧0.05。
2 结果接受PVP治疗的OVCFs患者共324例(381椎),其中12例(14椎)患者出现骨水泥强化椎再骨折,占比例3.7%。7例患者(9椎体)接受保守治疗(表 1)。所有患者获得随访,随访时间13~29(21.3±11.2)个月,随访期间无褥疮、坠积性肺炎、下肢静脉血栓等并发症出现。治疗后疼痛VAS评分及ODI值均较治疗前有明显下降(表 2),差异有统计学意义(P < 0.05),治疗后7 d、1个月、3个月比较差异有统计学意义(P < 0.05),3个月与12个月比较差异无统计学意义(P > 0.05)。疼痛VAS评分由治疗前(8.3±0.8)分降至治疗后1个月(3.1±1.2)及3个月(0.8±0.7),ODI值由治疗前平均(88.3%±3.2%)降至之后1个月(56.3%±7.7%)及3个月(5.9%±2.8%)。
| 表 1 PVP术后骨水泥强化椎再骨折患者的临床资料 Table 1 Clinical data of the 7 female patients with refracture in the cemented vertebrae after percutaneous vertebroplasty (PVP) |
| 表 2 治疗前后ODI值与VAS评分的比较 Table 2 Changes of VAS scores and ODI after treatment in these patients (Mean±SD) |
骨质疏松症以骨量减少和骨质量降低为主要特征,其结果是骨的脆性增加和骨折风险升高。椎体压缩性骨折是老年骨质疏松人群中最常见的骨折[1]。大约仅有三分之一的新发椎体骨折会就医,而大多数的骨折患者没有明显临床症状或症状在可以耐受范围内[16]。有症状的急性椎体骨折患者通常会出现严重的腰背部疼痛,疼痛在体位改变时加重,而疼痛的发生可能是没有诱因的或仅有轻微的外伤史。长期以来,对于没有神经症状的OVCFs,保守治疗一直是其唯一选择,包括卧床休息、止痛药物、支具保护以及腰背肌功能锻炼等。PVP以及PKP等技术的出现彻底改变了疼痛性OVCFs的治疗理念。PVP及PKP因具有微创及迅速缓解疼痛等优点成为近年来临床上治疗OVCFs的最常用方法[2-4]。自推出以来,该微创技术已得到了广泛应用,其减轻疼痛的疗效显著,无论是短期还是在长期的随访研究中大多数表现优秀[13-15]。但随着时间的推移及该治疗方法在临床上广泛开展,PVP术后再发腰背部疼痛逐渐引起人们的关注。许多研究报道显示,PVP术后相邻节段椎体骨折风险会增加,而PVP术后再发腰背部疼痛通常是由于相邻节段新发椎体的骨折所致[5-7]。此外,近年来还有文献报道,除了相邻节段椎体骨折发生会增加以外,PVP术后骨水泥强化椎也会出现再发骨折[8-10],其发生率报道不一,但相对处于较低水平。许多学者对其发生的原因进行了探讨,认为术前存在椎体骨坏死[8]、再发的轻微外伤或骨水泥强化时填充不充分等是其可能的高危因素[10]。对于PVP术后相同节段椎体再骨折的治疗,不同学者的观点不尽相同,包括再次行PVP治疗以及开放的脊柱内固定手术等[10-11]。由于病例数不多,相关的文献报道亦少,其最佳的治疗方案尚无定论。2012年1月至2014年8月间我们采用保守疗法治疗PVP术后骨水泥强化椎再骨折,通过观察相应指标评价治疗效果及并发症的发生情况,认为保守治疗能够有效缓解患者疼痛症状及改善功能,未见明显并发症,中期疗效令人满意。
传统脊柱椎体压缩骨折保守治疗方案已使用多年,虽然其中存在一些争议,也很少有Ⅰ级水平的随机对照试验的系统性研究报道[17]。但治疗方案日趋成熟,疗效确切。OVCFs的保守治疗主要包括两方面的内容:第一,缓解疼痛和康复训练,其中包括各种止痛药物、卧床休息以及支具保护下功能锻炼等;第二,评估及治疗潜在的骨质疏松症。
再发急性腰背疼痛是骨水泥强化椎再骨折患者的首要主诉,因此,止痛是保守治疗中最关键的环节。减轻疼痛可以改善患者的生活质量和提高舒适度,而且可以促进其早期活动和功能锻炼。非甾体抗炎药物(NSAIDs)是公认的缓解腰背部疼痛的一线药物。虽然担忧使用NSAIDs类药物会影响骨折愈合并进而导致骨不连发生,但NSAIDs暴露与骨不连发生之间确切关系并没有可靠的证据支持[18]。因此NSAIDs类药物仍然是骨科医师临床上最常处方的止痛药物。传统的NSAIDs类药物具有胃肠道副作用及肾毒性,而Cox-2特异性抑制剂避免了这些副作用,但其潜在的心血管风险仍不可忽视,尤其该病人群均为老年患者[19]。综合考虑上述因素,在排除患者有胃肠道疾病的情况下,我们更愿意选择传统的NSAIDs类药物或联用质子泵抑制剂作为首选的控制疼痛方案,本组患者在短期使用的情况下(1至3周)情况下,其安全性是可靠的。有文献提出,如果NSAIDs类药物疗效欠佳的情况下,可改用阿片类止痛药物[16]。由于考虑到我们的整体治疗方案已经获得足够满意的疼痛缓解疗效以及阿片类药物的诸多副作用等因素,本组患者没有采用该类药物。此外,使用肌松剂对于缓解椎旁肌肉痉挛导致的疼痛是有益的。肌松剂可以加强NSAIDs类药物的止痛效果,它可以阻止由于OVCFs引发的疼痛与椎旁肌肉痉挛之间的恶性循环[20]。因此,对于OVCFs患者,我们常规使用NSAIDs类药物加用肌松剂处方组合。此外,某些治疗骨质疏松的药物对于OVCFs的急性疼痛也具有止痛效果。其中最为熟知的是降钙素,无论对于男性还是女性患者OVCFs的急性疼痛,其止痛疗效均较出色,被许多文献推荐作为OVCFs常规止痛药物进行处方[21-22]。其止痛机理有许多假说,但有两个是比较明确的:即通过与中枢神经系统的降钙素受体直接作用发挥止痛效果,以及增加血浆中β-内啡肽水平来减轻疼痛[22]。因此,我们在所有OVCFs患者的治疗过程中均常规使用降钙素治疗。此外,研究显示,其他抗骨质疏松的药物如双磷酸盐类对于急性OVCFs也具有止痛作用[23],但考虑到在急性期卧床不便于口服及静脉用药价格昂贵等因素,本组患者未予使用。
支具的应用在脊柱椎体压缩骨折保守治疗中是一个具有里程碑意义的进步。各种脊柱支具种类繁多,其最大作用是维持脊柱在运动过程中的稳定性,因此,它对于各种由于脊柱不稳产生的疼痛均具有缓解作用。脊柱支具还可以维持脊柱的正常生理弧度,限制屈曲活动,减轻骨折椎体的轴向负荷,可以限制OVCFs后凸畸形的进展。在支具的辅助支撑作用下,急性OVCFs患者可以相对提早下地活动并可在无痛或微痛状态下进行功能锻炼,从而减少了患者的卧床时间。因此,无论是急性OVCFs还是非OVCFs的保守治疗方案均推荐佩戴支具治疗[24-25]。由于脊柱骨折好发部位等因素,胸腰矫形器是使用最多的支具类型,包括最常见的Jewitt支具和Taylor支具等,它们可以保持脊柱处于轻度过伸位并限制其屈曲活动,固定效果牢固可靠。但对于老年患者来说,理想的支架还应该具备重量轻及容易穿戴等特点,确保其舒适度以保证患者具有良好的依从性。传统的坚强支具外固定效果可靠,但对于老年患者来说会存在一些问题,如佩戴方法繁琐或不舒适以致依从性差,坚强稳定需要坚硬的材质,而这些材料容易造成老年人脆弱的皮肤不适甚至破损;此外,过度的限制作用会影响老年患者的呼吸功能,而且长时间佩戴坚强支具会导致椎旁肌肉萎缩等。因此,对于老年患者,许多学者推荐放弃使用传统的坚强支具,而转向使用轻质的软性支具[26]。我们在本组患者中使用背侧有支撑条的普通腰围,发现患者在相对早期下床时也可以保证基本无痛活动,脊柱稳定效果已经达到临床要求。
经过短期的卧床休息及药物治疗待疼痛缓解后,应该积极指导患者进行康复功能训练。功能锻炼在椎体压缩骨折中的治疗价值不言而喻,无论对于年轻患者还是老年患者,无论是保守治疗还是手术治疗,功能锻炼均是必不可少的组成部分。功能锻炼在康复早期的作用是帮助急性期的患者尽早活动,恢复日常生活;而从远期来讲,锻炼后良好的躯体机能又可以降低日常生活中的跌倒风险,从而预防再骨折的发生。在指导患者进行功能锻炼时,有两个基本目标我们应该达到:第一,加强病人躯体轴向的肌肉力量,特别是脊柱后方伸肌的力量;其次,训练病人的本体反应能力,通过改善站姿和行走功能以减少将来可能的跌倒风险。竖脊肌在脊柱后方起到张力带作用,这在维持躯干正常姿势中发挥了至关重要的作用,其所产生的生物力学效应平衡了脊柱前倾跌倒的趋势。因此,加强脊柱背伸肌肉的力量有助于维持脊柱的正常生理序列,并对于改善OVCFs的急性疼痛以及骨折后腰背部后凸畸形引发的慢性疼痛具有积极意义[27]。腰背部伸肌的力量锻炼是整个功能锻炼的核心内容。本组患者在确诊再发骨折约1周后疼痛缓解后即开始在床上进行功能锻炼,根据患者的疼痛情况及身体状况每日分批多次进行仰卧位腰背肌力量练习,在此基础上,鼓励患者早期下地行走活动。经过上述综合处理,虽然患者早期下地活动,但随访结果显示其疼痛VAS评分及功能障碍ODI值并没有因此升高。
通过本组病例的临床观察及随访结果分析,我们发现保守治疗对于PVP术后骨水泥强化椎再骨折具有良好的临床疗效及安全性,且患者的依从性好。但由于该疾病发生率比较低等因素,本研究病例数较少,随访时间较短,观察指标偏少,我们今后还将继续该项目的研究,通过继续扩大样本量,延长随访时间,以便得到更加科学可靠的结果。
| [1] |
Wang D, Dai WX, Feng J, et al. Efficacy evaluation of percutaneous vertebroplasty via an extra-pedicular approach for osteoporotic compression fracture[J].
Chin J Med,2013, 93 (11) : 845-8.
( 0) 0)
|
| [2] |
Tang H, Zhao J, Hao C. Osteoporotic vertebral compression fractures: surgery versus non-operative management[J].
J Int Med Res,2011, 39 (4) : 1438-47.
DOI: 10.1177/147323001103900432. ( 0) 0)
|
| [3] |
Huang H, He S, Fang W, et al. Percutaneous vertebroplasty for treatment of painful osteoporotic vertebral compression fractures: a retrospective analysis of clinical efficacy[J].
Chin J Med,2014, 94 (27) : 2119-22.
( 0) 0)
|
| [4] |
Li YA, Lin CL, Chang MC, et al. Subsequent vertebral fracture after vertebroplasty: incidence and analysis of risk factors[J].
Spine (Phila Pa 1976),2012, 37 (3) : 179-83.
DOI: 10.1097/BRS.0b013e3181f72b05. ( 0) 0)
|
| [5] |
任海龙, 王吉兴, 陈建庭, 等. 单侧与双侧穿刺经皮椎体成形术治疗Kummell's病的临床对比[J].
南方医科大学学报,2014, 34 (9) : 1370-4.
( 0) 0)
|
| [6] |
Blasco J, Martinez-Ferrer A, Macho J, et al. Effect of vertebroplasty on pain relief, quality of Life, and the incidence of new vertebral fractures: a 12-month randomized follow-up, controlled trial[J].
J Bone Miner Res,2012, 27 (5) : 1159-66.
DOI: 10.1002/jbmr.1564. ( 0) 0)
|
| [7] |
Ahn Y, Lee JH, Lee HY, et al. Predictive factors for subsequent vertebral fracture after percutaneous vertebroplasty[J].
J Neurosurg Spine,2008, 9 (2) : 129-36.
DOI: 10.3171/SPI/2008/9/8/129. ( 0) 0)
|
| [8] |
Heo DH, Chin DK, Yoon YS, et al. Recollapse of previous vertebral compression fracture after percutaneous vertebroplasty[J].
Osteoporos Int,2009, 20 (3) : 473-80.
DOI: 10.1007/s00198-008-0682-3. ( 0) 0)
|
| [9] |
He SC, Teng GJ, Deng G, et al. Repeat vertebroplasty for unrelieved pain at previously treated vertebral levels with osteoporotic vertebral compression fractures[J].
Spine (Phila Pa 1976),2008, 33 (6) : 640-7.
DOI: 10.1097/BRS.0b013e318166955f. ( 0) 0)
|
| [10] |
Chiu YC, Yang SC, Chen HS, et al. Clinical evaluation of repeat percutaneous vertebroplasty for symptomatic cemented vertebrae[J].
J Spinal Disord Tech,2012, 25 (8) : E245-53.
DOI: 10.1097/BSD.0b013e31825ef90f. ( 0) 0)
|
| [11] |
Chen LH, Hsieh MK, Liao JC, et al. Repeated percutaneous vertebroplasty for refracture of cemented vertebrae[J].
Arch Orthop Trauma Surg,2011, 131 (7) : 927-33.
DOI: 10.1007/s00402-010-1236-7. ( 0) 0)
|
| [12] |
Uyang SC, Chen WJ, Yu SW, et al. Revision strategies for complications and failure of vertebroplasties[J].
Eur Spine J,2008, 17 (7) : 982-8.
DOI: 10.1007/s00586-008-0680-3. ( 0) 0)
|
| [13] |
Ma XL, Xing D, Ma JX, et al. Balloon kyphoplasty versus percutaneous vertebroplasty in treating osteoporotic vertebral compression fracture: grading the evidence through a systematic review and meta-analysis[J].
Eur Spine J,2012, 21 (9) : 1844-59.
DOI: 10.1007/s00586-012-2441-6. ( 0) 0)
|
| [14] |
Huang Z, Wan S, Ning L, et al. Is unilateral kyphoplasty as effective and safe as bilateral kyphoplasties for osteoporotic vertebral compression fractures? A meta-analysis[J].
Clin Orthop Relat Res,2014, 472 (9) : 2833-42.
DOI: 10.1007/s11999-014-3745-0. ( 0) 0)
|
| [15] |
Chen H, Tang P, Zhao Y, et al. Unilateral versus bilateral balloon kyphoplasty in the treatment of osteoporotic vertebral compression fractures[J].
Orthopedics,2014, 37 (9) : e828-35.
DOI: 10.3928/01477447-20140825-61. ( 0) 0)
|
| [16] |
Klazen CA, Lohle PN, De Vries J, et al. Vertebroplasty versus conservative treatment in acute osteoporotic vertebral compression fractures (Vertos II): an open-label randomised trial[J].
Lancet,2010, 376 (9746) : 1085-92.
DOI: 10.1016/S0140-6736(10)60954-3. ( 0) 0)
|
| [17] |
Longo UG, Loppini M, Denaro L, et al. Conservative management of patients with an osteoporotic vertebral fracture: a review of the literature[J].
J Bone Joint Surg Br,2012, 94 (2) : 152-7.
( 0) 0)
|
| [18] |
Dodwell ER, Latorre JG, Parisini E, et al. NSAID exposure and risk of nonunion: a meta-analysis of case-control and cohort studies[J].
Calcif Tissue Int,2010, 87 (3) : 193-202.
DOI: 10.1007/s00223-010-9379-7. ( 0) 0)
|
| [19] |
Kearney PM, Baigent C, Godwin J, et al. Do selective cyclooxygenase-2 inhibitors and traditional non-steroidal antiinflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials[J].
BMJ,2006, 332 (7553) : 1302-8.
DOI: 10.1136/bmj.332.7553.1302. ( 0) 0)
|
| [20] |
Browning R, Jackson JL, O'malley PG. Cyclobenzaprine and back pain: a meta-analysis[J].
Arch Intern Med,2001, 161 (13) : 1613-20.
DOI: 10.1001/archinte.161.13.1613. ( 0) 0)
|
| [21] |
Knopp JA, Diner BM, Blitz M, et al. Calcitonin for treating acute pain of osteoporotic vertebral compression fractures: a systematic review of randomized, controlled trials[J].
Osteoporos Int,2005, 16 (10) : 1281-90.
DOI: 10.1007/s00198-004-1798-8. ( 0) 0)
|
| [22] |
Knopp-Sihota JA, Newburn-Cook CV, Homik J, et al. Calcitonin for treating acute and chronic pain of recent and remote osteoporotic vertebral compression fractures: a systematic review and meta-analysis[J].
Osteoporos Int,2012, 23 (1) : 17-38.
DOI: 10.1007/s00198-011-1676-0. ( 0) 0)
|
| [23] |
Armingeat T, Brondino R, Pham T, et al. Intravenous pamidronate for pain relief in recent osteoporotic vertebral compression fracture: a randomized double-blind controlled study[J].
Osteoporos Int,2006, 17 (11) : 1659-65.
DOI: 10.1007/s00198-006-0169-z. ( 0) 0)
|
| [24] |
Dai LY, Jiang LS, Jiang SD. Conservative treatment of thoracolumbar burst fractures: a long-term follow-up results with special reference to the load sharing classification[J].
Spine (Phila Pa 1976),2008, 33 (23) : 2536-44.
DOI: 10.1097/BRS.0b013e3181851bc2. ( 0) 0)
|
| [25] |
Gnanenthiran SR, Adie S, Harris IA. Nonoperative versus operative treatment for thoracolumbar burst fractures without neurologic deficit: a meta-analysis[J].
Clin Orthop Relat Res,2012, 470 (2) : 567-77.
DOI: 10.1007/s11999-011-2157-7. ( 0) 0)
|
| [26] |
Wong CC, Mcgirt MJ. Vertebral compression fractures: a review of current management and multimodal therapy[J].
J Multidiscip Healthc,2013, 6 : 205-14.
( 0) 0)
|
| [27] |
Hongo M, Miyakoshi N, Shimada Y, et al. Association of spinal curve deformity and back extensor strength in elderly women with osteoporosis in Japan and the United States[J].
Osteoporos Int,2012, 23 (3) : 1029-34.
DOI: 10.1007/s00198-011-1624-z. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
