社区获得性肺炎(community-acquired pneumonia, CAP)是指在医院外罹患的感染性肺实质(含肺泡壁,即广义上的肺间质)炎症,包括具有明确潜伏期的病原体感染而在入院后潜伏期内发病的肺炎[1]。其总体发病率为每年5~11例次/1000人,占所有下呼吸道感染的5%~12%。22%~42%的CAP患者需要住院治疗,其中1.2%~10%的住院患者因病情严重需要入住重症监护病房(ICU)[2-4]。免疫功能的状态可影响CAP的发生、发展以及转归,尤其细胞免疫是机体抵抗细菌感染的主要途径。T淋巴细胞按不同功能可分为辅助性T细胞、抑制性T细胞、效应性T细胞、细胞毒性T细胞和迟发性变态反应性T细胞;按不同表型可分为CD4+T淋巴细胞和CD8+T淋巴细胞,CD3代表总T细胞[5]。其中CD4是辅助性T细胞的主要表面标志,具有协助体液免疫和细胞免疫的功能,CD8是细胞毒性T细胞的主要表面标志,具有杀伤靶细胞的功能[6]。通过不同表面标志来检测各T淋巴细胞计数,可反应机体的细胞免疫功能。
国内外在对肺部感染、重症肺炎、小儿支气管肺炎的研究中发现,患者的细胞免疫功能下降、T淋巴细胞减少、免疫功能紊乱,且与炎症的严重程度相关[7-9]。临床中发现血常规淋巴细胞计数降低的CAP患者,T淋巴细胞绝对计数水平相对较低,病情也相对严重,但国内外关于CAP患者血常规淋巴细胞计数的变化趋势与细胞免疫水平的研究,迄今未见相关报道。本文研究CAP(以下泛指非重症患者)及重症肺炎(severe pneumonia, SP)患者血常规中淋巴细胞计数的水平,通过外周血T淋巴细胞绝对计数的变化情况,分析不同病情患者机体的细胞免疫状态,并与血常规进行对比及相关性分析,探讨血常规中淋巴细胞计数对CAP及SP患者细胞免疫功能的判断价值。
1 资料和方法 1.1 研究对象选取我院呼吸内科2012年1月~2014年7月收治的CAP患者53例,SP患者40例,共计93例。所取患者不伴有其他系统感染、肿瘤、血液系统及免疫系统等疾病,近期未应用免疫抑制剂。CAP诊断标准参照2006年中华医学会呼吸病学分会制定的《社区获得性肺炎诊断和治疗指南》 [1],SP诊断标准参照2007年ATS和美国感染病学会(IDSA)制订的《社区获得性肺炎治疗指南》 [3]。对照组(CG)选取我院门诊健康体检者52人。所有研究对象基本资料见表 1。3组在年龄、性别、体质量指数上无明显统计学差异。
| 表 1 3组受试者的基本资料 Table 1 Demographic data of the subjects |
分别留取患者入院当日及健康体检者受检时的静脉血2 mL,送至检验科行血常规分析及T淋巴细胞绝对计数检测,探讨3组受试者血常规淋巴细胞计数及T淋巴细胞绝对计数的变化。
1.3 统计学分析统计学分析采用SPSS 17.0统计软件对数据进行统计学分析,数据的正态性采用单样本Kolmogorov-Smirnov检验验证(P > 0.05认为具有正态性),计量资料以均数±标准差表示,多组间比较采用单因素方差分析(one-way ANOVA),组间均数两两比较采用LSD法检验,方差不齐时采用Tamhane's T2多重比较方法。相关性检验采用Pearson简单相关系数测定,P < 0.05具有统计学意义。两变量间线性关系采用一元线性回归建立回归方程。
2 结果 2.1 血常规淋巴细胞计数及T淋巴细胞绝对计数结果CAP及SP组受试者血常规中淋巴细胞计数及T淋巴细胞绝对计数中CD3+、CD4+、CD8+水平均明显低于对照组,差异具有统计学意义(P < 0.05)。其中SP组受试者血常规淋巴细胞计数及CD3+、CD4+水平低于CAP组,差异具有统计学意义(P < 0.05),而两组受试者CD8+水平无显著差异。3组受试者CD4+与CD8+比值无显著差异。检测结果见表 2。
| 表 2 3组受试者血常规淋巴细胞计数及T细胞绝对计数检测结果 Table 2 Lymphocyte counts and absolute T lymphocyte counts in the 3 groups |
3组受试者CD3+、CD4+、CD8+水平均与血常规中淋巴细胞计数呈显著正相关,与患者年龄不完全相关。CD3+、CD4+、CD8+与淋巴细胞计数(L)间的回归方程见图 1~3。
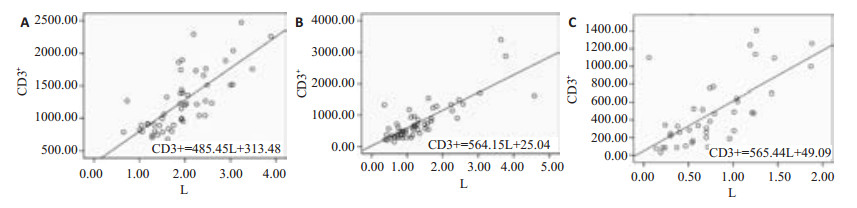
|
图 1 对照组(A)、 CAP组(B)、 SP组(C)CD3+与淋巴细胞计数间的相关性与回归方程 Figure 1 Correlation and regression equation between CD3+ and lymphocyte count in control (A), CAP (B), and SP (C) groups. |
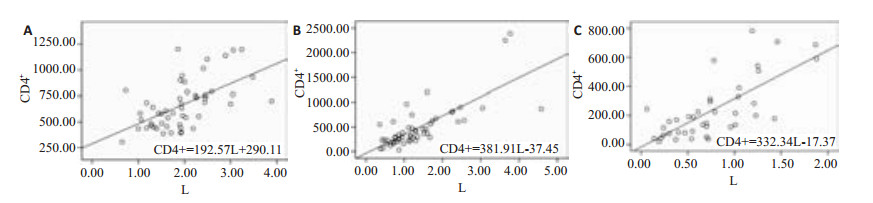
|
图 2 对照组(A)、 CAP组(B)、 SP组(C)CD4+与淋巴细胞计数间的相关性与回归方程 Figure 2 Correlation and regression equation between CD4+ and lymphocyte count in control (A), CAP (B), and SP (C) groups. |
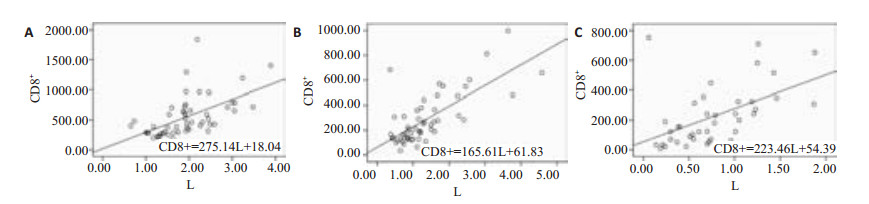
|
图 3 图 2对照组(A)、 CAP组(B)和SP组(C)CD8+与淋巴细胞计数间的相关性与回归方程 Figure 3 Correlation and regression equations between CD8+ and lymphocyte count in control (A), CAP (B), and SP (C) groups. |
近年来,随着我国人口老龄化趋势明显,病原体变迁和抗生素耐药率上升,免疫抑制性疾病增加,社区获得性肺炎的临床治疗难度越来越大[10]。当机体受到细菌、病毒等病原体感染时,淋巴细胞亚群的数量和功能发生异常,免疫机制失调,机体将出现免疫功能紊乱,导致免疫力降低从而引起疾病的发生与发展,并导致一系列的病理变化[11]。本研究中CAP及SP组受试者T淋巴细胞绝对计数中CD3+、CD4+、CD8+水平均明显低于健康对照组,差异具有统计学意义(P < 0.05),说明患者机体细胞免疫功能降低。感染患者体内T淋巴细胞总数因大量凋亡而降低,细胞因子的产生减少,免疫功能的效力下降,且单个细胞上表面标志CD4或CD8密度也随之减少,致使细胞在接受抗原刺激时免疫应答更弱,发挥的免疫效能更低,尤其重症感染对机体的细胞免疫功能抑制更为严重[12]。本研究中SP组受试者CD4+水平显著低于CAP组受试者,而两组间CD8+水平无显著差异,考虑CD4+T淋巴细胞既参与细胞免疫又协助体液免疫的介导,在重症患者的体内大量消耗,致使水平显著降低。可见CAP患者细胞免疫功能下降,重症患者更为显著,对患者细胞免疫功能的监测有助于评估疾病严重程度。
T淋巴细胞水平能够反映机体的细胞免疫功能,其动态变化能够评估疗效、预示疾病的转归。研究表明持续的T淋巴细胞降低,尤其是CD4+水平的降低,对疾病的诊疗及预后有一定程度的提示意义,如果积极治疗1周后T淋巴细胞水平仍不能恢复甚至进行性下降,则提示预后不良[13]。在对艾滋病患者机会性感染的分析中,CD4+≥200的患者机会性感染率明显少于CD4+ < 200的患者,尤其是当CD4+ < 50时机会性感染更加复杂凶险,临床上对于CD4+T淋巴细胞 < 200的患者,酌情给予抗肺孢子菌肺炎的预防性治疗[14]。胸腺肽具有调节和增强人体细胞免疫功能的作用,能促使外周血中T淋巴细胞的成熟,增加各种淋巴因子的分泌及其受体水平,激活T辅助细胞并增强NK细胞的作用。有研究者对比胸腺肽联合美罗培南和单独应用美罗培南治疗革兰阴性杆菌下呼吸道感染,证明加用胸腺肽组总有效率明显高于单独应用抗生素组,且临床症状缓解时间明显缩短[15]。观察胸腺肽α1对气管切开的危重病人肺部感染的治疗作用,发现治疗组肺部感染率、二重感染率、混合感染率明显降低,白细胞、C反应蛋白、肿瘤坏死因子、白细胞介素-6等炎性指标明显下降[16]。所以在治疗CAP的时候,要注重对患者细胞免疫水平的监测和改善,T淋巴细胞绝对计数的检测便尤为重要。
在我院,T淋巴细胞绝对值计数的检验费用为352元,而血常规的检验费用为27.5元。已有研究表明淋巴细胞计数对HIV患者CD4计数有替代效用,是监测HIV感染的较为经济的方法[17-19]。而本研究中CD3+、CD4+、CD8+水平与血常规中淋巴细胞计数呈显著正相关,可建立CD3+、CD4+、CD8+与淋巴细胞计数(L)间的回归方程,通过对血常规的检测,了解患者的细胞免疫水平。在疾病治疗期间,亦可通过复查血常规评估患者细胞免疫功能的恢复情况,判断疾病的预后,指导临床治疗,节约检验成本。在无法开展T淋巴细胞绝对计数的医院,可通过血常规中淋巴细胞计数计算T淋巴细胞绝对计数,评估机体免疫功能状况,反映病情的严重程度。今后也有待增加样本量来进一步研究两者的相关性,提供更加精确的对照。
| [1] |
中华医学会呼吸病学分会. 社区获得性肺炎诊断和治疗指南[J].
中华结核和呼吸杂志,2006, 29 (10) : 651-5.
( 0) 0)
|
| [2] |
余丹阳. 国外社区获得性肺炎(CAP)诊治指南解读[J].
中国药物应用与监测,2012, 9 (2) : 63-6.
( 0) 0)
|
| [3] |
Mandell LA, Wunderink RG, Anzueto A, et al. Infectious diseases society of America/American thoracic society consensus guidelines on the management of community-acquired pneumonia in adults[J].
Clin Infect Dis,2007, 44 (Suppl 2) : S27-72.
( 0) 0)
|
| [4] |
王吉耀, 廖二元, 黄从新.
内科学[M]. 北京: 人民卫生出版社, 2005 : 50 -63.
( 0) 0)
|
| [5] |
Reade MC, Huang DT, Bell D, et al. Variability in management of early severe sepsis[J].
Emerg Med J,2010, 27 (2) : 110-5.
DOI: 10.1136/emj.2008.070912. ( 0) 0)
|
| [6] |
Korn T, Bettelli E, Oukka M, et al. IL-17 and Th17 cells[J].
Annu Rev Immunol,2009, 27 (4) : 485-517.
( 0) 0)
|
| [7] |
Kim JE, Bauer S, La KS, et al. CD4 +/CD8 + T lymphocytes imbalance in children with severe 2009 pandemic influenza A (H1N1) pneumonia[J].
Korean J Pediatr,2011, 54 (5) : 207-11.
DOI: 10.3345/kjp.2011.54.5.207. ( 0) 0)
|
| [8] |
Plonquet A, Bastuji-Garin S, Tahmasebi F, et al. Immune risk phenotype is associated with nosocomial lung infections in elderly in-patients[J].
Immun Ageing,2011, 8 : 8.
DOI: 10.1186/1742-4933-8-8. ( 0) 0)
|
| [9] |
山浩明, 张兰芳, 张琴. 小儿支气管肺炎的淋巴细胞亚群的变化[J].
中华急诊医学杂志,2012, 21 (5) : 488-90.
( 0) 0)
|
| [10] |
袁蓓, 杜娟, 唐凤婕, 等. 《社区获得性肺炎诊疗指南》与Fine危险分层在社区获得性肺炎中的应用价值[J].
贵阳医学院学报,2015, 40 (5) : 493-6.
( 0) 0)
|
| [11] |
朱晓华, 陈强, 柯江维, 等. 支气管肺炎患儿免疫功能变化的临床分析[J].
中国当代儿科杂志,2013, 15 (3) : 175-8.
( 0) 0)
|
| [12] |
Pawelec G, Barnett Y, Forsey R, et al. T cells and aging[J].
Front Biosci,2002, 7 (5) : 1056-183.
( 0) 0)
|
| [13] |
Amante FH, Haque A, Stanley AC, et al. Immune-mediated mechanisms of parasite tissue sequestration during experimental cerebral malaria[J].
J Immunol,2010, 185 (6) : 3632-42.
DOI: 10.4049/jimmunol.1000944. ( 0) 0)
|
| [14] |
Liu BC, Zhang L, Su JS, et al. Treatment of postoperative infectious complications in patients with human immunodeficiency virus infection[J].
World J Emerg Med,2014, 5 (2) : 103-6.
DOI: 10.5847/wjem.j.issn.1920-8642.2014.02.004. ( 0) 0)
|
| [15] |
杨洪吉, 王凤侠, 陈冉, 等. 美罗培南联合胸腺肽治疗革兰阴性杆菌下呼吸道感染的疗效分析[J].
中华医院感染学杂志,2013, 23 (20) : 5040-1.
( 0) 0)
|
| [16] |
Huang DP, Yang M, Peng WP, et al. Prevention and management of lung infections with thymosin alpha1 in critical patients with tracheotomy[J].
Nan Fang Yi Ke Da Xue Xue Bao,2006, 26 (1) : 128-9.
( 0) 0)
|
| [17] |
Karanth SS, Rau NR, Gupta A, et al. Utility of total lymphocyte count as a surrogate for absolute CD4 count in the adult Indian HIV population: A prospective study[J].
Avicenna J Med,2014, 4 (1) : 1-4.
DOI: 10.4103/2231-0770.127413. ( 0) 0)
|
| [18] |
Gautam H, Saini S, Bhalla P, et al. Use of total lymphocyte count to predict absolute CD4 count in HIV-seropositive cases[J].
J Int Assoc Physicians AIDS Care (Chic),2010, 9 (5) : 292-5.
DOI: 10.1177/1545109710373826. ( 0) 0)
|
| [19] |
Kakar A, Beri R, Gogia A, et al. Absolute lymphocyte count: a cost-effective method of monitoring HIV-infected individuals[J].
Indian J Pathol Microbiol,2011, 54 (1) : 107-11.
DOI: 10.4103/0377-4929.77349. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
