2. 南方医科大学南方医院妇产科生殖医学 中心,广东 广州 510515
2. Department of Obstetrics and Gynecology, Center for Reproductive Medicine, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
中心体是所有真核生物体内都存在的一种微管结构[1-2],由典型的9条对称的粗纤维组成纤维带,长500 nm,直径275 nm [3]。精子形成过程中,精子中心体丢失大部分中心粒周围的基质(PCM)并保留微管结构[4]。成熟精子在精子头尾处有两个相互垂直的中心粒,即近端中心粒和远端中心粒,后者在精子形成过程中逐步退化[5]。对多数脊椎动物而言,中心体遗传属于父源性遗传[5-6],精子入卵后,以中心粒为中心逐步形成精星体,同时在精星体的牵引下雌雄原核逐渐靠近并融合。中心粒与卵子中的PCM形成新的中心体,且复制始于原核期,合子的中心体将成为体细胞中心体的前身[7]。
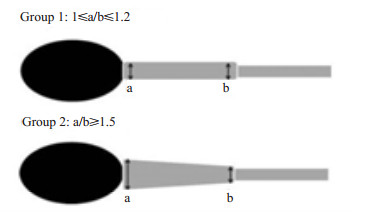
对曾进行过ICSI治疗且受精失败的接受辅助生育技术(ART)患者的卵母细胞研究后发现,受精受阻可能是因精子中心体功能异常所致[8],由此可见精子中心体在受精过程中扮演着极其重要的角色[9]。为此,需要研究者进行有关精子中心体功能的相关研究。2002年,Nakamura等[10]利用不同中心体结构异常的精子注射入卵母细胞来评估其功能,研究结果认为受精失败可能是精子中心体功能异常所致。导致辅助生育治疗患者受精失败的影响因素较多,其中纤维鞘异常(DFS)是一种很少见的畸形,DFS的精子丧失其运动能力以及精子中心体异常都会导致受精失败[11]。随着显微镜技术的不断发展,精子形态对于辅助生育结局的影响越来越受到业内人士的重视,比如精子头部空泡、精子中段形态等。那么,精子中段形态与其中心体功能的关系以及不同中段形态是否对辅助生育结局产生影响等这些问题引起了我们的关注,并希望通过本实验检验MSOME技术能否通过挑选某种中段形态的精子进行显微注射,从而获得更好的助孕结局。本研究利用精子放大系统将精子放大6000倍观察后,按照精子中段形态将这些精子分为3组A组: 1≤a/b≤1.2;B组: a/b≥1.5;C组:其他形态不规则(a/b表示精子中段近端直径/远端直径),并将每组精子分别注射入卵后观察卵子的正常受精情况、胚胎发育情况和胚胎着床情况,这是国内首次对ART患者尝试从精子形态学角度评估精子中心体功能,以及精子中段形态对胚胎发育的影响。
1 资料和方法 1.1 资料 1.1.1 研究对象观察2014年1~11月在成都锦江妇幼保健院行ICSI治疗的57例患者(含9例重复周期)。患者促排卵方案为我院标准方案。我院行ICSI患者的指征[12]:(1)严重少、弱、畸精子症;(2)不可逆的梗阻性无精子症;(3)生精功能障碍(排除遗传缺陷疾病所致);(4)男性免疫性不育;(4)体外受精失败;精子顶体异常。
1.1.2 研究对象分组57例研究对象的精子标本按照MSOME高倍镜(×6000)观察下中心体形态进行分组。高倍镜下观察到精子的中段形态可分为3组: A组: 1≤a/ b≤1.2;B组: a/b≥1.5;C组:其他形态不规则(a/b表示精子中段近端直径/远端直径)(图 1)[14]。
|
图 1 根据精子中心体a/b比值分1,2两组 Figure 1 Classification of the sperms according to sperm midpiece morphology. Sperms with a proximal /distal diameter ratio between 1 and 1.2 were allocated in group 1, and those with a ratio exceeding 1.5 in group 2. |
标准方案:黄体中期肌注GnRHa 0.05 mg(达必佳,FERRING, Swiss),14 d后rFSH 150~300 U刺激卵巢(果纳芬,Merck,Germany),随后B超监测卵泡发育情况,优势卵泡≥18 mm后,肌注HCG 250 mg(艾泽,Merck,德国),36 h后B超下经阴道穿刺取卵。取卵至少2 h后,利用透明质酸酶(Hyaluronidase,80 U/mL,Sage,USA)脱颗粒细胞后,置于微滴(G-IVF,Vitrolife,Swedish)中培养,并将培养皿放置于37 ℃、6% CO2的培养箱(Thermo Scientific Forma 3110,USA)。
1.2.2 精子的处理患者精液采用梯度离心法或直接离心法处理,处理后的精子与精子缓冲液(spermrinse,Vitrolife,Swedish)混匀,放入37 ℃、6% CO2的培养箱(Thermo Scientific Forma 3110,USA)中备用。
1.2.3 低倍镜下挑选精子过程将处理后的精液吸取少许加入注射皿中的聚乙烯吡咯烷酮(PVP)或缓冲液液滴里,然后在400倍显微镜(NIKON TE-2000U,日本)下挑选精子形态正常的精子(挑选时主要观察指标:精子顶体形态、头部形态、颈部形态及颈部液滴、尾部形态,要尽量挑选前向运动的精子,如果死精子较多时可选微动精子或尾部弯曲的精子),观察到所要挑选的精子后,用注射针在精子尾部靠近头部的1/3处迅速制动(当看到精子尾部明显折痕时,表示制动完成),随后,从尾部吸入被制动的精子放置在PVP标记过的位置,待下一步精子放大系统观察所挑选精子。
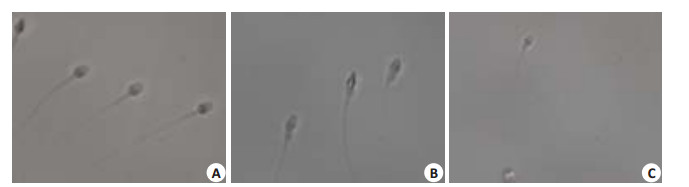
1.2.4 精子放大系统精子在低倍镜下挑选好后,利用精子放大系统对精子进行再次放大观察[13]并拍照,然后测量精子中段形态(分A、B、C 3组)[14] 图 2)。再次放大观察过程中不会对患者精子造成任何损伤,另外观察结束后依然按照低倍镜下挑选好的精子进行注射,随后根据注射顺序进行单独培养。
|
图 2 3组不同中段形态的精子 Figure 2 Sperm midpiece morphology in the three groups (Original magnification: × 4000). A: Sperms with midpiece proximal diameter/distal diameter ratio between 1 and 1.2; B: Sperms with midpiece proximal / distal diameter ratio more than 1.5; C: A sperm with irregular midpiece shape. |
本实验室胚胎培养均置于37 ℃、6% CO2中进行序贯培养(卵裂期胚胎用G-1/囊胚用G-2,Vitrolife,Swedish)。注射后16~20 h观察卵子受精情况(两原核视为正常受精)。D3胚胎参考WIH [15]评分法,囊胚参考Gardner [16]评分法来对患者胚胎进行评分。
1.2.6 胚胎移植与妊娠结果判断患者移植胚胎后14 d尿检hCG,阳性患者2周后行阴道超声检查,发现宫内孕囊则判定为临床妊娠。
1.3 统计学分析实验结果采用SPSS 21.0软件进行统计学分析,计量资料用均数±标准差,采用单向方差分析,计数资料百分率采用R×C表卡方检验,以P < 0.05为有统计学意义。
2 结果 2.1 不同中段形态的精子与胚胎发育不同中段形态的精子注射入卵后,A,B,C 3组中正常受精率、D3优胚率、可用囊胚率、胚胎冷冻率均无显著性差异(P>0.05,表 1)。
| 表 1 不同中段形态的精子对胚胎发育的影响 Table 1 Outcomes of embryo development following sperm injection in the 3 groups |
研究结果表明,D3移植优胚率和胚胎着床率具有显著性差异(P < 0.05,表 2)。
| 表 2 不同中段形态的精子注射入卵后胚胎着床情况 Table 2 Implantation rates of embryos in the 3 groups |
部分哺乳动物(比如猪、人等[21-22])已被证实中心体的遗传属于父源性遗传。对于人类而言,男性精子在形成的过程中,初始精原细胞中典型的中心体结构经过逐步降解以及较为复杂的修饰作用后,最终成熟精子中仅仅保留了近端中心粒[22],当卵母细胞被精子激活后,排出第二极体,精子近端中心粒与卵子胞质中的中心体基质进行重组,此时以精子颈部中段的中心粒为中心形成精星体[19-21],在精星体的牵引下,雌雄原核逐渐靠近最终融合形成受精卵。中心粒在原核期开始复制后均分至第1次胚胎分裂的纺锤体两极,合子的中心体是胚胎、胎儿和成年体细胞中心体的前身[15]。本文中,不同中心体形态的精子注射入卵后,尽管统计学差异不显著,但从数据上看存在着一定的差异,中心体形态较差的精子注射后,正常受精率较低,仅为63.5%。因此,精子中心体对于卵母细胞的正常受精,精星体的形成以及雌雄原核的形成起着关键性的作用。
随着对精子形态研究的不断深入,扫描电镜下观察精子给了我们很多有趣的提示-精子形态和内部结构也许存在某种关联,因为内部结构异常往往伴随着形态异常,比如圆头精子,当对其内部遗传物质稳定性进行相关研究时证实圆头精子多表现出紊乱的染色质状态以及异常的染色体结构[14, 17-18]。同时,有研究发现低倍镜(×400)下精子活力正常,但高倍镜(×6000)下观察到精子中段形态呈锥形时,该类精子注射入牛卵后精星体形成率较低,选择中段较直的精子,有利于改善精星体的形成率[17]。该结论与本研究相吻合,本文对精子中心体不同形态注射入卵后,观察卵子的受精情况,结果显示,精子中心体形态较好的AB组精子注射后,受精率分别为80%和73%,明显高于C组的受精情况。从这些研究推测精子中段形态异常可能会导致精子中心体功能异常。研究精子中心体功能最好的方法是将不同精子注射入卵,观察精星体的形成,该类试验多用哺乳动物的卵子进行研究。Rawe等[23]利用不育男性精子注射入牛卵,每条精子在注射入卵后均在颈部形成精星体,随后形成多个有丝分裂的纺锤体,但是未见多极纺锤体。而孤雌激活的牛卵子中未见微管结构,由此推断当人精子注射入牛卵时,精子中心体可能对受精过程发挥极其重要的作用。
另外,研究者对圆头精子患者和DFS的不育患者精子与有生育能力的男性精子相比,圆头精子症患者形态异常的精子注射入卵后精星体形成率低于后者,同时还观察到精子中段形态异常的精子注射入卵后所形成的中心体排列絮乱[24]。上述的研究表明,精子中心体功能可能与精子中段形态存在某种相关性。形态较差的精子其中心体功能可能存在异常。另外有研究者利用形态选择性胞浆内单精子注射技术(IMSI)对精液参数正常者、少弱精子症患者、少弱畸精子症患者精子进行形态挑选后检测精子中DNA碎片率,结果发现3组分别为21.1%、31.8%和54.1%,结果提示精液参数和精子DNA碎片率相关[24]。Him等[25]将少弱畸精症患者分为两组,一组进行传统的ICSI治疗;另一组将在MSOME放大系统下对精子进行更细微的形态学观察,挑选出形态最佳的精子进行注射。最终对IMSI和ICSI治疗后的助孕结局进行对比分析,结果发现二者受精率无显著性差异,临床妊娠率和着床率均差异显著。与此同时本文中不同中心体形态的精子注射后,移植优质胚胎率和胚胎着床率均差异显著(P < 0.05)。这些研究结果提示我们,从精子形态学角度出发,精子的形态多样性可能与某些内部结构的不同状态存在紧密联系,当利用更加精确的精子挑选系统对精子进行观察及分类后,将不同形态的精子注射入卵母细胞会得到不同的助孕结局。从而本研究中并未对患者进行筛选,仅仅从精子中段形态角度考察其中心体功能,并最终观察不同中段形态对助孕结局是否产生影响。研究结果显示,精子中段形态不规则的精子,注射入卵后正常受精率有所下降,尤其是精子中段形态不规则的精子,其正常受精率仅为63.5%,由此可推断精子中段形态的变化会影响精卵的正常受精,本研究由于样本量较少,这一结果并没有表现出显著性差异,我们需要进一步累计较多的临床数据再进行进一步分析。
精子中心体不仅在受精过程中起着关键作用,Yoshinmoto等[26]用不育患者的精子注入牛卵母细胞中来评估精子中心体功能,发现早期的胚胎卵裂及后期的种植、妊娠过程与中心体功能存在联系,正常情况下胚胎进行对等分裂,分裂中每个卵裂球都含1个中心体和1套染色体,当中心体功能异常时,胚胎发生不均等分裂,可能有1或2个卵裂球无细胞核,这也表明中心体功能对早期胚胎的分裂发育也产生一定的影响。早起胚胎发育过程中卵裂球的分裂往往呈几何倍数增长,但是在日常胚胎实验室工作中经常会观察到D2胚胎的卵裂球数呈奇数,其中部分卵裂球中并未观察到原核,该现象有时在囊胚阶段也能观察到[27-28]。Kim等[29]研究表明,将患者精子行ICSI注入卵中精星体的形成始于精子颈部,如果注射精子仅仅是精子头部时,精星体的形成始于卵子,此时形成的胚胎类似于孤雌激活的胚胎。本研究中精子中心体形态为C组的D3优胚率和囊胚形成率分别为18.8%和9.09%,均低于A、B两组,尽管C组中正常受精率为63.5%,但是后续的胚胎发育潜能欠缺,同时移植3例患者中9枚胚胎均来自C组的精子注射入卵形成胚胎,无一例胚胎着床。研究结果提示我们是不是精子中心体形态除了影响精星体的形成外,参与的后续的胚胎发育情况,这一结论也验证了Yoshinmoto等学者的推断[26]。由于样本量较少,对与该假设仍然需要进一步的积累并证实。可以肯定的是利用精子放大系统选择那些精子中段较直的精子注射入卵,能获得较为理想的正常受精率。
| [1] |
Hodges ME, Scheumann N, Wickstead BA, et al. Reconstructing the evolutionary history of the centriole from protein components[J].
J Cell Sci,2010, 123 (9) : 1407-13.
DOI: 10.1242/jcs.064873. ( 0) 0)
|
| [2] |
Carvalho-Santos Z, Azimzadeh J, Pereira-Leal JB, et al. Tracing the origins of centrioles, cilia, and flagella[J].
J Cell Biol,2011, 194 (2) : 165-75.
DOI: 10.1083/jcb.201011152. ( 0) 0)
|
| [3] |
Chre'tien D, Buendia B, Fuller SD, et al. Reconstruction of the centrosome cycle from cryoelectron micrographs[J].
J Struct Biol,1997, 120 (6) : 117-33.
( 0) 0)
|
| [4] |
Lu¨ders J, Stearns T. Microtubule-organizing centres: a reevaluation[J].
Nat Rev Mol Cell Biol,2007, 24 (8) : 161-7.
( 0) 0)
|
| [5] |
Li S, Fernandez JJ, Marshall WF, et al. Threedimensional structure of basal body triplet revealed by electron cryotomography[J].
EMBO,2012, 31 (1) : 552-62.
( 0) 0)
|
| [6] |
Guichard P, Hachet V, Majubu N, et al. Native architecture of the centriole proximal region reveals features underlying its 9-Fold radial symmetry[J].
Cur Biol,2013, 23 (17) : 1620-8.
DOI: 10.1016/j.cub.2013.06.061. ( 0) 0)
|
| [7] |
Palermo GD, Colombero LT, Rosenwaks Z. The human sperm centrosome is responsible for normal syngamy and early embryonic development[J].
Rev Reprod,1997, 2 (1) : 19-27.
DOI: 10.1530/ror.0.0020019. ( 0) 0)
|
| [8] |
Rawe VY, Olmedo SB, Nodar FN, et al. Cytoskeletal organization defects and abortive activation in human oocytes after IVF and ICSI failture[J].
Mol Hum Reprod,2000, 6 (6) : 510-6.
DOI: 10.1093/molehr/6.6.510. ( 0) 0)
|
| [9] |
Schatten H, Sun QY. New insights into the role of centrosomes in mammalian fertilization and implications for ART[J].
Reproduction,2011, 142 (6) : 793-801.
DOI: 10.1530/REP-11-0261. ( 0) 0)
|
| [10] |
Nakamura S, Terada Y, Horiuchi T, et al. Analysis of the human sperm centrosomal function and the oocyte activation ability in a case of globozoospermia, by ICSI into bovine oocytes[J].
Hum Reprod,2002, 17 (11) : 2930-4.
DOI: 10.1093/humrep/17.11.2930. ( 0) 0)
|
| [11] |
Terada YT, Nakamura SN, Okamura KO. A trial to restore defective human sperm centrosomal function[J].
Int J Androl,2005, 28 (5) : 29.
( 0) 0)
|
| [12] |
中华医学会.
临床诊疗指南-辅助生殖技术与精子库分册[M]. 人民卫生出版社出版, 2009 : 9 .
( 0) 0)
|
| [13] |
Sifer C, El Khattabi L, Dupont CA, et al. Could sperm grade under high magnification condition predict IMSI clinical outcome[J].
Eur J Obstet Gynecol Reprod Biol,2014, 181 (8) : 189-94.
( 0) 0)
|
| [14] |
Ugajin T, Terada Y, Hasegawa H, et al. The shape of the sperm midpiece in intracytoplasmic morphologically selected sperm injection relates sperm centrosomal function[J].
J Assist Reprod Genet,2010, 27 (2/3) : 75-81.
( 0) 0)
|
| [15] |
Berkovitz A, Eltes F, Ellenbogen A, et al. Does the presence of nuclear vacuoles in human sperm selected for ICSI affect pregnancy outcome[J].
Hum Reprod,2006, 21 (7) : 1787-90.
DOI: 10.1093/humrep/del049. ( 0) 0)
|
| [16] |
Jequier AM. Clinical andrology--still a major problem in the treatment of infertility[J].
Hum Reprod,2004, 19 (6) : 1245-9.
DOI: 10.1093/humrep/deh269. ( 0) 0)
|
| [17] |
Dirican EK, Isik A, Vicdan K, et al. Clinical pregnancies and livebirths achieved by intracytoplasmic injection of round headedacrosomeless spermatozoa with and without oocyte activation in familial globozoospermia: case report[J].
Asian J Androl,2008, 10 (2) : 332-4.
DOI: 10.1111/ajan.2008.10.issue-2. ( 0) 0)
|
| [18] |
Harbuz R, Zouari R, Pierre V, et al. A recurrent deletion of DPY19L2 causes infertility in man by blocking sperm head elongation and acrosome formation[J].
Am J Hum Genet,2011, 88 (3) : 351-61.
DOI: 10.1016/j.ajhg.2011.02.007. ( 0) 0)
|
| [19] |
Fawcett DW, Phillips DM. The fine structure and development of the neck region of the mammalian spermatozoon[J].
Anat Rec,1969, 165 (2) : 153-84.
DOI: 10.1002/(ISSN)1097-0185. ( 0) 0)
|
| [20] |
Rhonda RS, David JH, Timothy LK. The biology and evolution of polyspermy:insights from cellular and functional studies of sperm and centrosomal behavior in the fertilized egg[J].
Reproduction,2011, 142 (6) : 779-92.
DOI: 10.1530/REP-11-0255. ( 0) 0)
|
| [21] |
Bornens M. The centrosome in cells and organisms[J].
Science,2012, 335 (667) : 422-6.
( 0) 0)
|
| [22] |
Sathanathan AH, Ratnam SS, Ng SC, et al. The sperm centriole: Its inheritance, replication and perpetuation in early human embryos[J].
Hum Reprod,1996, 11 (2) : 345-56.
DOI: 10.1093/HUMREP/11.2.345. ( 0) 0)
|
| [23] |
Rawe VY, Olmedo SB, Nodar FN, et al. Cytoskeletal organization defects and abortive activation in human oocytes after IVF and ICSI failure[J].
Mol Hum Reprod,2000, 6 (6) : 510-6.
DOI: 10.1093/molehr/6.6.510. ( 0) 0)
|
| [24] |
Maettner R, Sterzik K, Isachenko V, et al. Quality of human spermatozoa: relationship between high-magnification sperm morphology and DNA integrity[J].
Andrologia,2014, 46 (5) : 547-55.
DOI: 10.1111/and.2014.46.issue-5. ( 0) 0)
|
| [25] |
Kim HJ, Yoon HJ, Jang JM, et al. Comparison between intracytoplasmic sperm injection and intracytoplasmic morphologically selected sperm injection in oligo-astheno-teratozoospermia patients[J].
Clin Exp Reprod Med,2014, 41 (1) : 9-14.
DOI: 10.5653/cerm.2014.41.1.9. ( 0) 0)
|
| [26] |
Yoshimoto-Kakoi T, Terada Y, Tachibana MA, et al. Assessing centrosomal function of infertile males using heterologous ICSI[J].
Syst Biol Reprod Med,2008, 54 (3) : 135-42.
DOI: 10.1080/19396360802043091. ( 0) 0)
|
| [27] |
Stevenson VA, Kramer J, Kuhn J, et al. Cen-trosomes and the scrambled protein coordinate micro-tubule-independent actin reorganization[J].
Nat Cell Biol,2001, 3 (1) : 68-75.
DOI: 10.1038/35050579. ( 0) 0)
|
| [28] |
Sun QY, Schatten H. Centrosome inheritance after fertilization and nuclear transfer in mammals[J].
Adv Exp Med Biol,2007, 591 (6) : 58-71.
( 0) 0)
|
| [29] |
Kim NH, Simerly C, Funahashi H, et al. Microtubule organization in porcine oocytes during fertilization and parthenogenesis[J].
Biol Reprod,1996, 54 (6) : 1397-404.
DOI: 10.1095/biolreprod54.6.1397. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
