2. 广州医科大学第三附属医院麻醉科,广东 广州 510150
2. Department of Anesthesiology, Third Affiliated Hospital of Guangzhou Medical University, Guangzhou 510150, China
肺移植是治疗各种终末期肺功能衰竭的最有效方法,但肺不同于肝、肾,它是一个空腔脏器,冷缺血保存时间只有4~6 h,而且常常伴有严重的缺血再灌注损伤。肺缺血再灌注损伤(Lung ischemia reperfusion injury, LIRI)是一个复杂的病理生理过程,以往研究表明其与炎症、活性氧自由基的释放、促炎介质释放、白细胞活化、细胞表面黏附分子上调、及保护性介质如肺泡表面活性物质的减少等因素相关[1]。肺泡巨噬细胞是启动LIRI的重要细胞,供体肺内的巨噬细胞在再灌注时迅速活化并释放促炎因子如TNF-α、单核细胞化学趋化蛋白-1等。而中性粒细胞是参与肺移植后LIRI中、后期的主要细胞[2],在再灌注时粘附在血管内皮细胞表面,通过在细胞表面表达选择性蛋白,释放有害的蛋白酶、氧自由基[3]、细胞因子如TNF-α、血小板活化因子(platelet-activating factor)而加剧肺组织的损伤。所有这些变化将直接或间接导致微血管系统的生理变化,表现为肺血管阻力和微血管通透性增加,进一步引起通气血流比例失调导致气体交换障碍[4],移植肺再灌注水肿,甚至肺功能丧失。LIRI成为威胁肺移植手术成功与否的重要因素。到目前为止,LIRI治疗的还是以支持、对症治疗为主,尚无比较确定的特异性预防、治疗LIRI的手段或药物。因此,最大程度的减少肺缺血再灌注损伤成为肺移植技术发展的一个重要瓶颈。我们前期的实验证实肺内灌注[5]或雾化吸入[6]乳化氟碳(perfluorocarbon)结合川芎嗪(ligustrazine)能降低猪急性肺损伤后的肺部炎症,对受损肺脏有确切的保护作用。两者联合静脉注射目前尚未见报导,本实验将乳化氟碳结合川芎嗪以静脉注射的给药方式,更切合临床应用,探讨其对肺缺血再灌注损伤的影响,为临床肺移植手术PIRI的治疗提供更充足的理论依据。
1 材料和方法 1.1 实验动物清洁级Sprague-Dawey(SD)大鼠,体质量350~400 g,由广东省医学实验动物中心提供,动物饲养于清洁级环境,自由摄食、饮水,室温20~25 ℃,湿度40%~70%。
1.2 方法 1.2.1 大鼠肺缺血再灌注模型的建立参照Eppinger [7]、杨世疆[8]的方法建立大鼠肺缺血再灌注模型。选取40只清洁级同系纯种雄性Sprague-Dawey(SD)大鼠,体质量350~400 g,由广东省医学实验动物中心提供。所有大鼠均术前禁食12 h,不禁水,术前30 min在大鼠后肢外侧肌注硫酸阿托品0.4 mg/kg。1%的戊巴比妥钠50 mg/kg腹腔注射麻醉,然后作气管切开并置入静脉留置针(已拔出针芯)行机械通气,呼机机参数为:呼吸频率75次/min,呼吸比1:2,潮气量10 mL/kg。开胸后显露肺门,无创血管钳钳夹左肺门致左肺门血管无舒缩,左肺无通气,调整呼吸机潮气量至原来的2/3,持续45 min。然后松开血管钳恢复血供,调整呼吸机恢复至原来的潮气量,持续通气3 h,即认为模型制作成功。
1.2.2 乳化氟碳联合川芎嗪对肺缺血再灌注损伤保护作用将40只健康雄性SD大鼠随机分为4组,每组10只,即对照组(C组)、川芎嗪组(T组)、乳化氟碳组(P组)及川芎嗪联合乳化氟碳组(TP组)。C组在恢复血供前5 min由鼠尾静脉注入生理盐水0.2 mL/10 g;T组在恢复血供前5 min由鼠尾静脉注入川芎嗪注射液0.1 mL/10 g,随后注入0.1 mL/10 g生理盐水;P组则在恢复血供前5 min由鼠尾静脉注入0.1 mL/10 g乳化氟碳,随后注入0.1 mL/ 10 g生理盐水;TP组则在恢复血供前5 min由鼠尾静脉同时注入0.1 mL/10 g乳化氟碳及0.1 mL/10 g川芎嗪注射液。
1.2.3 组织取样及测定方法恢复血供3 h后,1%的戊巴比妥钠50 mg/kg腹腔注射麻醉,打开、充分显露胸腹腔,止血钳夹闭左肺门,整块取出左肺,分别在各肺叶同一部位剪一小块组织放入福尔马林溶液中浸泡,用于常规步骤制作切片及HE染色;其余肺组织立即用无菌冷PBS缓冲液漂洗肺组织,取适量肺组织剪碎放入匀浆管,加入19倍冷生理盐水,在冰浴中充分手动研磨制成5%匀浆,离心后取上清冻存于-80 ℃冰箱中。分别取样本测MDA、MPO、SOD、TNF-α含量。SOD含量的测定采用WST法完成,MDA含量的测定采用TBA法完成,TNF-α、及MPO采用ELISA法测定,严格按照说明书操作。
HE染色后的切片在光镜下观察,主要观察:肺泡及肺泡间质有无水肿增厚,肺泡腔有无红细胞渗出,有无炎性细胞浸润,有无纤维蛋白渗出。无此项病理改变记为1分,病理变化轻微且位置局限记为2分,病理变化显著但位置局限或病理变化轻微但病变广泛记为3分,广泛显著病变记为4分。各观察项目分别评分,累加后即为此样本得分,每例10个样本均参与评分,取其平均值作为该例病理检查最终得分,从而综合全面的评估肺损伤程度。
1.3 统计学处理所有数据以均数±标准差表示,用SPSS 17.0统计软件分析,数据间的比较采用析因设计的方差分析方法加以分析;P < 0.05为差异有统计学显著性。
2 结果 2.1 肺组织MDA含量的比较T组、P组、TP组肺组织MDA含量显著低于C组(P < 0.05,表 1)。
| 表 1 4组动物肺组织MDA、 MPO、 SOD、 TNF-α含量 Table 1 Levels of MDA, MPO, SOD, and TNF-α in the lung tissues of the 4 groups (Mean±SD, n=10) |
T组、P组、TP组肺组织MPO含量显著低于C组(P < 0.05);TP组MPO含量显著低于T组和P组(P < 0.05,表 1)。
2.3 肺组织SOD活性的比较T组、P组、TP组肺组织SOD活性显著高于C组(P < 0.05);TP组SOD活性显著高于T组和P组(P < 0.05,表 1)。
2.4 肺组织TNF-α表达的比较4组肺组织TNF-α含量无统计学差异(P>0.05,表 1)。
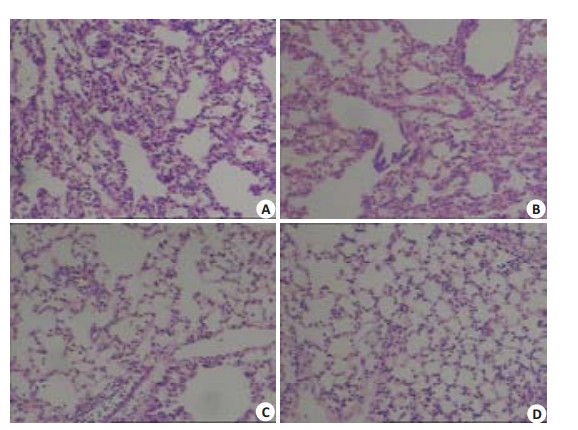
2.5 肺组织的病理变化C组的肺泡、间质及脉管周围组织水肿增厚,肺泡腔内可见红细胞,并有明显渗出,与他人研究相似[9],大鼠肺缺血再灌注模型建立成功。T组的肺泡、间质及脉管周围组织无明显水肿,肺泡腔可见少量红细胞及少量渗出。P组的肺泡、间质及脉管周围组织无明显水肿,肺泡腔可见少量红细胞及少量渗出。TP组的肺泡、间质及脉管周围组织无明显水肿,肺泡腔内少量渗出,见图 1。
|
图 1 肺组织的病理变化 Figure 1 Histopathological changes in the lung tissues in the 4 groups (HE staining, Original magnification: ×200). A: Control group. Obvious edema and exudation can be seen; B, C: Ligustrazine and perfluorocarbon groups, respectively, where a few red blood cells and exudation can be seen without edema; D: Combined treatment group, where a small amount of exudation was seen without edema. |
C组的病理积分大于T组、P组及TP组,T组及P组病理积分大于TP组,4组病理积分存在统计学差异(P < 0.05,表 2)。
| 表 2 4组动物肺组织病理积分 Table 2 Pathological scores of lung tissues in the 4 groups (Mean±SD, n=10) |
肺脏具有复杂的肺泡-毛细血管网状结构,极易受到缺血再灌注的损伤,移植肺的缺血再灌注损伤多发生在肺移植术后72 h之内,特征性的表现是非特异性的肺泡破坏、肺水肿和低氧血症。这种损伤和中性粒细胞的活化及聚集、各种炎症因子释放及氧化应激反应密切相关。大量的炎性因子失控性生成导致瀑布式的炎症连锁反应,从而释放氧自由基及蛋白酶等攻击肺泡-毛细血管网状结构,造成肺水肿、通气功能下降等。严重的肺缺血再灌注损伤还会导致早期移植肺功能不全[10]、增加供肺急性排斥反应的发生和长期的肺功能衰竭。
含双键的脂肪酸过氧化可生成MDA,它的产生与脂质过氧化相平行,MDA含量可代表脂质过氧化物的浓度,间接反映组织细胞氧化损伤程度。SOD可清除超氧阴离子自由基,保护细胞免受损伤,在机体的氧化与抗氧化平衡起着至关重要的作用,SOD活力的高低间接反应了机体清除自由基的能力。本实验研究表明,川芎嗪组、乳化氟碳及乳化氟碳结合川芎嗪组动物的MDA含量明显低于生理盐水动物组;川芎嗪组、乳化氟碳及乳化氟碳结合川芎嗪组动物SOD含量明显高于生理盐水组,乳化氟碳结合川芎嗪组动物SOD含量明显高于川芎嗪动物组及乳化氟碳动物组,说明川芎嗪及乳化氟碳可以产生抗氧化应激,使内源性清除氧自由基的能力增强,而且二者合用效应更强。
MPO是多型核粒细胞的一种标志性酶,其活性和组织中中性粒细胞的浸润程度成正比,是反映中性粒细胞浸润的可靠指标。彭雪梅等已经证实将乳化氟碳和川芎嗪联合应用进行肺内灌注可以有效地减少中性粒细胞浸润,抑制炎性细胞NF-κB的活化和细胞因子TNF-α与IFN-γ的表达,减轻肝肺综合征猪肝移植围手术期引起的肺损伤[11]。本实验研究表明,川芎嗪组、乳化氟碳组及乳化氟碳结合川芎嗪组动物的MPO含量明显低于生理盐水组,乳化氟碳结合川芎嗪组动物的MPO含量明显低于川芎嗪组及乳化氟碳组,说明川芎嗪及乳化氟碳可减少炎性细胞的激活及减少中性粒细胞在肺内聚集浸润,将两者联合应用在减少肺组织炎症浸润上能发挥更大作用。
TNF-α主要由激活的巨噬细胞、内皮细胞、中性粒细胞及B淋巴细胞分泌,被认为是引起肺损伤最重要和最早产生的细胞因子之一。有研究认为[24-25],TNF-α在损伤后12 h或24 h左右明显升高并达到高峰。本实验中肺缺血再灌注各组动物TNF-α含量无统计学差异。这是否由于肺损伤后引起TNF-α开始释放增高,但本研究缺血再灌注时间(≤8 h)较短,TNF-α含量还在上升期,乳化氟碳或者川芎嗪的保护作用尚未体现出来?这有待进一步研究。
本研究中肺组织的病理变化与实验检测指标结果有高度的一致性。T组、P组及TP组与C组相比,肺组织结构更清晰完整,肺泡、间质及脉管周围组织无明显水肿;同时TP组比T组、P组肺泡腔内有更少的红细胞及渗出,病理积分也是最低的。说明乳化氟碳及川芎嗪均可保护肺组织,减少肺缺血再灌注损伤,两者合用对肺组织保护作用更强。
近年来,有许多研究证明乳化氟碳及川芎嗪用于器官移植可显著减轻移植后器官缺血再灌注损伤,对缺血器官有保护作用[12, 23]。川芎嗪通过以下途径减轻移植后器官缺血再灌注损伤:(1)提高内源性清除氧自由基的能力,产生抗氧化应激[13];(2)调节内皮功能[14],其减轻肺毛细血管内皮损伤,降低肺血管通透性,抑制中性粒细胞在肺内聚集;(3)可显著降低外周血促炎细胞因子水平[15-16],如IL-8、TNF-α等,从而保护肺组织免遭致炎因子的损伤作用。乳化氟碳颗粒小、携氧高、气体交换迅速,是良好人工氧载体,其对缺血器官的保护作用主要表现在:(1)乳化氟碳摄取、释放氧速度极快,远快于血红蛋白,且颗粒微小,仅为血红蛋白的1/70~80,可进入毛细血管和部分发生阻塞的血管,迅速携氧到达红细胞所不能及的缺血组织,快速而又充分的向组织供氧[17];(2)乳化氟碳具有显著抗炎效应,可抑制中性粒细胞及巨噬细胞聚集,降低各种炎症因子产物,减轻组织的炎症破坏,减少氧自由基的释放,缓解细胞的过氧化反应[18];(3)乳化氟碳可抑制红细胞及血小板的聚集,改善微循环,有利于物质交换和代谢[19];(4)乳化氟碳不含血液有形成份,可使细胞毒性物质来源有所减少;(5)乳化氟碳可在缺血过程中维持组织内ATP水平[20-22]。
综上所述,乳化氟碳及川芎嗪可提高内源性清除氧自由基的能力,产生抗氧化应激,显著降低外周血促炎细胞因子水平,抑制中性粒细胞在肺内聚集,减轻组织的炎症破坏,对抗肺缺血再灌注的病理损伤。同时,本研究表明乳化氟碳静脉给药可以起到与肺灌洗、雾化吸入同样的肺保护作用,这为以后的临床应用研究打下了良好的基础。但鉴于再灌注损伤机制较复杂、乳化氟碳与川芎嗪的相互作用尚不明确,川芎嗪及乳化氟碳对肺组织的保护有待于更深入的研究。
| [1] |
Den Hengst WA, Gielis JF, Lin JY, et al. Lung ischemia-reperfusion injury: a molecular and clinical view on a complex pathophysiological process[J].
Am J Physiol Heart Circ Physiol,2010, 299 (5) : H1283-99.
DOI: 10.1152/ajpheart.00251.2010. ( 0) 0)
|
| [2] |
Draenert A, Marquardt K, Inci I, et al. Ischaemia-reperfusion injury in orthotopic mouse lung transplants -a scanning electron microscopy study[J].
Int J Exp Pathol,2011, 92 (1) : 18-25.
DOI: 10.1111/j.1365-2613.2010.00752.x. ( 0) 0)
|
| [3] |
Weyker PD, Webb CA, Kiamanesh D, et al. Lung ischemia reperfusion injury: a bench-to-bedside review[J].
Semin Cardiothorac Vasc Anesth,2013, 17 (1) : 28-43.
DOI: 10.1177/1089253212458329. ( 0) 0)
|
| [4] |
Ng CS, Wan S, Arifi AA, et al. Inflammatory response to pulmonary ischemia-reperfusion injury[J].
Surg Today,2006, 36 (3) : 205-14.
DOI: 10.1007/s00595-005-3124-2. ( 0) 0)
|
| [5] |
李经华, 韩丽芳, 颜亮, 等. 部分液体通气治疗家猪急性肺损伤的抗炎效应[J].
中国病理生理杂志,2006, 22 (6) : 1147-51.
( 0) 0)
|
| [6] |
彭雪梅, 谢娟华, 帅兵, 等. 联合雾化吸入氟碳及中药川芎嗪治疗急性肺损伤的血流动力学及组织病理的改变[J].
南方医科大学学报,2011, 31 (8) : 1382-6.
( 0) 0)
|
| [7] |
Eppinger MJ, Deeb GM, Bolling SF, et al. Mediators of ischemia-reperfusion injury of rat lung[J].
Am J Pathol,1997, 150 (5) : 1773-84.
( 0) 0)
|
| [8] |
杨世疆, 王家宁, 平伟, 等. 大鼠急性肺缺血再灌注损伤模型的建立与评估[J].
中国医药导刊,2013, 15 (5) : 858-9.
( 0) 0)
|
| [9] |
熊平, 蒋灵芝, 廖秀清. 黄芪甲苷保护大鼠肺缺血再灌注肺损伤的形态学研究[J].
南方医科大学学报,2010, 30 (8) : 1864-7.
( 0) 0)
|
| [10] |
Hertz MI, Mohacsi PJ, Boucek MM, et al. The registry of the International Society for Heart and Lung Transplantation: Past, present and future[J].
J Heart Lung Transplant,2002, 21 (9) : 945-9.
DOI: 10.1016/S1053-2498(02)00499-0. ( 0) 0)
|
| [11] |
彭雪梅, 席露, 李雅兰, 等. 乳化氟碳结合川芎嗪对肝肺综合征猪肝移植围手术期肺部炎症的影响及其机制研究[J].
中国病理生理杂志,2010, 26 (1) : 112-5.
( 0) 0)
|
| [12] |
范国华, 黄杰. 川芎嗪对幼兔肺缺血再灌注损伤的保护作用[J].
武汉大学学报:医学版,2010, 31 (5) : 616-8.
( 0) 0)
|
| [13] |
楼正家, 诸葛丽敏, 郑文龙, 等. 川芎嗪对心肺复苏后脑缺血-再灌注损伤的保护作用[J].
中国中西医结合急救杂志,2003, 10 (5) : 299-301.
( 0) 0)
|
| [14] |
毛宇飞, 王晓杨, 王万铁, 等. 肺缺血-再灌注损伤超微结构及川芎嗪对其影响[J].
中国全科医学,2007, 10 (16) : 1337-9.
( 0) 0)
|
| [15] |
路东明, 汪栋, 韩开宝. 川芎嗪对体外循环中炎性因子IL-8、 TNF-α的影响[J].
山东医药,2007, 47 (19) : 108-9.
( 0) 0)
|
| [16] |
Gao S, Chen ZW, Zheng H, et al. Ligustrazine attenuates acute myocardium injury after thermal trauma[J].
Burns,2007, 33 (3) : 321-7.
DOI: 10.1016/j.burns.2006.07.002. ( 0) 0)
|
| [17] |
Hosgood SA, Nicholson ML. The role of perfluorocarbon in organ preservation[J].
Transplantation,2010, 89 (10) : 1169-75.
DOI: 10.1097/TP.0b013e3181da6064. ( 0) 0)
|
| [18] |
Forgiarini LA, Forgiarini LF, Da Rosa DP, et al. Endobronchial perfluorocarbon administration decreases lung injury in an experimental model of ischemia and reperfusion[J].
J Surg Res,2013, 183 (2) : 835-40.
DOI: 10.1016/j.jss.2013.01.035. ( 0) 0)
|
| [19] |
Xu SF, Wang P, Wei K, et al. Cytoprotection of perfluorocarbon on PMVECs in vitro[J].
Inflammation,2013, 36 (2) : 512-20.
DOI: 10.1007/s10753-012-9572-0. ( 0) 0)
|
| [20] |
Ntinas A, Iliadis S, Achparaki AA, et al. The protective effect of oxygenated perfluorocarbons (PFCs) on intestinal ischemia reperfusion injury (I/R) in rabbits[J].
Vasc Endovascular Surg,2010, 44 (2) : 81-8.
DOI: 10.1177/1538574409344437. ( 0) 0)
|
| [21] |
Hindryckx P, Devisscher L, Laukens D, et al. Intrarectal administration of oxygenated perfluorodecalin promotes healing of murine colitis by targeting inflammatory hypoxia[J].
Lab Invest,2011, 91 (9) : 1266-76.
DOI: 10.1038/labinvest.2011.102. ( 0) 0)
|
| [22] |
Burkhardt W, Koehne P, Wissel H, et al. Intratracheal perfluorocarbons diminish LPS-induced increase in systemic TNF-alpha[J].
Am J Physiol Lung Cell Mol Physiol,2008, 294 (6) : L1043-8.
DOI: 10.1152/ajplung.00125.2007. ( 0) 0)
|
| [23] |
Isaka M, Sakuma I, Shiiya N, et al. Experimental study of the relationship between perfluoro-octyl bromide emulsion and norepinephrine release in reperfusion arrhythmia: isolated Guinea pig heart model[J].
Ann Thorac Cardiovasc Surg,2008, 14 (6) : 363-8.
( 0) 0)
|
| [24] |
吴智勇, 胡锐, 王志维, 等. 大鼠肺组织深低温缺血再灌注后AQP-5、 NF-κB、 TNF-α含量变化与肺损伤的关系[J].
武汉大学学报:医学版,2014, 35 (2) : 193-7.
( 0) 0)
|
| [25] |
项洁, 沈霞, 杨荣礼, 等. 大鼠脑缺血再灌注后TNF-α及ICAM-1的相关性分析[J].
徐州医学院学报,2005, 25 (2) : 110-4.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36