2. 重庆医科大学 2011级临床医学,重庆 400016 ;
3. 重庆三峡医药高等专科学校 免疫学与病原生物学教研室,重庆 404120
2. Grade 2011 of Clinical Medicine, Chongqing Medical University, Chongqing 400016, China ;
3. Department of Immunology and Pathgenic Biology, Chongqing Three Gorges Medical College, Chongqing 404120, China
近10余年来,地塞米松类药物已广泛应用于临床各科多种疾病的治疗,如自身免疫性疾病、过敏症、哮喘及皮肤科、眼科的疾病。目前,中国已成为世界上最大的地塞米松类药物市场[1]。临床常用的地塞米松制剂为易溶于水、易吸收的地塞米松磷酸钠(Dexamethasone sodium phosphate),其药用效果与地塞米松相同,多用于治疗和预防药物引起的过敏及病毒性感冒引起的发烧等病症,而且是抢救垂危病人不可缺少的急救药物[2]。临床上,地塞米松类药物在应用生理剂量治疗时无明显不良反应,长期或大剂量使用后可引起医源性库欣综合征,免疫抑制,加重癫痫持续状态,儿童生长抑制、青光眼、白内障等不良反应[3-4]。地塞米松类药物在应用过程中,其药物残液可经各种途径污染环境,特别是医院废水;也可从应用者体内经分泌液和尿液排出,污染更广泛的水环境[5]。目前,医院废水的处理主要采用物理、生物化学和消毒的方法,这些方法可清除废水中的病原体、放射性物质、重金属等,但尚未对激素类污染物进行有效处理。近年来,国内外多篇报道在水体中已发现地塞米松类药物的污染[6-8],但尚无水体污染地塞米松类药物后造成生物危害的报道。本文通过小鼠动物模型,观察含不同污染剂量地塞米松磷酸钠的饮用水对小鼠生长发育及其肠道菌群的影响,为评价水体地塞米松类药物污染造成的危害提供实验依据。
1 材料和方法 1.1 材料 1.1.1 实验动物3周龄无特定病原体(SPF级)雄性Balb/c小鼠20只,体质量18±1.2 g/只,购自重庆医科大学实验动物中心,SPF级动物房喂养,室内湿度为45%~65%,温度为22~25 ℃,光暗比为1:1。喂养中所用饲料、饮用水、垫料及鼠笼等均经过严格消毒灭菌。
1.1.2 主要试剂细菌基因组抽提试剂盒、2×Taq PCR Master Mix购自北京天根生物科技有限责任公司;SanPrep柱式DNA胶回收试剂盒、PCR引物、Tris、琼脂糖、EDTA·2H2O购自上海生工科技有限公司;DNA凝胶纯化试剂盒、DNA Marker、Goldview购自大连宝生物工程有限公司;30%丙烯酰胺预混液、去离子甲酰胺、硝酸银、TEMED、尿素、过硫酸铵购自北京鼎国有限公司;地塞米松磷酸钠标准品购自上海哈灵生物科技有限公司。试验中其余试剂均用分析纯售品自行配制。
1.2 方法 1.2.1 动物试验为评价水体地塞米松污染对小鼠的影响,将20只小鼠随机分成4组,每组5只,每组饲养于同1个鼠笼。经过2 d适应性饲养后,根据国内外水体中地塞米松污染剂量的报道[6-8],以及适应性饲养时每只小鼠每日饮水量,推算实验组每只小鼠从污染饮水中可能摄入的地塞米松磷酸钠含量,除正常饮水外,一次性灌喂含不同剂量地塞米松磷酸钠的饮用水。实验低剂量组(A组)灌喂含0.035 ng地塞米松磷酸钠的饮用水,中剂量组(B组)含0.225 ng、高剂量组(C组)含2.25 ng,于每日8~9 am灌喂0.2 mL,对照组同法灌喂同量不含地塞米松磷酸钠的饮用水。含地塞米松磷酸钠的饮用水均为当日配制。每日观察小鼠行为、皮毛、大便等的变化,连续35 d。
1.2.2 采集肠道标本第36天在乙醚麻醉下断颈处死小鼠,无菌条件下从小鼠回盲部上下各1 cm处切取肠段,纵向剖开,除去内容物,用无菌生理盐水反复清洗3次,置无菌EP管内-80 ℃保存。
1.2.3 细菌DNA提取取出冷冻的回盲部标本,室温下解冻,用无菌剪刀剪碎后放入无菌研钵中,加入500 μL灭菌生理盐水研磨,将研磨后的悬液移至无菌EP管中,添加无菌生理盐水至1000 μL,用细菌基因组DNA提取试剂盒按说明书提取细菌DNA。取1 μL提取的DNA用核酸浓度测定仪测量DNA含量,加无菌双蒸水稀释成100 ng/μL,-20 ℃保存。
1.2.4 原核生物16S rDNA V6区扩增以提取的细菌DNA为模板,采用含GC夹的原核生物16S rDNA V6区通用引物[9]进行扩增,引物序列为V6-GCF: 5'-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGG GCACGGGGGCACGGGGGGAACGCGAAGAAGA ACCTTAC-3';V6-GCR: 5'-CGGTGTGTACAAGACC C-3'。PCR反应体系: 2×rTaq Mix 12.5 μL,ddH2O 9.5 μL,V6-GCF、V6-GCR各1 μL,DNA模板1 μL,总体积25 μL。PCR扩增程序: 95 ℃ 10 min;30个循环(95 ℃ 30 s,56 ℃ 1 min,72 ℃ 1 min);72 ℃ 10 min。扩增产物2%琼脂糖凝胶电泳分析。
1.2.5 变性凝胶梯度电泳及图谱分析参照Liu [10]的方法,将扩增产物进行变性凝胶梯度电泳(Denaturing Gradient Gel Glectrophoresis, DGGE),通过预试验,略有改进。采用8%聚丙烯酰胺凝胶和40%-60%尿素为变性梯度,16S rDNA V6区PCR扩增产物和6 × loading Buffer上样各5 μL。电泳条件为: 1× TAE恒温60 ℃;恒压200 V,预电泳10 min;再恒压85 V,电泳时间13 h。电泳结束后,取出凝胶硝酸银染色,凝胶成像分析系统拍照。用Quantity One软件(Version 4.6.2,BIO-RAD Laboratory,America)对DGGE图谱的条带数目(丰富度,S)进行分析,将相关数据导入BIO-DAP软件[Parks,Canada(PHQ)and National Park,Canada]和Excel,计算香农指数(Shannon-Wiener diversity index, H’)和均匀度指数(Pielou index, E)。通过SPSS 17.0软件对各组小鼠肠道菌群结构进行主成分分析。
1.2.6 DGGE优势条带的扩增切取DGGE电泳凝胶上的优势条带,分别置无菌EP管中,用无菌去离子水冲洗2次,捣碎并浸泡于50 μL无菌去离子水中,4 ℃过夜,使凝胶内的DNA完全析出。2000 r/min离心1 min,取上清液2 μL为模板,用原核生物16S rDNA V6区不含GC夹通用引物进行扩增,引物序列为V6-R: CGGTGTGTACAAGACCC,V6-F:AACGCGAAGAACCTTAC。PCR反应体系同前,扩增程序: 95 ℃ 10 min,30个循环· 239 · J South Med Univ, 2016, 36(2): 238-243 http://www.j-smu.com(95 ℃ 30 s,54 ℃ 1 min,72 ℃ 1 min),72 ℃ 10 min [11]。
1.2.7 克隆测序及其数据处理扩增后用DNA回收试剂盒回收并纯化,送上海美吉生物科技有限公司克隆测序。用TM 5.0软件对全部测序结果进行操作分类单元(Operational taxonomic units, OTU)划分[12-13]。并将测得的DNA序列在NCBI上Genbank数据库进行BLAST比对,以16S rDNA基因序列相似性大于或等于97%视为同一菌属[14]。将全部已知序列按属进行细菌分类。
1.2.8 统计学分析将数据用SPSS 17.0软件进行统计学分析。不同组间比较采用单因素方差分析,分析后的两两比较采用Tukey检验。以P < 0.05为差异有统计学意义。
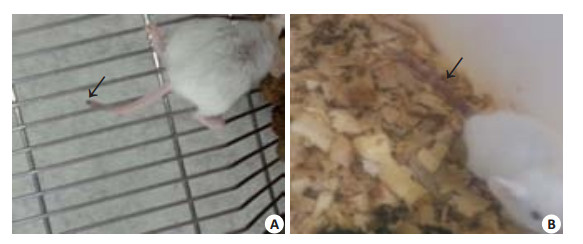
2 结果 2.1 对小鼠生长发育的影响各组小鼠饲喂35 d后均存活,各从灌喂第6天开始, 实验组小鼠出现皮毛凌乱,斗殴打架、咬断尾部等现象,其中有12只小鼠尾部被咬伤或咬断(图 1),而对照组无此现象。各组小鼠大便无异常。
|
图 1 小鼠尾部的改变 Figure 1 Changes of the mouse' tails following exposed to dexamethasone in drinking water. A: The tail was bitten off; B: Deformed tail due to repeated infection after being bitten. |
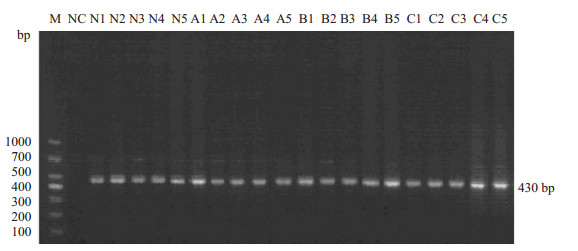
从回盲部肠段提取的细菌基因组DNA经2%琼脂糖凝胶电泳显示(图 2),各实验组标本可见长度约430 bp条带,对照组无此条带,表明细菌DNA得到特异性扩增。经核酸浓度测定仪检测,扩增的核酸浓度均大于800 ng/μL,可用作模板进行16S rDNA V6区PCR扩增。
|
图 2 细菌基因组DNA PCR产物电泳图 Figure 2 Electrophoretogram of DNA PCR products of the bacterial genome. M: DNA Marker; NC: Negative control; A: Low dose group; B: Medium dose group; C: High dose group. |
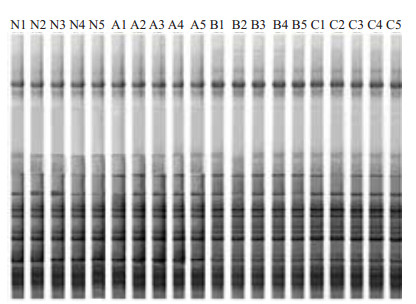
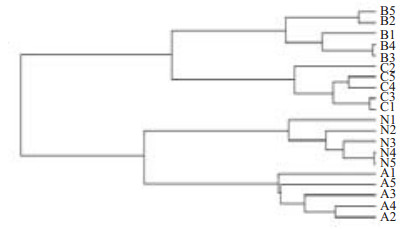
小鼠回盲部16S rDNA V6区DGGE图谱见图 3,用Quantity one软件分析各组之间图谱的相似性,通过UPGAM法计算并绘制各组之间相似性树状图(图 4),再根据该树状图分析各组间菌群结构的相似程度。根据相似性系数,将相似性较高的标本归为1组。本实验结果可分为2组。Ⅰ组包含了B组和C组所有的标本,Ⅱ组包含了N组和A组所有的标本,各实验组中小鼠肠道菌群结构的相似性均在0.90以上,Ⅰ组中B组与C组相似性为0.88;Ⅱ组中N组与A组的相似性为0.86。表明各组小鼠回盲部具有较稳定的菌群结构,低剂量实验组与对照组菌群结构差异不大,而中、高剂量组与对照组菌群结构差异较大。
|
图 3 各组肠道菌群16srDNA的DGGE图谱 Figure 3 DGGE graph of 16srDNA of the intestinal flora in each group of mice. |
|
图 4 各组小鼠肠道菌群系统树图 Figure 4 Dendrogram of the intestinal flora in each group of mice. |
对DGGE图谱进行主成分分析(Principal component analysis, PCA),根据每组小鼠第一、第二主成分的分值绘制PCA图(图 5)。X坐标轴表示第一主成分PC1(56.85%),Y轴表示第二主成分PC2(13.71%),括号里的百分比代表主成分的贡献率。各组的数据点均集中分布于不同区域,表明各组的优势菌群均存在一定差异。
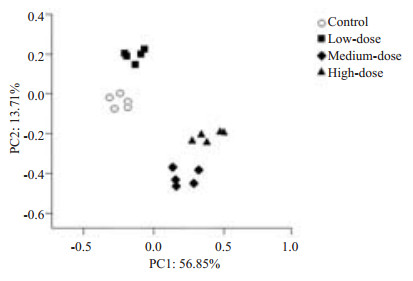
|
图 5 肠道菌群DGGE图谱的PCA图 Figure 5 PCA gram of DGGE graph of the intestinal flora. |
在DGGE图谱中(图 3),每一泳道即为1只小鼠回盲部的16S rDNA V6区图谱,每一条带即为1种细菌的16S rDNA V6区,每一泳道中的条带数量可反映小鼠回盲部菌群种数,条带数目越多,说明该样本细菌种类越多;反之则越少。泳道中条带粗细不一致,则对应的光密度不同,表明此条带所含的DNA量不同[15]。其中,DNA含量多的条带为优势条带,代表了菌群中的优势细菌;相同位置的条带为共有条带,表明含有共同的细菌种类,差异条带表明含有特有的细菌种类。从图谱中可见,对照组和实验组均有大量相同位置的条带和少量不同位置的条带。
2.3.4 菌群多样性分析丰富度是反映菌群多样性的指标之一,条带数越多,表明菌群丰富度越大、种类越多;香农指数反映了菌群的细菌种类与数量的变化;均匀度指数显示了优势菌种类及其相对含量[16]。从表 1可见,A组与对照组相比菌群丰富度与香农指数明显增加(P < 0.05),B组和C组的丰富度与香农指数比对照组显著增加(P < 0.01)。各实验组与对照组均匀度指数无明显差异(P>0.05)。表明实验组与对照组细菌的种类和数量均有差异,但优势菌种类与菌群相对含量相似。
| 表 1 DGGE图谱菌群多样性分析 Table 1 Diversity analysis of flora based on DGGE graph (n=5, Mean±SD) |
DGGE图谱中的优势条带扩增后克隆测序,用Blast工具与GenBank数据库中已有序列进行比对,发现17种菌属,其中共有菌属15种、差异菌属2种。对照组含有乳杆菌属的细菌,而中、高剂量实验组乳杆菌属的细菌消失,却出现志贺菌属的细菌(表 2)。
| 表 2 优势条带序列比对结果 Table 2 Sequence alignment results of the dominant bands |
各组小鼠菌群构成比(图 6)表明本实验组小鼠回盲部定植着以毛螺旋菌属、布劳蒂亚菌属、螺杆菌属和黏液螺旋菌属为优势菌的固有菌群,其中,实验A组与对照组均以毛螺旋菌属所占比例最多,分别为22.6%和28%,其次为布劳蒂亚菌属、螺杆菌属和黏液螺旋菌属;而实验组B组、C组则以黏液螺旋菌属所占比例最多,分别为32.7%和34.1%,其次为毛螺旋菌属、布劳蒂亚菌属和螺杆菌属。对照组中定植的乳杆菌占1.2%,而中、高剂量组出现的志贺菌属细菌分别占0.5%和0.7%。此结果表明小鼠饮用含不同剂量地塞米松磷酸钠的水后,回盲部定植的优势菌种类和比例发生了一定的改变。
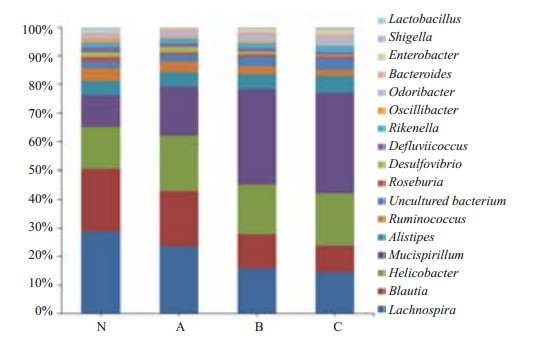
|
图 6 各组小鼠肠道菌群构成比 Figure 6 Proportion of the intestinal flora in each group of mice. N: Negative control; A: Low dose group; B: Medium dose group; C: High dose group. |
地塞米松是长效的糖皮质类激素,性质较稳定,可通过多种途径进入水体。近年来,国内外多篇报道表明在养猪场、医院、工厂的废水中均存在糖皮质类激素,其中,废水中地塞米松磷酸钠的污染量大多集中于7~450 ng/L之间[4-6]。适应性喂养观察到每只小鼠日饮水量约为5 mL,因此,本研究每日一次性灌喂含0.035、0.225、2.25 ng地塞米松磷酸钠的饮用水模拟低、中、高剂量地塞米松污染的水源水,通过Balb/c小鼠来探讨天然水体中地塞米松污染对小鼠生长发育及其肠道菌群的影响。
Balb/c小鼠性情温顺,胆小怕惊,一般很少相互殴打[17]。本实验中,给小鼠灌喂含不同污染剂量地塞米松磷酸钠饮用水后,从第6天开始,实验组小鼠均出现皮毛凌乱、咬尾、斗殴等性情改变的现象,各实验组中共有12只小鼠尾部被咬伤或咬断,尾部多次咬伤后反复感染而引起不规则组织增生,尾部变形,而对照组小鼠无此现象。此结果表明饮用含不同剂量地塞米松磷酸钠的饮水可使小鼠的性情从温顺变为烦懆,可能影响了小鼠神经系统的发育,与临床上长期或大剂量使用地塞米松后加重癫痫持续状态相符[18]。
从微生态的角度,人和动物的正常菌群分为以高数量(>1%)定植于特定部位的固有菌群、以低数量( < 1%)定植于特定部位的增补菌群和短暂停留的暂时菌群。本实验旨在探讨饮水地塞米松污染对小鼠肠道菌群的影响,故取菌群相对稳定的回盲部,并洗尽肠内容物,有利于分析定植于肠道的固有菌群[19]。
DGGE图谱分析表明各组小鼠回盲部具有较稳定的菌群结构,含不同剂量地塞米松磷酸钠的饮用水对小鼠回盲部细菌的种类和数量均有一定的影响,使优势菌在菌群中所占的比例发生一定的改变,在一定程度上增加菌群的多样性。其中,地塞米松磷酸钠低剂量对菌群结构影响较小,中、高剂量对菌群结构影响较大。饮水中地塞米松污染引起肠道菌群变化的原因可能是肠道菌群中有的细菌能以地塞米松为碳源和能源进行代谢,从而促进其生长[20],使菌群结构和分布发生改变。将DGGE图谱中的优势条带扩增后测序,与GenBank数据库中已有的细菌序列进行比对,发现17种菌属,其中共有菌属15种、差异菌属2种。对照组含有乳杆菌属的细菌,而实验中、高剂量组乳杆菌属的细菌消失,却出现志贺菌属的细菌。乳杆菌属的细菌是肠道菌群的主要成员,现已广泛作为益生菌,应用于保健食品中,而志贺菌属的细菌多为肠道致病菌。
以上结果表明,饮水中地塞米松污染,无论是低剂量还是高剂量对小鼠神经系统均有明显的影响,并可使小鼠肠道菌群的结构发生改变,抑制肠道益生菌的定植,有利于肠道致病菌的入侵。因此,天然水体中地塞米松污染对人体健康可能造成潜在的危害[21]。
| [1] |
Rathod SS, Motghare VM, Deshmukh VS, et al. Prescribing practices of topical corticosteroids in the outpatient dermatology department of a rural tertiary care teaching hospital[J].
Indian J Dermatol,2013, 58 (5) : 342-5.
DOI: 10.4103/0019-5154.117293. ( 0) 0)
|
| [2] |
Zhu LL, Yang ZB, Yang Q, et al. Degradation of dexamethasone by acclimated strain of Pseudomonas Alcaligenes[J].
Int J Clin Exp Med,2015, 8 (7) : 10971-8.
( 0) 0)
|
| [3] |
Thachil AJ, Shaw DP, Nagaraja KV. Effects of dexamethasone immunosuppression on Turkey clostridial dermatitis[J].
Avian Dis,2014, 58 (3) : 433-6.
DOI: 10.1637/10819-031314-Reg.1. ( 0) 0)
|
| [4] |
Zhao SF, Chai MZ, Wu M, et al. Effect of vitamin B-12 on cleft palate induced by 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin and dexamethasone in mice[J].
J Zhejiang Univ Sci B,2014, 15 (3) : 289-94.
DOI: 10.1631/jzus.B1300083. ( 0) 0)
|
| [5] |
Liu S, Ying GG, Zhou LJ, et al. Steroids in a typical swine farm and their release into the environment[J].
Water Res,2012, 46 (12) : 3754-68.
DOI: 10.1016/j.watres.2012.04.006. ( 0) 0)
|
| [6] |
Vander Linden SC, Heringa MB, Man HY, et al. Detection of multiple hormonal activities in waste water effluents and surface water, using a panel of steroid receptor CALUX bioassays[J].
Environ Sci Technol,2008, 42 (15) : 5814-20.
DOI: 10.1021/es702897y. ( 0) 0)
|
| [7] |
Schriks M, Van Leerdam JA, Van Der Linden SC, et al. HighResolution mass spectrometric identification and quantification of glucocorticoid compounds in various wastewaters in the Netherlands[J].
Environ Sci Technol,2010, 44 (12) : 4766-74.
DOI: 10.1021/es100013x. ( 0) 0)
|
| [8] |
石中全, 周裕珍, 杨致邦, 等. 废水中地塞米松污染的探讨[J].
中国医药指南,2012, 10 (9) : 319-21.
( 0) 0)
|
| [9] |
Huws SA, Edwards JE, Kim EJ, et al. Specificity and sensitivity of eubacterial primers utilized for molecular profiling of bacteria within complex microbial ecosystems[J].
J Microbiol Methods,2007, 70 (3) : 565-9.
DOI: 10.1016/j.mimet.2007.06.013. ( 0) 0)
|
| [10] |
Liu D, Du LZ, Yu JL, et al. 16S rDNA PCR-DGGE and sequencing in the diagnosis of neonatal late-onset septicemia[J].
Mol Med Rep,2015, 12 (4, B) : 6346-52.
( 0) 0)
|
| [11] |
田志颖, 杨致邦, 黄微微, 等. 幽门螺杆菌感染对小鼠食道下端菌群的影响[J].
南方医科大学学报,2014, 34 (9) : 1241-7.
( 0) 0)
|
| [12] |
Wei L, Yu JL, Qing A, et al. Increased constituent ratios of klebsiella sp., acinetobacter sp., and streptococcus sp. and a decrease in microflora diversity May be indicators of VentilatorAssociated pneumonia: a prospective study in the respiatory tracts of neonates[J].
PLoS One,2014, 9 (2) : e87504.
DOI: 10.1371/journal.pone.0087504. ( 0) 0)
|
| [13] |
Li HD, Song C, Liu D, et al. Molecular analysis of biofilms on the surface of neonatal endotracheal tubes based on 16S rRNA PCRDGGE and species-specific PCR[J].
Int J Clin Exp Med,2015, 8 (7) : 11075-84.
( 0) 0)
|
| [14] |
Wei W, Lee IM, Davis RE, et al. Automated RFLP pattern comparison and similarity coefficient calculation for rapid delineation of new and distinct phytoplasma 16Sr subgroup lineages[J].
Int J Syst Evol Microbiol,2008, 58 (10) : 2368-77.
DOI: 10.1099/ijs.0.65868-0. ( 0) 0)
|
| [15] |
乔健敏, 王丽凤, 郑艺, 等. 哈尔滨城市和乡村青年居民肠道菌群多样性研究[J].
微生物学通报,2014, 41 (12) : 2488-500.
( 0) 0)
|
| [16] |
苏运芳, 李义, 齐雪峰, 等. 溶葡萄球菌素对小鼠肠道菌群结构的影响[J].
西北农林科技大学学报:自然科学版,2012, 40 (10) : 1-8.
( 0) 0)
|
| [17] |
张洪, 鲍波. 浅谈国内BALB/c小鼠及KM小鼠的基本生物学特性[J].
中国实用医药,2010, 5 (3) : 252-4.
( 0) 0)
|
| [18] |
Duffy BA, Chun KP, Ma D, et al. Dexamethasone exacerbates cerebral edema and brain injury following lithium-pilocarpine induced status epilepticus[J].
Neurobiol Dis,2014, 63 (100) : 229-36.
( 0) 0)
|
| [19] |
Thompson JS, Quigley EM, Adrian TE. Qualitative changes in enteric flora and short chain fatty acids after intestinal resection[J].
Gastroenterology,1997, 112 (4, S) : A411.
( 0) 0)
|
| [20] |
Yi W, Zhibang Y, Lili Z, et al. Isolation and identification of dexamethasone Sodium phosphate degrading Pseudomonas alcaligenes[J].
J Basic Microbiol,2014, 55 (2) : 262-8.
( 0) 0)
|
| [21] |
Lalone CA, Villeneuve DL, Olmstead AW, et al. Effects of a glucocorticoid receptor agonist, dexamethasone, on fathead minnow reproduction, growth, and development[J].
Environ Toxicol Chem,2012, 31 (3) : 611-22.
DOI: 10.1002/etc.v31.3. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
