2. 广州市番禺区中心医院呼吸内科,广东 广州 511486
2. Department of Respiratory Medicine, Panyu District Central Hospital, Guangzhou 511486, China
慢性阻塞性肺疾病(COPD)是一种以持续性气流受限为特征的慢性呼吸系统疾病[1],由于受到动态肺过度充气(DPH)和内源性呼气末正压(PEEPi)的影响,膈肌长期处于不利的机械力学位置,容易出现疲劳[2]。支气管舒张剂作为治疗COPD的一线用药,可以明显减轻患者静息和运动过程中呼吸困难的症状[3],膈肌疲劳得到缓解可能是其重要的作用机制,但目前尚缺乏深人的呼吸生理机制研究。等二氧化碳高通气(maximal isocapnic ventilation, MIV)是一种评价通气储备功能的测试方法,要求患者尽可能深快地呼吸,并通过气体调节使二氧化碳在测试过程中保持正常水平,目的是排除二氧化碳对中枢驱动的干扰。研究显示,MIV由于直接增加了膈肌的负荷,短时间内可以使膈肌的收缩能力明显下降[4],因此可用来模拟病理状态下的膈肌疲劳。本研究通过观察COPD患者在MIV过程中膈肌功能和中枢驱动的变化,探讨短效吸人支气管舒张剂对高通气过程中各项呼吸生理参数的影响,为预防病理状态下膈肌疲劳和支气管舒张剂的合理应用提供理论依据。
1 资料和方法 1.1 研究对象及分组选择南方医科大学珠江医院呼吸内科、广州市番禺区中心医院呼吸内科自2014年5月~2015年11月47例稳定期COPD门诊患者,均为男性。通过病史、体格检查、肺功能检查、X线检查等明确诊断,符合“全球慢性阻塞性肺疾病防治倡议”(GOLD)的COPD诊断标准[1]。具体入选标准:(1)年龄40~75岁;(2)吸入支气管舒张剂后,FEV1/FVC < 70%且30% < FEV1% pre < 80%预计值;(3)最近2个月内未出现急性加重。排除标准:(1)4周内有口服糖皮质激素史;(2)合并支气管哮喘、支气管扩张、肺癌、冠心病、心律失常等心肺疾病;(3)合并Ⅰ型或Ⅱ型呼吸衰竭;(4)合并神经肌肉疾病,如重症肌无力、帕金森病等。所有患者在实验前48 h停用各类支气管舒张剂。患者随机分为4组:安慰剂组(n=12)、沙丁胺醇组(n=13)、异丙托溴铵组(n=10)和联合组(沙丁胺醇+异丙托溴铵,n=12)。
1.2 药物、检测方法及仪器 1.2.1 药物安慰剂(葛兰素威康制药有限公司,中国重庆);沙丁胺醇(万托林,葛兰素威康产品,法国);异丙托溴铵(爱全乐,勃林格殷格翰药业有限公司,德国)。
1.2.2 MIV方法参照Mulvey的装置[5]改良如图 1,患者含咬嘴(夹鼻)用尽可能深的幅度和快的频率做最大通气运动3 min,用CO2检测仪来同步检测呼出气CO2浓度,同时调节吸入混合二氧化碳气体(21% O2+79% CO2)的量,保持高通气过程中呼出末二氧化碳浓度(PETCO2)在35~45 mmHg。
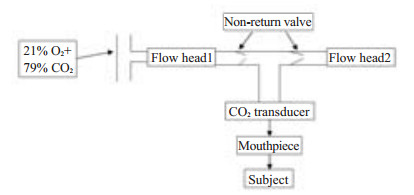
|
图 1 等二氧化碳高通气装置 Figure 1 Schematic illustration the maximal isocapnic ventilation device. |
采用层流型流量计(MLT 300 L,ADInstruments公司,澳大利亚)和差分压力传感放大器(ML141,ADInstruments公司,澳大利亚)检测呼吸流量。分钟通气量(VE)通过流量对时间的积分求得。
1.2.4 跨膈压(Pdi)的测定[6-7]经鼻腔将食道囊管、胃囊管分别放置于食道中下段1/3附近和胃腔中,并将食道囊管、胃囊管的开口连接压力感受器(P-300B型,金三江传感技术有限公司,北京)对食道内压(Pes)、胃内压(Pga)进行动态监测,压力信号通过生物信号放大器(3808型,英辉医疗器械科技有限公司,广州)进行放大处理。跨膈压(Pdi)为胃内压与食道压之差,即Pdi=Pga-Pes。
1.2.5 食道电极的定位和膈肌肌电(EMGdi)的采集及计算食道电极管有5对记录电极,经鼻腔放置入食道后,根据肌电图的幅度进行定位,当第1和第5个膈肌肌电导联信号相对最大,而第3个膈肌导联信号相对最小时,固定电极。膈肌肌电信号的滤波带宽设为10~1 kHz,并通过生物放大器进行放大处理。用膈肌肌电电压的均方根(RMS)来反映呼吸中枢驱动,滤除20 Hz以下的因食道蠕动等因素造成的基线摆动干扰波,由计算机软件LabChart7.5自动连续计算持续100 ms肌电电压的均方根(RMS),为避免心电活动对膈肌肌电的影响,应选择心电图两QRS波之间的电信号,计算每一次呼吸的RMS最大值,取连续5次以上吸气期的平均峰值RMS。
1.2.6 数据采集和处理流量和压力的采集频率为200 Hz,膈肌肌电的采集频率为1 kHz。所有生理信号放大后经Powerlab16导生理记录仪(ML796,ADInstruments公司,澳大利亚)通过LabChart7.5软件记录和数据处理。
1.2.7 患者呼吸困难的变化评分采用Borg scale评分,分为0~10分,分数越高,提示呼吸困难程度越高。
1.3 MIV过程及数据同步记录实验前1 d患者完成常规肺功能检查,并配合练习MIV。实验当天教会患者吞咽电极管动作,让患者熟悉Borg评分。患者坐位,常规表面粘膜麻醉后,放置食道和胃囊管、多导食道电极管并定位。患者在基础状态下含咬嘴(夹鼻)平静呼吸1 min后,进行3 min MIV,同步记录压力、流量、膈肌肌电的数据。MIV过程分为6个时间段,即0~30 s,30~60 s,60~90 s,90~120 s,120~150 s,150~180 s,计算每个时间段Pdi、VE、RMS、VE/RMS的平均值。VE/RMS代表通气-中枢偶联,即单位中枢驱动所产生的通气量,反映呼吸中枢的有效性。在MIV结束后即刻询问患者的Borg scale评分。患者充分休息30 min后,按组别分别在吸入安慰剂400 μg,或吸入沙丁胺醇400 μg,或吸入异丙托溴胺80 μg,或联合吸入沙丁胺醇400 μg和异丙托溴胺80 μg,30 min后再进行3 min MIV并重复测量上述指标。拔除食道电极,实验结束。
1.4 统计学分析采用SPSS 20.0软件包进行统计学分析。计量资料用均数±标准差的形式来表示,组内各项指标用药前后的比较采用配对t检验,组内各项指标在MIV过程不同时间段的比较采用重复测量数据的方差分析,组间各项指标的比较采用单因素方差分析,两两比较用LSD法;呼吸困难评分与测量指标的相关性采用Person相关分析;P < 0.05作为显著性统计学差异。
2 结果 2.1 4组COPD患者基本资料和平静呼吸状态下各项测量指标4组患者年龄、身高、肺功能指标(FEV1、FEV1% pre、FVC)相比较无统计学差异(P均>0.05),平静呼吸状态下Pdi、VE、RMS、VE/RMS无显著差异(P均>0.05,表 1)
| 表 1 COPD患者基本资料及平静呼吸状态下各项测量指标 Table 1 Basic demographic and respiratory parameters during eupnea of the COPD patients (Mean±SD, n=47) |
MIV过程中,在基础状态下从0~30 s,30~60 s,60~90 s,90~120 s,120~150 s,到150~180 s 6个时间段,4组患者RMS均呈线性增加(P < 0.05),Pdi、VE、VE/RMS均呈线性下降(P均 < 0.05)。4组同一时间段各项测量指标无统计学差异(P均>0.05,表 2)。
| 表 2 MIV过程中COPD患者基础状态下各项测量指标的变化 Table 2 Indices measured during maximal isocapnic ventilation (MIV) in the COPD patients before inhalation of short-acting bronchodilators (Mean±SD, n=47) |
MIV过程中,吸入药物后4组各项测量指标在不同时间段(0~180 s)的变化趋势均没有明显改变。安慰剂组各项指标在用药前后比较无显著统计学差异(P均> 0.05),沙丁胺醇组、异丙托溴铵组和联合组各项指标在用药前后比较均有显著统计学差异(P < 0.05)。与安慰剂组比较,沙丁胺醇组和联合组在吸入支气管舒张剂后同一时间段的Pdi、VE均增加(P均 < 0.05),RMS降低(P < 0.05),VE/RMS增高(P < 0.05)。与安慰剂组比较,异丙托溴铵组同一时间点各个指标均有改善,但无统计学差异(P>0.05)。沙丁胺醇组和异丙托溴铵组同一时间段的各项指标比较无显著差异(P均 < 0.05)。与吸入单药比较,联合组同一时间段的VE/RMS显著增高(P均 < 0.05),其他各项指标无统计学差异(P均>0.05)。结果见表 3。
| 表 3 MIV过程中COPD患者吸入短效支气管舒张剂后各项测量指标的变化 Table 3 Indices measured during maximal isocapnic ventilation in the COPD patients after inhalation of short-acting bronchodilators (Mean±SD, n=47) |
与安慰剂组比较,沙丁胺醇组、异丙托溴铵组和联合组吸入支气管舒张剂后Borg评分均显著降低(3.85±0.91,4.00±0.89和3.26±0.99 vs 5.36±0.85,P均 < 0.05);与沙丁胺醇组、异丙托溴铵组比较,联合吸入组Borg评分无统计学差异(P=0.147,P=0.173)。
2.5 呼吸困难评分与VE、RMS、VE/RMS的相关性分析采用Person相关分析,吸入支气管舒张剂后,△Borg与△Pdi、△VE、△RMS、△VE/RMS均有显著相关性(r=-0.546,P=0.024;r=-0.507,P=0.017;r=0.422,P=0.011;r=-0.650,P=0.002)。
3 讨论膈肌疲劳是COPD呼吸衰竭发生发展的重要病理生理机制之一,研究COPD患者膈肌疲劳状态下的呼吸生理改变具有重要意义。本研究采取MIV的方式,一方面通过高通气模拟COPD病理状态下的膈肌疲劳,另一方面通过保持CO2等水平排除CO2对呼吸中枢的影响,保证了研究结果的准确性。
本研究表明,COPD患者基础状态下进行高通气的过程中,反映膈肌收缩力量的Pdi呈逐渐下降趋势,提示膈肌疲劳程度逐渐加重,膈肌收缩力逐渐下降。与此同时,VE也呈线性下降趋势,可能与膈肌疲劳加重动态肺过度充气,呼气末肺容量增加和潮气量减少有关。而在我们早期进行的CO2重复呼吸测试中[8]VE呈线性增加,则主要与CO2刺激通气增加有关。本研究发现,吸入支气管舒张剂后,Pdi和VE均出现显著增加,提示支气管舒张剂对膈肌功能和肺通气具有改善作用。
本研究通过多导食道电极记录膈肌电信号来评价中枢驱动[9-10],观察了吸入短效支气管舒张剂对COPD患者在高通气过程中枢驱动的影响。由于COPD的基础病变导致肺顺应性下降和气道阻力的增高,机体需要更大的吸气压力才能产生特定的通气量。COPD患者在膈肌疲劳加重状态下,例如急性加重期时,需要更强的呼吸中枢驱动来维持特定的吸气压力,从而保证特定的潮气量来满足机体的通气需求。然而,中枢驱动的过度增加可能会进一步加重呼吸肌肉的疲劳和损伤,所以肌肉通过反馈抑制中枢,以降低中枢驱动的输出,例如COPD患者的中枢驱动在踏车运动过程会达到一个平台[11]。本研究结果显示,在MIV的过程中,RMS呈持续上升趋势,这与通气需求和膈肌疲劳均有关,但并没有出现类似踏车运动的平台期,这可能与最大通气时间较短(3 min),呼吸中枢未受到反馈性抑制有关。吸入支气管舒张剂后,RMS在MIV过程的变化趋势没有明显改变,但与安慰剂组对比,数值出现了显著下降,可能的解释是:支气管舒张剂减少了COPD患者动态内源性呼气末正压(iPEEP),降低了气道阻力和吸气做功,吸气压力下降[12-13],反映了膈肌疲劳获得改善。另外,有关动物和人体的实验显示传出到膈肌的驱动会受控于调节膈肌本身的力学特性,当膈肌处于较好的长度-张力关系,膈肌电活动也会减弱。可以解释本研究所得出结果:吸入支气管舒张剂可以显著降低COPD患者在通气过程中的呼吸中枢驱动。
在膈肌疲劳状态下,COPD患者更容易出现异常的通气-中枢偶联,通常表现为通气需求和呼吸中枢驱动增高,但实际通气量却不变甚至下降。在本研究中,VE随着高通气时间而逐渐下降,但对应的RMS却逐渐上升,因此通气-中枢偶联出现了下降。同样地,吸入短效支气管舒张剂后并不能明显改变VE/RMS在MIV过程中的下降趋势,但对比吸入安慰剂,同一时间段的VE/ RMS显著增加(P < 0.05),提示通气-中枢偶联关系得到改善。呼吸困难是影响COPD病人日常活动和工作的最重要因素,而支气管舒张剂可以明显减轻患者呼吸困难的症状。有研究[14]表明,吸入支气管舒张剂对COPD患者通气-中枢偶联的改善可能是患者呼吸困难缓解的重要机制。本研究也发现,吸入支气管舒张剂后进行MIV过程中,患者呼吸困难的减轻与Pdi、VE、VE/ RMS、RMS的变化均有显著的相关性,其中与VE/RMS相关性最高。因此,我们推测,吸入支气管舒张剂可改善患者在膈肌疲劳状态下的通气-中枢偶联比例失调,吸气需求和通气输出不平衡得以纠正,呼吸效能增加,呼吸困难症状缓解。
沙丁胺醇(β2激动剂)和异丙托溴铵(M受体阻滞剂)是COPD治疗的重要药物。本研究结果显示,尽管沙丁胺醇组和异丙托溴铵组同一时间段的各项指标比较无统计学差异,但从绝对值来看,沙丁胺醇还是要优于异丙托溴铵,这可能跟沙丁胺醇达药效高峰更快有关。由于沙丁胺醇和异丙托溴铵是两种作用机理不同的药物,临床更关注的是联合药物的协同作用。很多研究已经证实联合这两种作用机制不同的药物比单独应用更有治疗的优势[15-16]。而本研究显示,联合沙丁胺醇和异丙托溴铵对各项测量指标的改善程度(绝对值)要优于单药,但尚无统计学差异,可能与样本量偏小、药物作用随时间减弱等因素有关。因此,本研究结果仍有待更大规模的临床研究加以进一步证实。
综上所述,吸入短效支气管舒张剂可以改善COPD患者MIV过程的膈肌疲劳状态,增加肺通气量,降低呼吸中枢驱动,提高通气-中枢偶联,从而缓解呼吸困难症状。联合沙丁胺醇、异丙托溴铵这两种短效支气管舒张剂疗效优于单独用药。
| [1] |
Vestbo J, Hurd SS, Agusti AG, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease Gold executive summary[J].
Am J Respir Crit Care Med,2013, 187 (4) : 347-65.
DOI: 10.1164/rccm.201204-0596PP. ( 0) 0)
|
| [2] |
Mador MJ, Kufel TJ, Pineda LA, et al. Diaphragmatic fatigue and high-intensity exercise in patients with chronic obstructive pulmonary disease[J].
Am J Respir Crit Care Med,2000, 161 (1) : 118-23.
DOI: 10.1164/ajrccm.161.1.9903010. ( 0) 0)
|
| [3] |
Nardini S, Camiciottoli G, Locicero SA, et al. COPD: maximization of bronchodilation[J].
Multidiscip Respir Med,2014, 9 (1) : 50.
DOI: 10.1186/2049-6958-9-50. ( 0) 0)
|
| [4] |
Janssens L, Brumagne S, Mcconnell AK, et al. The assessment of inspiratory muscle fatigue in healthy individuals:a systematic review[J].
Respir Med,2013, 107 (3) : 331-46.
DOI: 10.1016/j.rmed.2012.11.019. ( 0) 0)
|
| [5] |
Mulvey DA, Koulouris NG, Elliott MW, et al. Inspiratory muscle relaxation rate after voluntary maximal isocapnic ventilation in humans[J].
J Appl Physiol,1991, 70 (5) : 2173-80.
( 0) 0)
|
| [6] |
陈新, 许睿, 陈荣昌, 等. 不同干预措施对犬急性肺损伤早期呼吸应答和呼吸做功的影响[J].
南方医科大学学报,2007, 27 (3) : 340-4.
( 0) 0)
|
| [7] |
陈新, 陈荣昌, 岑燕遗, 等. 应用食道-胃囊管测压系统评估犬急性肺损伤早期生理学反应[J].
南方医科大学学报,2007, 27 (8) : 1271-3.
( 0) 0)
|
| [8] |
陈新, 李寅环, 许睿, 等. 呼气末二氧化碳分压水平对慢性阻塞性肺疾病患者中枢驱动和呼吸应答的影响[J].
中华神经医学杂志,2008, 7 (8) : 841-5.
( 0) 0)
|
| [9] |
Jolley CJ, Luo YM, Steier J, et al. Neural respiratory drive and breathlessness in COPD[J].
Eur Respir J,2015, 45 (2) : 355-64.
DOI: 10.1183/09031936.00063014. ( 0) 0)
|
| [10] |
Luo YM, He BT, Wu YX, et al. Neural respiratory drive and ventilation in patients with chronic obstructive pulmonary disease during sleep[J].
Am J Respir Crit Care Med,2014, 190 (2) : 227-9.
DOI: 10.1164/rccm.201402-0302LE. ( 0) 0)
|
| [11] |
Qin YY, Steier J, Jolley C, et al. Efficiency of neural drive during exercise in patients with COPD and healthy subjects[J].
Chest,2010, 138 (6) : 1309-15.
DOI: 10.1378/chest.09-2824. ( 0) 0)
|
| [12] |
李寅环, 陈荣昌, 陈新, 等. 吸入支气管舒张剂对慢性阻塞性肺疾病患者动态内源性呼气末正压的影响[J].
中国实用内科杂志,2007, 27 (4) : 278-81.
( 0) 0)
|
| [13] |
李寅环. 吸入支气管舒张剂对慢性阻塞性肺疾病患者呼吸力学的影响[J].
中国呼吸与危重监护杂志,2007, 6 (3) : 171-90.
( 0) 0)
|
| [14] |
Qin YY, Li RF, Wu GF, et al. Effect of tiotropium on neural respiratory drive during exercise in severe COPD[J].
Pulm Pharmacol Ther,2015, 30 : 51-6.
DOI: 10.1016/j.pupt.2014.11.003. ( 0) 0)
|
| [15] |
Ulrik CS. Clinical benefit of fixed-dose dual bronchodilation with glycopyrronium and indacaterol once daily in patients with chronic obstructive pulmonary disease: a systematic review[J].
Int J Chron Obstruct Pulmon Dis,2014, 9 : 331-8.
( 0) 0)
|
| [16] |
Mahler DA, Kerwin E, Ayers T, et al. FLIGHT1 and FLIGHT2: efficacy and safety of QVA149 (indacaterol/glycopyrrolate) versus its monocomponents and placebo in patients with chronic obstructive pulmonary disease[J].
Am J Respir Crit Care Med,2015, 192 (9) : 1068-79.
DOI: 10.1164/rccm.201505-1048OC. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
