2. 南方医科大学中医药学院,广东 广州 510515 ;
3. 南方医科大学南方医院药学部,广东 广州 510515
2. College of Traditional Chinese Medicine, Southern Medical University, Guangzhou 510515, China ;
3. Department of Pharmacy, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
肝细胞癌(HCC)是目前严重危害人类健康的恶性肿瘤之一,每年导致大约25~100万人死亡[1]。我国是原发性肝癌的高发地,其死亡率高居恶性肿瘤第2位。虽然目前肝癌的治疗方法有射频消融、肝动脉介入化疗栓塞、分子靶向药物治疗等,但肿瘤的生长和早期转移仍无法被完全抑制[2]。肝癌发生的分子机制十分复杂,目前尚未阐明,相关研究表明可能与癌基因的激活和抑癌基因的失活密切相关。因此,目前肝癌研究的热点和难点在于探索新的肝癌细胞生长、侵袭机制,并研发新的抗癌药物。
鳖甲煎丸出自东汉张仲景的《金匮要略》,具有软坚散结、益气养血、活血化瘀等多方面疗效。现代医学研究表明,鳖甲煎丸具有抗癌、抗纤维化、调节机体免疫等作用[3-5],但其作用机制尚未完全阐明。我们前期的细胞体外实验研究发现,鳖甲煎丸能通过Wnt/β-catenin通路有效抑制肝癌细胞HepG2的增殖、黏附和侵袭[6-10]。为进一步探讨鳖甲煎丸体内抗肝细胞癌的作用机制,我们进行一系列的动物模型实验。
1 材料和方法 1.1 材料及试剂BALBc-nu裸小鼠购自南方医科大学实验动物中心;肝癌细胞系(HepG2)由南方医科大学药学院抗病毒中心提供;DMEM(高糖)、胎牛血清系美国GIBCO产品;β-catenin抗体、PCNA抗体、Tbx3抗体、二抗购自美国Abcam公司;TUNEL试剂盒由罗氏公司提供;胰蛋白酶、二甲基亚砜(DMSO)由Sigma公司提供;即用型免疫组化Biotin-SP-HRP试剂盒系武汉博士德生物工程有限公司产品;RIPA裂解液;BCA法蛋白浓度测定试剂盒、预染蛋白marker购自Thermo Scientific公司,ECL发光液购自Santa Cruz公司;PVDF膜、显影液、定影液、胶片购自广州浩玛生物技术有限公司;6孔板、培养皿由corning公司提供;恒温CO2细胞培养孵箱系美国Froma Scientific产品;超净工作台系苏州医疗仪器厂产品。
1.2 实验方法 1.2.1 裸鼠皮下成瘤实验6周龄BALBc-nu裸小鼠,体质量(16±2)g,雌性,在南方医科大学SPF级动物房普通饲料喂养,自由饮水,每周测量裸鼠体质量。将裸鼠随机分为高药物剂量组(下称H组)、中药物剂量组(下称M组)、低药物剂量组(下称L组)、阴性对照组(下称NC组),每组8只。取对数生长期HepG2细胞,胰酶适度消化,800 r/min离心5 min去上清。用生理盐水洗涤3次,调整细胞浓度为5×107/mL。H组、M组、L组和NC组裸小鼠于腋窝处皮下注射细胞悬液,每只0.2 mL。鳖甲煎丸用生理盐水溶解,分别配制为0.22、0.11、0.055 g/mL 3个剂量组的混悬液,3 d后鳖甲煎丸干预组(H组、M组和L组)分别按照2.2、1.1、0.55 g/kg灌胃给药,阴性对照组用等量生理盐水灌胃,1次/d,连续给药4周,于第4周(30 d)给药后0.3%异戊巴比妥钠腹腔注射麻醉。切取皮下结节,拍照,切取0.5 cm×0.5 cm大小组织2块,一块放于4%中性甲醛中固定24 h,石蜡包埋,以备后续组织学检查。
1.2.2 免疫组织化学法检测人肝癌HepG2裸鼠移植瘤组织中PCNA的表达水平将组织切成5微米厚度的切片。将干燥后的切片用二甲苯脱蜡,然后逐级经纯酒精及梯度酒精直至蒸馏水水化。0.5% Triton X-100孵育1次20 min,3% H2O2孵育15 min,封闭血清孵育20 min,一抗(动物血清配,滴度1:200,湿盒)孵育4 ℃过夜(阴性对照使用PBS液),二抗工作液孵育(湿盒)37 ℃ 30 min,DAB显色约10~15 min,自来水洗1次5 min,苏木素复染10 min,自来水洗5 min。中性树胶封片。光镜下分析结果,拍照。
1.2.3 TUNEL法检测人肝癌HepG2裸鼠移植瘤细胞凋亡TUNEL切片常规脱蜡至水后,每张切片加3%过氧化物酶阻断剂50 μL,室温孵育10 min,去离子水冲洗3次。用蛋白酶K(Zoug/inl溶于10 mmol/L Tris/HCl中,pH7.4)在湿盒中37 ℃孵育30 min,PBS液冲洗2次。擦干样品周围的水,滴加50 μL的TUNEL反应混合液,在湿盒中37 ℃孵育60 min,PBS液冲洗3次。滴加50 μL的converter-POD,在湿盒中37℃孵育30 min,PBS液冲洗3次。加入50-100 μL DAB底物溶液,在室温孵育10 min,PBS液冲洗3次。苏木素复染,脱水,透明,封片。在光镜下分析结果,胞核中着棕黄色颗粒为TUNEL阳性细胞。在光学显微镜下每例随机选取5个高倍视野,计数阳性细胞的百分率。
1.2.4 Western blot检测人肝癌HepG2裸鼠移植瘤组织中β-catenin和Tbx3的表达水平取冻存组织,按照RIPA裂解液说明书裂解。BCA测定蛋白浓度,酶标仪测定波长为A562,根据标准曲线计算出蛋白浓度。灌制10%的分离胶,5%的浓缩胶的SDS-PAGE凝胶。吸取60 μg总蛋白,恒压80 V,30 min。当溴酚蓝前沿进入分离胶,把电压提高到120V,继续电泳90 min直到溴酚蓝到达分离胶底部。半干电转恒压20 V,18 min,将蛋白从SDS-PAGE凝胶转至PVDF膜。5%的脱脂奶粉封闭。β-actin作为内参,一抗(5%的脱脂奶粉,1:800稀释)4 ℃孵育过夜。1:4000稀释二抗孵育1 h,增强化学发光显影。UVI凝胶成像系统摄像,Image J软件分析条带灰度值。
1.3 统计学处理实验数据用SPSS13.0采用单因素方差分析方法,以P < 0.05为差异有统计学意义,数据以均数±标准差表示。
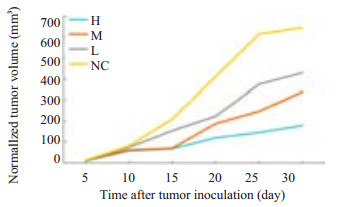
2 结果 2.1 鳖甲煎丸对人肝癌HepG2裸鼠移植瘤生长的抑制作用裸鼠皮下接种细胞2 d后接种部位见一白色小皮丘,并逐渐缩小,1周后逐渐转为实性结节并增大,2周左右测量瘤体直径约7 mm,成瘤率达100%。第2周末,鳖甲煎丸干预组皮下瘤生长速度明显慢于阴性对照组。30 d时,鳖甲煎丸干预组瘤体体积明显小于阴性对照组(体积=1/2×长径×宽径2)(P < 0.05),差异具有统计学意义(图 1)。
|
图 1 各组人肝癌HepG2裸鼠移植瘤生长趋势 Figure 1 Tumor growth curve (normalized tumor volume) in nude mice in different groups. H: High-dose group, M: Middle-dose group, L: Low-dose group, NC: Negtive control group. |
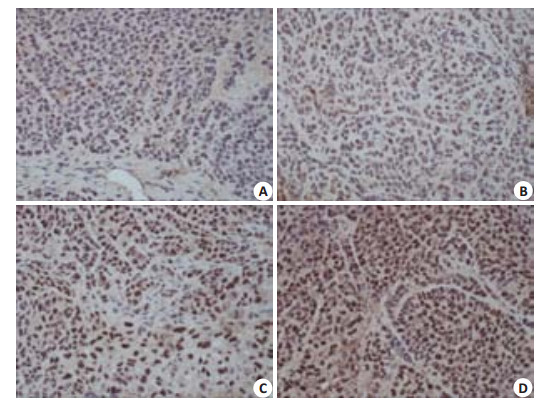
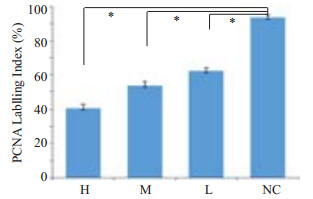
PCNA蛋白主要表达于癌细胞核,少数表达于细胞质中,各组人肝癌HepG2裸鼠移植瘤组织切片PCNA免疫组化结果显示,黄色为阳性细胞。连续观察5个高倍视野,阳性细胞数占总细胞数小于25%为(-),25%~50%为(+),51%~75%为(++),大于75%为(+++),阳性细胞数超过25%作为组织阳性诊断标准。多视野阳性细胞计数结果表明,H(40.9±2.31)、M(53.5±2.41)、L(62.3±1.80)组与NC(93.5±1.70)组相比PCNA阳性细胞比例显著降低(P < 0.05,图 2、3)。
|
图 2 免疫组化检测各组人肝癌HepG2裸鼠移植瘤组织中PCNA表达 Figure 2 Immunohistochemistry for PCNA in the xenografts in different groups (Original magnification: × 200). A: High-dose group; B: Middle-dose group; C: Low-dose group; D: Negtive control group. |
|
图 3 各组人肝癌 HepG2 裸鼠移植瘤组织中PCNA表达水平 Figure 3 Quantification of PCNA-positive cells in every 1000 cells in the xenografts from each animal (n=4). *P<0.05. |
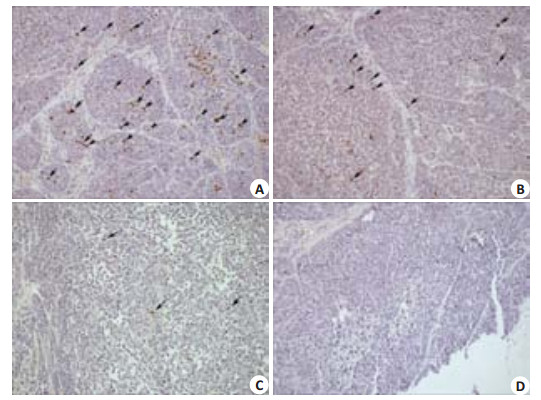
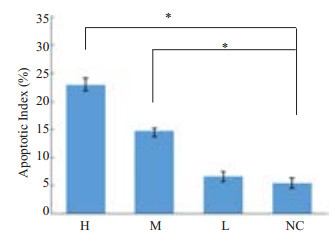
TUNEL法检测人肝癌HepG2裸鼠移植瘤细胞凋亡,细胞核中着棕黄色颗粒为阳性细胞,在光学显微镜下每例随机选取5个高倍视野(图 4),计算凋亡细胞数及总细胞数,计数阳性细胞的百分率,凋亡指数=凋亡细胞数/肿瘤细胞总数×100%。结果表明,H组(22.9±1.22)、M组(14.7±0.50)较NC组(5.5±0.90)阳性细胞数目明显增多,且差异具有统计学意义(P < 0.05,图 5)。
|
图 4 TUNEL法检测人肝癌HepG2裸鼠移植瘤细胞的凋亡 Figure 4 TUNEL assay of the xenografts in different groups (Original magnification: × 100). A: High-dose group; B: Middle-dose group; C: Low-dose group; D: Negtive control group. |
|
图 5 各组人肝癌HepG2裸鼠移植瘤组织的凋亡情况 Figure 5 Apoptotic index of the cells in the xenografts in different groups. *P<0.05. |
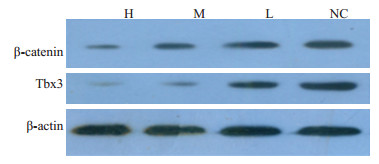
Western blotting检测各组人肝癌HepG2裸鼠移植瘤组织切片β-catenin、Tbx3的表达水平,结果显示,H组、M组与NC组相比,β-catenin和Tbx3的表达水平均显著降低(P < 0.05),且其抑制作用与药物血清浓度呈正相关(图 6)
|
图 6 各组人肝癌HepG2裸鼠移植瘤组织中β-catenin和Tbx3的表达水平 Figure 6 Expression of β-catenin and Tbx3 in the xenografts in different groups. P<0.05. |
肝细胞癌为我国常见恶性肿瘤之一,中医根据其症状和体征,多将其归为积聚、癥瘕等范畴。肝癌是多种致病因素协同作用的结果,中医学认为肝癌的病因病机主要与人体正虚邪实、气滞血瘀、湿毒凝聚有关。本虚者,主要表现为气、血、阴、阳等方面的亏虚;标实者,则主要有气滞、痰湿、血瘀、热毒等表现。肝癌的临床治疗以手术、放化疗及生物治疗为主,但临床疗效均不十分理想。鳖甲煎丸在临床治疗肝癌中,具有疗效确切、副作用小等特点[11],具有益气养血、活血化瘀、解毒散结之功,在治疗肝癌方面具有一定的优势。
裸鼠成瘤实验是药物抗肿瘤的经典实验,该实验具有特异性强、干扰因素少等优点。本实验采用6周龄裸鼠接种人肝癌细胞株HepG2,接种3 d后可见裸鼠接种点皮下出现单个白色小节,此时开始每日按分组灌胃鳖甲煎丸混悬液,并测量结节大小,至30 d时处死裸鼠,实验过程中无裸鼠死亡,解剖得到皮下结节经病理检测证实为癌结节。由此,人肝癌HepG2裸鼠成瘤实验造模成功。实验结果表明,和阴性对照组相比,鳖甲煎丸药物干预组人肝癌HepG2裸鼠移植瘤生长速度明显减缓,瘤体体积也明显小于阴性对照组。
增殖细胞核抗原(PCNA)是DNA聚合酶δ的辅助蛋白,其在细胞核内合成,并储存于细胞核中,是DNA复制的必需物质[12],与细胞中DNA合成及细胞周期有着密切关系[13]。研究发现,在细胞周期中,PCNA的表达从G1期开始升高,到S期时表达量达到最高,到G2期开始逐渐下降[14],表明PCNA的合成和表达与细胞增殖有着密切的关系,是反映细胞增殖的主要生物学指标[15]。张绪慧等[16-17]发现,鳖甲煎丸可以抑制荷瘤小鼠VEGF及PCNA的表达水平,并能够抑制肿瘤中微血管生成,推测鳖甲煎丸抑制肿瘤生长的机制与可能此有关。通过免疫组化法检测裸鼠移植瘤组织中PCNA的表达水平,结果表明,鳖甲煎丸干预组的阳性细胞比例显著少于阴性对照组,表明鳖甲煎丸能够抑制人肝癌HepG2裸鼠移植瘤组织中PCNA的表达,且抑制作用与药物浓度呈正相关。
细胞凋亡是由体内外多种因素触发细胞内预存的死亡程序而导致的细胞死亡过程,也称为程序性细胞死亡。鳖甲煎丸能明显抑制人肝癌HepG2细胞株在体外的生长。TUNEL法是目前在组织水平检测细胞凋亡的经典方法,我们运用该方法在人肝癌HepG2裸鼠成瘤实验所得的标本中进行检测,发现与NC组相比,H组和M组能使肝癌细胞凋亡程度明显上升。进一步说明鳖甲煎丸能够抑制肝癌细胞的生长并促进其凋亡。
肝癌发生发展与细胞信号转导通路有着密切关系,如Wnt/β-catenin信号通路、Notch信号转导通路、核转录因子kappaB(NF-κB)通路等[18]。其中,Wnt/β-catenin信号通路与肝癌的关系日益受到研究人员的重视。Wnt/ β-catenin信号通路在生物进化中极为保守,正常成熟细胞中Wnt/β-catenin通路处于未激活状态,其异常激活与人类疾病有着密切关系[19]。研究发现,Wnt/β-catenin信号通路在肿瘤的增殖、侵袭以及转移中起到至关重要的作用[20]。β-catenin主要参与细胞间黏附,调控细胞生长、分化和凋亡等过程,是Wnt/β-catenin信号通路重要的信号分子[21]。Wnt/β-catenin信号通路激活后,β-catenin在细胞质中逐渐积累,当其浓度达到一定的程度时则向细胞核内转移。在细胞核中,β-catenin与转录因子家族Tcf/Lefs结合,可激活cyclinD1、c-myc等一系列原癌基因而导致细胞的增殖、分化、成熟。因此,β-catenin在细胞内的积累与肿瘤的发生、侵袭以及转移有着密切关系[22-23]。本实验结果表明,鳖甲煎丸对人肝癌HepG2裸鼠移植瘤组织中β-catenin的表达有显著抑制作用,可以直接降低人肝癌HepG2裸鼠移植瘤组织中β-catenin的表达水平,减少β-catenin在人肝癌HepG2裸鼠移植瘤细胞内的积累,且这种抑制作用与药物浓度呈正相关。
近年来研究发现,Tbx3是Wnt/β-catenin信号通路下游的新靶点。一方面,在肝癌细胞中,激活的果蝇蛋白促使β-catenin转移至核内,通过T细胞因子直接作用于他们的靶目标Tbx3的启动子,激活Tbx3的表达,从而促进肝癌细胞的增殖[24];另一方面,Tbx3还可负调节作用于细胞膜表面的β-catenin,从而抑制E-钙黏蛋白的表达,促进肿瘤细胞的侵袭和转移[25]。所以,Tbx3是Wnt/β-catenin信号通路中的一个关键因子。因此我们认为Tbx3可能是鳖甲煎丸所调控的靶蛋白之一。实验结果表明,与阴性对照组相比,鳖甲煎丸干预组的Tbx3表达水平显著降低。表明鳖甲煎丸能通过影响Wnt/ β-catenin信号通路来调控Tbx3的表达,最终抑制肝癌细胞的侵袭转移,并促进其凋亡,达到抗肝细胞癌的目的。
综上所述,鳖甲煎丸可以抑制肝癌细胞的生长,促进肝癌细胞的凋亡,从而达到抑制肝癌组织生长的目的。其机制可能与鳖甲煎丸通过Wnt/β-catenin信号通路调控Tbx3的表达有关。研究表明β-catenin蛋白是鳖甲煎丸的一个特异性作用位点,但鳖甲煎丸对其他抑癌因子是否具有调控作用,以及这些抑癌因子与β-catenin之间的相关性还有待进一步研究。
| [1] |
闫涛, 苏俐. 原发性肝癌的流行特征及其生存质量研究进展[J].
内蒙古医学杂志,2013 (6) : 702-5.
( 0) 0)
|
| [2] |
吴孟超, 吴东. 原发性肝癌的外科治疗进展[J].
临床外科杂志,2005 (1) : 4-7.
( 0) 0)
|
| [3] |
罗庆东, 王月飞, 赵红晔, 等. 鳖甲煎丸对肝癌荷瘤小鼠肿瘤组织生长及转移的影响[J].
中国实验方剂学杂志,2012 (14) : 230-2.
( 0) 0)
|
| [4] |
缪京翔. 鳖甲煎丸抗乙肝后肝纤维化作用的机制研究[J].
河南中医,2010 (5) : 457-9.
( 0) 0)
|
| [5] |
王丹, 关洪全. 鳖甲煎丸煎剂对大鼠免疫功能影响的实验研究[J].
辽宁中医药大学学报,2010 (7) : 103-4.
( 0) 0)
|
| [6] |
程旸, 贺松其, 朱云, 等. 鳖甲煎丸抑制肝癌细胞增殖、黏附及侵袭作用的实验研究[J].
中国中西医结合杂志,2013 (5) : 664-7.
( 0) 0)
|
| [7] |
贺松其, 程旸, 朱云, 等. 鳖甲煎丸对肝细胞癌中Wnt/β-catenin信号通路及抑制基因DKK-1、FrpHe表达的影响[J].
南方医科大学学报,2013 (1) : 30-3.
( 0) 0)
|
| [8] |
郑艳, 贺松其, 文彬, 等. 鳖甲煎丸对HUVEC增殖及HepG2中VEGF表达的影响[J].
中国实验方剂学杂志,2014 (20) : 132-6.
( 0) 0)
|
| [9] |
文彬, 孙海涛, 贺松其, 等. 鳖甲煎丸对Wnt信号通路中β-catenin/ TCF4复合物活性及信号分子cyclin D1、MMP-2的影响[J].
南方医科大学学报,2014 (12) : 1758-62.
( 0) 0)
|
| [10] |
孙海涛, 贺松其, 文彬, 等. 鳖甲煎丸对肝癌细胞中Wnt信号分子β-catenin、GSK-3β及靶基因CD44v6、VEGF的影响[J].
南方医科大学学报,2014 (10) : 1454-8.
( 0) 0)
|
| [11] |
曹阳. 鳖甲煎丸加减在原发性肝癌治疗中的应用[J].
中国中医基础医学杂志,2000 (7) : 30-1.
( 0) 0)
|
| [12] |
Han JM, Myung H, Kim S. Antitumor activity and pharmacokinetic properties of ARS-interacting mμLti-functional protein 1 (AIMP1/p43)[J].
Cancer Lett,2010, 287 (2) : 157-64.
DOI: 10.1016/j.canlet.2009.06.005. ( 0) 0)
|
| [13] |
Xing G, Kirouac K, Shin YJ, et al. Structural insight into recruitment of translesion DNA polymerase Dpo4 to sliding clamp PCNA[J].
Mol Microbiol,2009, 71 (3) : 678-91.
DOI: 10.1111/mmi.2009.71.issue-3. ( 0) 0)
|
| [14] |
Zolota VG, Tzelepi VN, Leotsinidis M, et al. Histologic-type specific role of cell cycle regμLators in non-small cell lung carcinoma[J].
J Surg Res,2010, 164 (2) : 256-65.
DOI: 10.1016/j.jss.2009.03.035. ( 0) 0)
|
| [15] |
Maga G, Hubscher U. Proliferating cell nuclear antigen (PCNA): a dancer with many partners[J].
J Cell Sci,2003, 116 (Pt 15) : 3051-60.
( 0) 0)
|
| [16] |
张绪慧, 陈达理, 罗荣城. 鳖甲煎丸对H22荷瘤小鼠的抑瘤作用及对增殖细胞核抗原表达的影响[J].
南方医科大学学报,2006 (12) : 1791-3.
( 0) 0)
|
| [17] |
张绪慧, 梁磊, 蔡长青, 等. 鳖甲煎丸对H22荷瘤小鼠肿瘤血管抑制作用的研究[J].
山东中医杂志,2010 (5) : 330-1.
( 0) 0)
|
| [18] |
汪增秀, 华海清. 肝癌相关细胞信号转导通路的研究进展[J].
肿瘤防治研究,2012 (5) : 604-8.
( 0) 0)
|
| [19] |
Logan CY, Nusse R. The Wnt signaling pathway in development and disease[J].
Annu Rev Cell Dev Biol,2004, 20 : 781-810.
DOI: 10.1146/annurev.cellbio.20.010403.113126. ( 0) 0)
|
| [20] |
环奕. WNT信号通路与肿瘤[J].
基础医学与临床,2006 (8) : 922-5.
( 0) 0)
|
| [21] |
Kim W, Kim M, Jho EH. Wnt/beta-catenin signalling: from plasma membrane to nucleus[J].
Biochem J,2013, 450 (1) : 9-21.
DOI: 10.1042/BJ20121284. ( 0) 0)
|
| [22] |
Behrens J, Lustig B. The Wnt connection to tumorigenesis[J].
Int J Dev Biol,2004, 48 (5-6) : 477-87.
DOI: 10.1387/ijdb.041815jb. ( 0) 0)
|
| [23] |
Doucas H, Garcea G, Neal CP, et al. Changes in the Wnt signalling pathway in gastrointestinal cancers and their prognostic significance[J].
Eur J Cancer,2005, 41 (3) : 365-79.
DOI: 10.1016/j.ejca.2004.11.005. ( 0) 0)
|
| [24] |
Renard CA, Labalette C, Armengol C, et al. Tbx3 is a downstream target of the Wnt/beta-catenin pathway and a critical mediator of beta-catenin survival functions in liver cancer[J].
Cancer Res,2007, 67 (3) : 901-10.
DOI: 10.1158/0008-5472.CAN-06-2344. ( 0) 0)
|
| [25] |
Kowalski PJ, Rubin MA, Kleer CG. E-cadherin expression in primary carcinomas of the breast and its distant metastases[J].
Breast Cancer Res,2003, 5 (6) : R217-22.
DOI: 10.1186/bcr651. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
