2. 重庆医科大学感染性疾病分子生物学教育部重点实验室,重庆 400016
2. Key Laboratory of Molecular Biology on Infection Diseases of Ministry of Education, Chongqing Medical University, Chongqing 400016, China
肝细胞癌(hepatocellular carcinoma, HCC)是全球范围内的多发性肿瘤,也是我国常见的恶性肿瘤,死亡率居我国恶性肿瘤的第2位[1]。每年约有630 000例肝癌新发病人,其中一半以上发现在中国[2]。Sirtuin家族是近来发现的依赖烟酰胺腺嘌呤二核苷酸(NAD+)的第Ⅲ类组蛋白去乙酰化酶[3]。人类sirtuin家族有7个成员,即SIRT1~7。他们的主要功能有:参与细胞衰老[4]、凋亡[5]、分化[6]、应激[7]及能量代谢[8]等。越来越多的证据表明,Sirtuin家族与肿瘤有着密切的联系[9]。沉默信息调节因子3(SIRT3)是线粒体内主要的去乙酰化酶,广泛分布于成人和胚胎组织。作为一种线粒体蛋白,SIRT3在能量生成[8]、代谢[10]、细胞老化[11]、细胞凋亡[12]和细胞内信号控制[13]等方面发挥着重要作用,且其在肿瘤方面的作用也逐渐受到重视。但SIRT3在癌症中的作用倍受争议,曾有文献报道[14],SIRT3缺失的小鼠成纤维细胞表现出了线粒体异常,并增加了应激诱导的基因组不稳定性,且细胞易发生癌变。另一些文献报道了,SIRT3在一些癌症中呈现高水平的表达[15-17]。SIRT3在不同肿瘤进展中的作用不同可能与肿瘤细胞类型和SIRT3在不同信号通路中的作用不同有关。目前,对于SIRT3在肝癌发生发展过程中的作用研究较少,因此明确SIRT3在肝癌细胞增殖中的作用,对进一步深入研究SIRT3对肝癌进展的影响、分析其分子机制、寻找肝癌治疗的分子靶向药物等具有重要的意义。
1 材料和方法 1.1 材料SK-Hep-1、PLC5、SMCC-7721及MIHA细胞系购于ATCC(American Type Culture Collection)。L02来自Prof.Nathalie Wong(香港中文大学)。pcDNA3.1及SIRT3质粒购于Addgene公司,siRNA购于RIBOBIO公司。SIRT3抗体(#3627)购于Cell Signaling Technology公司。辣根过氧化物酶标记羊抗兔IgG购于GE公司。GAPDH及辣根过氧化物酶标记羊抗鼠IgG购于中杉金桥公司。BCA试剂盒购于碧云天公司。逆转录试剂盒FastQuant RT Ki(t with gDNase)购于TIANGEN公司,SYBR Green购于Roche公司。Click-iT EdU Imaging Kits购于Life Technologies,Invitrogen。质粒转染试剂购买自Roche公司。siRNA转染试剂购于QIGEN公司。
1.2 方法 1.2.1 细胞培养以上细胞均培养于含有10% FBS,1% p/s的DMEM培养基中,在含5% CO2、37 ℃孵箱中常规培养。质粒转染和siRNA转染严格按照试剂说明书操作。
1.2.2 Western blotting用RIPA裂解液使肝组织及细胞充分裂解,16 000 g离心5 min并取上清于新的EP管中。BCA试剂盒测蛋白浓度,SDS-PAGE凝胶电泳,每孔上样量为30 μg蛋白,将蛋白转至NC膜(RPN303D, GE公司),5%脱脂牛奶封闭1 h,一抗4 ℃摇床孵育过夜(SIRT3抗体:BSA=1:3000),二抗室温孵育2 h。以GAPDH为内参。
1.2.3 qRT-PCR细胞转染3 d后,提取RNA,逆转录RNA成cDNA,并同时去除基因组DNA,随后使用FastStart Universal SYBR Green Master Mix进行qPCR,以β-actin为内参。每组实验重复3次。以2-△△Ct计算目的基因的相对表达水平。
1.2.4 台盼蓝排斥实验转染后3、4、5 d后进行台盼蓝细胞计数。40 μL细胞悬液加40 μL台盼蓝染液,用枪头吹打混匀后,吸取10 μL加入到计数板内,罗氏自动化细胞计数系统Cedex XS机器读数。并收集细胞以Western blotting进行过表达验证。
1.2.5 平板集落实验转染24 h后换液时,加入含有300 μ/mL G418的新培养基。3孔为pcDNA3.1组,3孔为SIRT3组。每3 d换液1次,细胞长至50%以上,重新传代,3周时观察到明显的集落,进行结晶紫染色。
1.2.6 EdU标记实验将SMMC-7721细胞12×104接种于含无菌盖玻片的6孔板中,24 h后转染质粒或siRNA,3 d后运用Click-iT EdUImaging Kits进行EdU标记实验,操作步骤严格按试剂盒说明书进行。
1.2.7 统计分析采用SPSS 19.0软件进行统计学分析,对两样本均数间比较采用配对t检验,多样本间均数比较采用单因素方差分析,组间两两比较采用两因素方差分析检验。以P < 0.05为差异具有统计学意义。
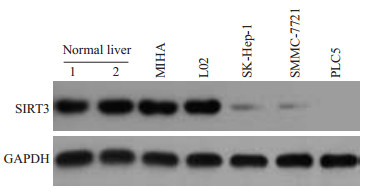
2 结果 2.1 SIRT3在肝组织及不同细胞中的表达差异收集正常肝组织2例,提取总蛋白;提取永生化肝细胞MIHA、L02,肝癌细胞SK-Hep-1、SMMC-7721、PLC5的总蛋白。Western blotting检测SIRT3的蛋白表达水平,结果显示SIRT3在肝癌细胞系中的表达量明显低于正常肝组织和永生化肝细胞(图 1)。
|
图 1 Western blotting显示SIRT3在正常肝组织、永生化肝细胞、肝癌细胞系中的蛋白表达水平 Figure 1 Expression levels of SIRT3 protein in normal liver tissues, immortalized hepatocyte and HCC cell lines detected by Western blotting. |
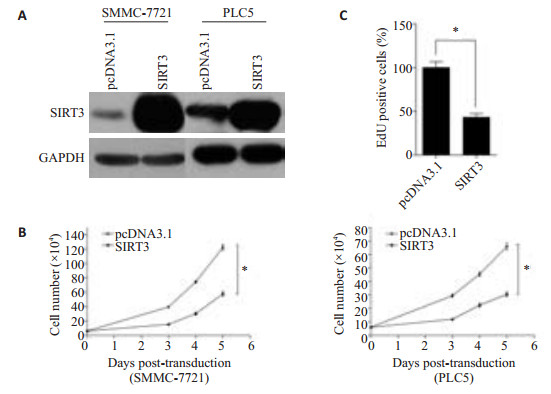
我们首先在SMMC-7721、PLC5这两种肝癌细胞系中成功的过表达SIRT3,Western blotting检测过表达效率(图 2A)。并在此基础上进行台盼蓝排斥实验,结果显示SIRT3过表达对SMMC-7721细胞增殖的抑制率在第3、4、5天分别为61%、59%、53%(图 2B,P < 0.05);SIRT3过表达对PLC5细胞增殖的抑制率在第3、4、5天分别为59%、51%、54%(图 2B,P < 0.05);同时,我们在SMMC-7721上进行了EdU标记实验,结果显示过表达SIRT3使肝癌细胞中的DNA合成能力较对照组下降了57%(图 2C,P < 0.05)。揭示SIRT3过表达明显抑制了肝癌细胞增殖。
|
图 2 SIRT3过表达对肝癌细胞增殖的影响 Figure 2 Effect of SIRT3 overexpression on proliferation of HCC cells. A: Western blotting for detecting overexpression of SIRT3 in transfected SMMC-7721 and PLC5 cells; B: Trypan blue exclusion experiment showing the changes in proliferation of SMMC-7721 and PLC5 cells following the transfection. *P<0.05 vs pcDNA3.1 group. C: Effect of SIRT3 overexpression on DNA synthesis of SMMC-7721 cells tested by EdU incorporation assay. *P<0.05 vs pcDNA3.1 group. |
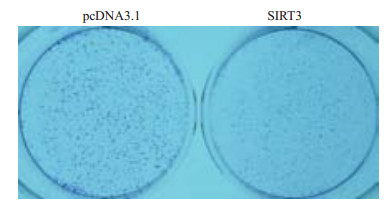
在SMMC-7721中过表达SIRT3,并以0.2 μmol/L嘌呤霉素处理培养2周,结晶紫染色。结果显示与pcDNA3.1组相比,SIRT3过表达组中肝癌细胞集落数目明显降低,提示着SIRT3过表达可显著抑制肝癌细胞的集落形成能力(图 3)
|
图 3 集落形成实验检测过表达SIRT3对肝癌细胞集落形成能力的影响 Figure 3 Colony-forming assay of HCC cells overexpressing SIRT3. |
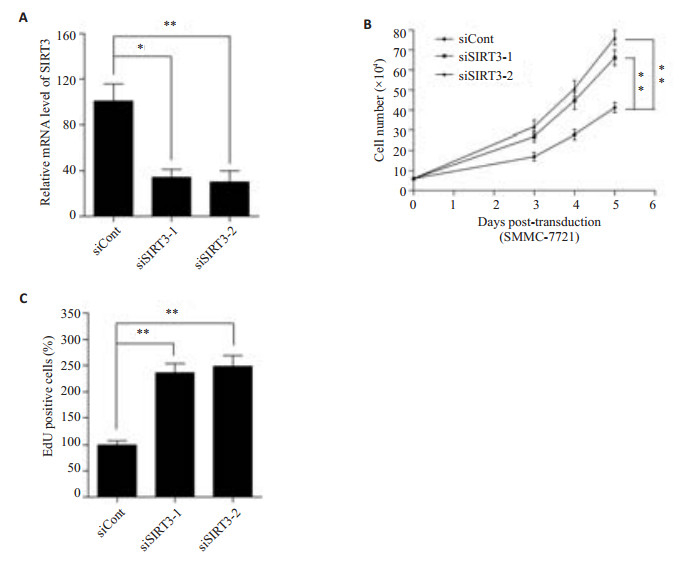
我们首先在SMMC-7721细胞中转染了靶向沉默SIRT3的siRNA和siCont,qRT-PCR证实SIRT3的沉默是有效的(图 4A),siSIRT3-1的沉默效率约为65%(P < 0.05),siSIRT3-2的沉默效率约为70%(P < 0.01)。在SIRT3沉默的基础上,通过台盼蓝排斥实验分析发现转染siSIRT3-1使SMMC-7721细胞增殖在第3、4、5天分别增加了59% 、61% 、61%(图 4B,P < 0.01),转染siSIRT3-2使SMMC-7721细胞增殖在第3、4、5天分别增加了55%、51%、53%(图 4B,P < 0.01),同时,通过EdU标记实验检测也发现siSIRT3-1、siSIRT3-2使SMMC-7721细胞的DNA合成能力分别增加了137%、149%,揭示着SIRT3沉默明显促进了SMMC-7721中的DNA合成能力(图 4C,P < 0.01)。这些结果证实SIRT3沉默可以明显促进肝癌细胞增殖。
|
图 4 SIRT3沉默对肝癌细胞增殖的影响 Figure 4 Effect of SIRT3 knockdown on HCC cell proliferation. A: QRT-PCR for detecting the knockdown efficiency of SIRT3. *P<0.05, **P< 0.01 vs siCont group; B: Effect of SIRT3 knockdown on SMMC-7721 cell proliferation. **P<0.01 vs siCont group; C: Effect of SIRT3 knockdown on DNA synthesis in SMMC-7721 cells. **P<0.01 vs siCont group. |
近年来,SIRT3的作用逐渐受到人们的关注,SIRT3通过去乙酰化SOD2的2个关键的赖氨酸残基,促进了SOD2的抗氧化活性[18],SIRT3也能够去乙酰化MnSOD赖氨酸122,诱导其活性[19],从而调节了细胞氧化应激反应。有研究表明[20]SIRT3通过去乙酰化Ku,促进Ku70-Bax的相互作用,调节了细胞凋亡。也有文献报道[21]SIRT3抑制P53的活性,参与了细胞周期和老化的调节。此外,SIRT3能调节肿瘤发生的不同进程,如细胞能量代谢失控,基因组不稳定性增加,促肿瘤炎症反应等,并在一些肿瘤中起着双重调节的作用,对口腔癌、纤维肉瘤、宫颈癌、淋巴结阳性的乳腺癌、膀胱癌,SIRT3起促进肿瘤发生的作用,而在结肠癌、骨肉瘤、早期乳腺癌、白血病中,起抑制肿瘤发生的作用[22]。因此,SIRT3在不同的肿瘤组织中有着不同的功能,这种功能具有细胞和肿瘤特异性。而目前有关于SIRT3在肝癌中的报道还很少。
本研究表明,SIRT3在肝癌细胞系中的表达量明显低于正常肝组织及永生化肝细胞。而在过表达SIRT3后,台盼蓝排斥实验检测明显观察到肝癌细胞的生长受到了抑制。EdU标记实验检测显示过表达SIRT3使得肝癌细胞的DNA合成能力显著减弱,进一步提示了SIRT3可抑制肝癌细胞的增殖。此外,平板集落实验显示过表达SIRT3可显著减弱肝癌细胞的集落形成能力。最后,我们在肝癌细胞中沉默SIRT3后发现肝癌细胞的增殖能力和DNA合成能力都显著增强。目前许多研究关注于SIRT3对不同肿瘤细胞增殖作用的机制研究,在胃癌进展中,SIRT3通过下调Notch-1的表达抑制了胃癌细胞增殖[23];在胰腺肿瘤发生中,SIRT3通过调节GOT2的乙酰化状态,抑制了细胞氧化应激反应,促进了胰腺肿瘤细胞增殖[24];在非小细胞肺癌发展中,SIRT3去乙酰化NMNA2,调节了细胞能量代谢,有利于细胞增殖[25]。从这些报道中发现SIRT3通过不同的信号通路对肿瘤细胞增殖有着不同的调节作用,下一步我们也将从氧化应激反应、能量代谢、凋亡等方面研究SIRT3影响肝癌细胞增殖的分子机制。肿瘤的发生是一个多基因、多步骤的过程,其中恶性增殖能力是肿瘤细胞的重要表型。我们从SIRT3过表达和沉默两个方面证实了SIRT3可抑制肝癌的增殖。因此,本研究对明确SIRT3对肝癌发生发展的作用,鉴定新的治疗肝癌的分子药物靶点具有重要的意义。
| [1] |
Yuen MF, Hou JL, Chutaputti A, et al. Hepatocellular carcinoma in the Asia pacific region[J].
J Gastroenterol Hepatol,2009, 24 (3) : 346-53.
DOI: 10.1111/jgh.2009.24.issue-3. ( 0) 0)
|
| [2] |
Ding J, Wang H. Multiple interactive factors in hepatocarcinogenesis[J].
Cancer Lett,2014, 346 (1) : 17-23.
DOI: 10.1016/j.canlet.2013.12.024. ( 0) 0)
|
| [3] |
Imai S, Armstrong CM, Kaeberlein M, et al. Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase[J].
Nature,2000, 403 (6771) : 795-800.
DOI: 10.1038/35001622. ( 0) 0)
|
| [4] |
Feinberg AP, Tycko B. The history of cancer epigenetics[J].
Nat Rev Cancer,2004, 4 (2) : 143-53.
DOI: 10.1038/nrc1279. ( 0) 0)
|
| [5] |
Lin Z, Yang H, Kong Q, et al. USP22 antagonizes p53 transcriptional activation by deubiquitinating Sirt1 to suppress cell apoptosis and is required for mouse embryonic development[J].
Mol Cell,2012, 46 (4) : 484-94.
DOI: 10.1016/j.molcel.2012.03.024. ( 0) 0)
|
| [6] |
Michan S, Sinclair D. Sirtuins in mammals: insights into their biological function[J].
Biochem J,2007, 404 (1) : 1-13.
DOI: 10.1042/BJ20070140. ( 0) 0)
|
| [7] |
Paraíso AF, Mendes KL, Santos SH. Brain activation of SIRT1: role in neuropathology[J].
Mol Neurobiol,2013, 48 (3) : 681-9.
DOI: 10.1007/s12035-013-8459-x. ( 0) 0)
|
| [8] |
Deng CX. SIRT1, is it a tumor promoter or tumor suppressor?[J].
Int J Biol Sci,2009, 5 (2) : 147-52.
( 0) 0)
|
| [9] |
Hall JA, Dominy JE, Lee Y, et al. The sirtuin family's role in aging and age-associated pathologies[J].
J Clin Invest,2013, 123 (3) : 973-9.
DOI: 10.1172/JCI64094. ( 0) 0)
|
| [10] |
Hirschey MD, Shimazu T, Huang JY, et al. SIRT3 regulates mitochondrial protein acetylation and intermediary metabolism[J].
Cold Spring Harb Symp Quant Biol,2011, 76 : 267-77.
DOI: 10.1101/sqb.2011.76.010850. ( 0) 0)
|
| [11] |
Giralt A, Villarroya F. SIRT3, a pivotal actor in mitochondrial functions: metabolism, cell death and aging[J].
Biochem J,2012, 444 (1) : 1-10.
DOI: 10.1042/BJ20120030. ( 0) 0)
|
| [12] |
Marfe G, Tafani M, Indelicato M, et al. Kaempferol induces apoptosis in two different cell lines via Akt inactivation, Bax and SIRT3 activation, and mitochondrial dysfunction[J].
J Cell Biochem,2009, 106 (4) : 643-50.
DOI: 10.1002/jcb.v106:4. ( 0) 0)
|
| [13] |
Jing E, Emanuelli B, Hirschey MD, et al. Sirtuin-3 (Sirt3) regulates skeletal muscle metabolism and insulin signaling via altered mitochondrial oxidation and reactive Oxygen species production[J].
Proc Natl Acad Sci USA,2011, 108 (35) : 14608-13.
DOI: 10.1073/pnas.1111308108. ( 0) 0)
|
| [14] |
Kim HS, Patel K, Muldoon-Jacobs K, et al. SIRT3 is a mitochondria-localized tumor suppressor required for maintenance of mitochondrial integrity and metabolism during stress[J].
Cancer Cell,2010, 17 (1) : 41-52.
DOI: 10.1016/j.ccr.2009.11.023. ( 0) 0)
|
| [15] |
Ashraf N, Zino S, Macintyre A, et al. Altered sirtuin expression is associated with node-positive breast cancer[J].
Br J Cancer,2006, 95 (8) : 1056-61.
DOI: 10.1038/sj.bjc.6603384. ( 0) 0)
|
| [16] |
Alhazzazi TY, Kamarajan P, Joo N, et al. Sirtuin-3 (SIRT3), a novel potential therapeutic target for oral cancer[J].
Cancer,2011, 117 (8) : 1670-8.
DOI: 10.1002/cncr.25676. ( 0) 0)
|
| [17] |
Zhao Y, Yang H, Wang X, et al. Sirtuin-3 (SIRT3) expression is associated with overall survival in esophageal cancer[J].
Ann Diagn Pathol,2013, 17 (6) : 483-5.
DOI: 10.1016/j.anndiagpath.2013.06.001. ( 0) 0)
|
| [18] |
Qiu X, Brown K, Hirschey MD, et al. Calorie restriction reduces oxidative stress by SIRT3-mediated SOD2 activation[J].
Cell Metab,2010, 12 (6) : 662-7.
DOI: 10.1016/j.cmet.2010.11.015. ( 0) 0)
|
| [19] |
Tao R, Coleman MC, Pennington JD, et al. Sirt3-mediated deacetylation of evolutionarily conserved lysine 122 regulates MnSOD activity in response to stress[J].
Mol Cell,2010, 40 (6) : 893-904.
DOI: 10.1016/j.molcel.2010.12.013. ( 0) 0)
|
| [20] |
Sundaresan NR, Samant SA, Pillai VB, et al. SIRT3 is a stress-responsive deacetylase in cardiomyocytes that protects cells from stress-mediated cell death by deacetylation of Ku70[J].
Mol Cell Biol,2008, 28 (20) : 6384-401.
DOI: 10.1128/MCB.00426-08. ( 0) 0)
|
| [21] |
Li S, Banck M, Mujtaba S, et al. p53-induced growth arrest is regulated by the mitochondrial SirT3 deacetylase[J].
PLoS One,2010, 5 (5) : e10486.
DOI: 10.1371/journal.pone.0010486. ( 0) 0)
|
| [22] |
Alhazzazi TY, Kamarajan P, Verdin E, et al. SIRT3 and cancer: Tumor promoter or suppressor?[J].
Biochim Biophys Acta,2011, 1816 (1) : 80-8.
( 0) 0)
|
| [23] |
Wang L, Wang WY, Cao LP. SIRT3 inhibits cell proliferation in human gastric cancer through down-regulation of Notch-1[J].
Int J Clin Exp Med,2015, 8 (4) : 5263-71.
( 0) 0)
|
| [24] |
Yang H, Zhou L, Shi Q, et al. SIRT3-dependent GOT2 acetylation status affects the malate-aspartate NADH shuttle activity and pancreatic tumor growth[J].
EMBO J,2015, 34 (8) : 1110-25.
DOI: 10.15252/embj.201591041. ( 0) 0)
|
| [25] |
Li H, Feng Z, Wu W, et al. SIRT3 regulates cell proliferation and apoptosis related to energy metabolism in non-small cell lung cancer cells through deacetylation of NMNAT2[J].
Int J Oncol,2013, 43 (5) : 1420-30.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
