2. 西安一四一医院皮肤科,陕西 西安 710089 ;
3. 西安市儿童医院皮肤科,陕西 西安 710003
2. Department of Dermatology, Xi'an 141 Hospital, Xi'an 710089, China ;
3. Department of Dermatology, Xi'an Children's Hospital, Xi'an 710003, China
日光照射是引起皮肤结构和功能老化改变的主要因素。日光中的紫外线(UV)目前被公认为是诱导光老化的重要因素[1-2],这已被大量临床实验研究充分证明。然而,流行病学数据和临床观察表明:红外线(IR)辐射不能被认为对人类皮肤完全无害[3]。红外线辐射与紫外线辐射相似,能够导致和加快皮肤光化性损伤的发生,如早衰和致癌作用[4]。以往研究发现近红外线(IR-A)辐射改变了人皮肤中HSF的基因转录[5]。这些基因大幅上调了HSF中基质金属蛋白酶-1(MMP-1)的表达,引起胶原纤维降解,最终导致皱纹形成[6]。近年来的研究表明,高剂量IR-A辐射会对人类皮肤产生病理影响,IR-A辐射引起皮肤发生氧化应激反应,引起线粒体活性氧和自由基的生成[7],启动不同的信号级联通路,破坏真皮细胞外基质结构蛋白,引发皮肤过早老化[8]。但目前国内外对红外线引起皮肤光老化的研究仍然较少,其分子机制仍处于未知阶段。因此,我们通过本研究进一步阐明红外线诱导皮肤光老化可能的形成机制,为预防皮肤光老化及开发新的防光老化产品提供新思路。
1 材料和方法 1.1 材料主要试剂:c-Jun抗体(Millipore, USA)、DMEM培养基及胎牛血清(HyClone, USA)、MTT(Thermo electron, USA)、Real time-PCR引物(北京奥科鼎盛生物科技有限公司)、Ⅰ,Ⅲ型胶原兔抗体及免疫组化染色试剂盒(武汉博士德生物科技有限公司)、Vimentin抗体(ImmunoWay, USA)、PrimeScript®; RT reagent Kit(Takara, 中国)。主要仪器:倒置及正置显微镜(OLYMPUS, Japan)、CO2培养箱(Heraeus, Germany)、高速冷冻离心机(Eppendorf, Germany)、红外线仪(重庆华伦弘历实业有限公司)、全波长酶标仪(Thermo electron, USA)Real time-PCR仪(ABI, USA)。
1.2 方法 1.2.1 人皮肤成纤维细胞培养取3名8~10岁的健康儿童的包皮组织,按照组织块贴壁法进行原代培养,培养成功后通过形态学观察、HE染色及免疫组化进行鉴定,并传代培养[9-10],第3~6代细胞用于实验。
1.2.2 实验分组(1)实验分组:实验组接受红外线照射,照射时间参考临床治疗时间(红外线仪,波长0.78~2.8 μm,功率100 W),红外线照射时间分别为10、20、30 min,细胞接受照射后继续培养12或24 h,分为6组,即为10 min~12 h组(红外线照射10 min后细胞继续培养12 h,其余组以此类推,红外线照射10、20、30 min相当于照射剂量为60 000、120 000、180 000 J),20 min~12 h组,30 min~12 h组;10 min~24 h组(红外线照射10 min后细胞继续培养24 h,其余组以此类推),20 min~24 h组,30 min~24 h组。对照组除无红外线照射外,其培养时间及条件与实验组相同;(2)样品制备:用胰酶消化对数生长期的HSF,用完全培养基调整细胞密度为1×105/孔HSF,接种于24或96孔板或培养瓶中,5% CO2的37 ℃培养箱中常规培养。待细胞长至80%左右融合时,分为对照组1个和实验组6个(包括10 min~12 h、20 min~12 h、30 min~12 h、10 min~24 h、20 min~24 h和30 min~24 h组),每次共7组,实验独立重复3次。将培养瓶或培养板置于距离红外线仪25 cm的平面进行照射,照射时间分别为10、20和30 min,照射结束后立即弃掉PBS加入完全培养基继续培养12 h或24 h后收集细胞备用。对照组除未给予红外线照射外,其余与实验组处理相同。
1.2.3 细胞增殖检测(MTT法)将上述7组96孔板细胞每孔中加入浓度为5 mg/mL的MTT 20 μL,放入含有5% CO2的37 ℃培养箱中继续培养4 h,终止培养,弃去培养板中每孔上清液后加入150 μL DMSO,震荡10 min,选择490 nm的波长,在酶标仪上测定每孔的吸光值(A值),按照下列公式计算细胞生长抑制率(%)=(实验组A值-对照组A值)/(对照组A值-空白组A值)×100%,细胞存活率=1-细胞生长抑制率(%),计算细胞的存活情况。
1.2.4 HE染色细胞爬片:将细胞悬液滴到铺有盖玻片的24孔板中,每孔中加入1 mL细胞悬液,放于37 ℃,5% CO2培养箱中培养,培养24 h后实验组按上述分组进行红外线照射,对照组不作处理。常规细胞固定后进行HE染色,显微镜下观察并取图。
1.2.5 免疫细胞化学(ICC)(1)细胞爬片及固定方法同HE染色;(2)c-Jun,Ⅰ型胶原、Ⅲ型胶原及Vimentin(波形蛋白)抗体一抗工作浓度分别为:1:200、1:50、1:100及1:100),阴性对照用PBS代替一抗。免疫组化操作按免疫组化染色试剂盒说明进行。
1.2.6 实时定量PCR(1)按照TaKaRa MiniBEST Universal RNA Extraction Kit试剂盒说明提取总RNA;(2)按照PrimeScript®; RT reagent Kit反转录试剂盒说明进行逆转录反应;(3)Real time-PCR过程根据GeneBank中c-Jun、Ⅰ型胶原(COL-1)和Ⅲ型胶原(COL-3)基因序列,以GAPDH为内参基因,设计、合成引物。c-Jun引物:上游引物5'-CCAAGAACTCGGAC CTCC-3',下游引物5'-GAAGCCCTCCTGCTCATC-3',长度167 bp;COL-1引物:上游引物5'-TGG AATGAAGGGACACAGAG-3',下游引物5'-CAG GGCGACCTCTCTCAC-3',长度155 bp;COL-3引物:上游引物5'-CCTGGTCCTCCTGGTAGT-3',下游引物5'-TCCCTTCTCTCCTGGTTG-3',长度159 bp;GAPDH引物:上游引物5'-CTCCTCCACCTTTGACGCTG-3',下游引物5'-TCCTCTTGTGCTCTTGCTGG-3',长度>175 bp。进行实时定量PCR反应,95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,共45个循环。每个标本的各个指标均做3个重复管,取平均Ct值,以管家基因GAPDH为内参基因,采用相对定量法,利用Ct值计算目的基因的相对表达含量,相对表达量=2-△△Ct。
1.2.7 统计分析采用SPSS 13.0软件进行统计分析,数据采用均数±标准差表达,计量资料用方差分析检验多组之间的显著性差异,P < 0.05认为差异有统计学意义。采用χ2分析方法对ICC结果进行比较,P < 0.05认为有统计学显著性差异。
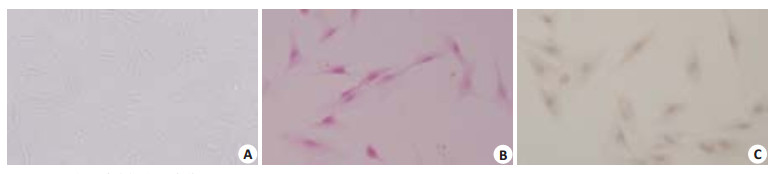
2 结果 2.1 原代人皮肤成纤维细胞的鉴定通过形态学、HE染色和波形蛋白免疫细胞化学染色3种方法,证明我们从人包皮中提取、分离和培养的是皮肤成纤维细胞(图 1)。
|
图 1 原代人皮肤成纤维细胞鉴定图 Figure 1 Primary culture of human skin fibroblasts. A: Phase-contrast microscopy (Original magnification: ×10); B: HE staining(×20); C: Immunocytochemistry for vimentin showing brown granules in the cytoplasm(×20). |
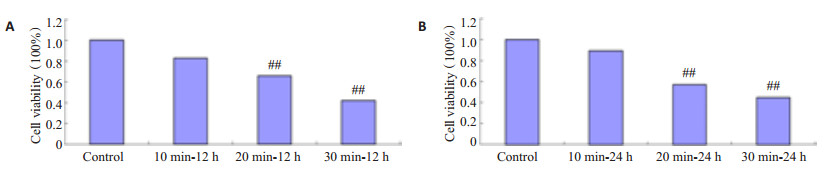
运用MTT的方法,观察IR照射对HSF增殖情况的影响(图 2)。MTT结果显示:(A)图中IR照射HSF后继续培养12 h测其A值,计算细胞存活率,随着IR照射剂量的增加细胞存活率越来越低,与正常组相比,10 min~12 h组HSF存活率无显著性差异(P < 0.05),而20 min~12 h和30 min~12 h组HSF存活率差异有显著性差异(P < 0.01);(B)图中IR照射HSF后继续培养24 h测其A值,计算细胞存活率,随着IR照射剂量的增加细胞存活率越来越低,与正常组相比,10 min~24 h组HSF存活率无显著性差异(P < 0.05),而20 min~24 h和30 min~24 h组HSF存活率差异有显著性差异(P < 0.01),以上结果表明:HSF的增殖能力随着IR照射剂量的增加逐渐减弱。
|
图 2 不同IR照射剂量照射HSF后12 h和24 h细胞存活率 Figure 2 Cell survival rate of HSFs exposed to different doses of IR irradiation for12 h(A) and24 h(B) (Mean±SD, n=6). ##P < 0.01 vs control group. |
c-Jun在细胞核表达,以细胞核出现棕黄色颗粒或呈棕黄色作为阳性细胞,Ⅰ、Ⅲ型胶原(COL-1、COL-3)在细胞质表达,以细胞胞质出现棕黄色颗粒或呈棕黄色作为阳性细胞。随机观察5个高倍视野,按照如下方法对ICC结果进行判断比较,细胞阳性着色程度:无色为0分,浅黄色(+)为1分,棕黄色(++)为2分,棕褐色(+++)为3分,染色强度需与背景着色相对比;依照阳性细胞数量:0分为阴性,1分为阳性细胞 < 25%,2分为25%~50%,3分为 > 50%。将上述两项得分相加得出评分结果:≤1分为阴性,2分为弱阳性(+),3~4分为阳性(++),≥5分为强阳性(+++),弱阳性及以上视为阳性表达,对结果进行卡方统计分析。
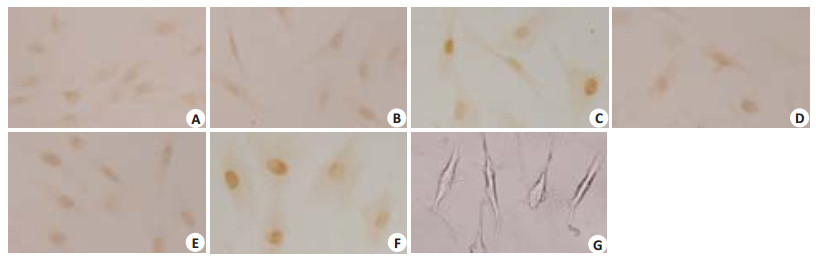
2.3.1 IR照射对人皮肤成纤维细胞中c-Jun表达的影响在正常情况下c-Jun不表达或低表达,当受到外界刺激后其表达会发生变化。c-Jun的ICC结果显示:HSF接受3种不同剂量的IR照射,在照射后12 h和24 h后c-Jun蛋白表达均有升高,照射20 min和30 min组与对照组相比,有显著性差异(P < 0.01),c-Jun蛋白表达随着IR照射剂量的增加逐渐升高(表 1,图 3)。
| 表 1 c-Jun在IR照射组和对照组的表达情况 Table 1 Expression of c-Jun in IR irradiation group and control group |
|
图 3 c-Jun在IR照射组和对照组的表达情况 Figure 3 Expression of c-Jun in the IR-irradiated cells and control cells(Original magnification: ×40). A: 10 min-12 h; B: 20 min-12 h; C: 30 min-12 h; D: 10 min-24 h; E: 20 min-24 h; F: 30 min-24 h; G: Control. |
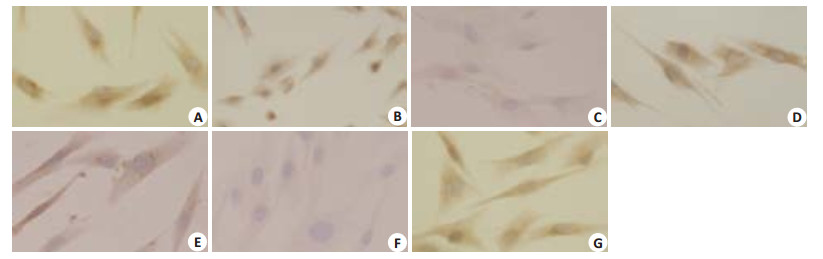
在正常情况下成纤维细胞能够表达Ⅰ型胶原(COL-1),当受到外界刺激后其表达会发生改变。COL-1的ICC结果显示:HSF接受3种不同剂量的IR照射,在照射后12 h和24 h后COL-1表达均有下降,照射20 min和30 min组与对照组相比,有显著性差异(P < 0.01),COL-1表达随着IR照射剂量的增加逐渐下降(表 2,图 4)。
| 表 2 COL-1在IR照射组和对照组的表达情况 Table 2 Expression of collagen I in IR-irradiated cells and control cells |
|
图 4 COL-1在IR照射组和对照组的表达情况 Figure 4 Expression of collagen I in IR-irradiated cells and control cells(Original magnification: ×40). A: 10 min-12 h; B: 20 min-12 h; C: 30 min-12 h; D: 10 min-24 h; E: 20 min-24 h; F: 30 min-24 h; G: Control. |
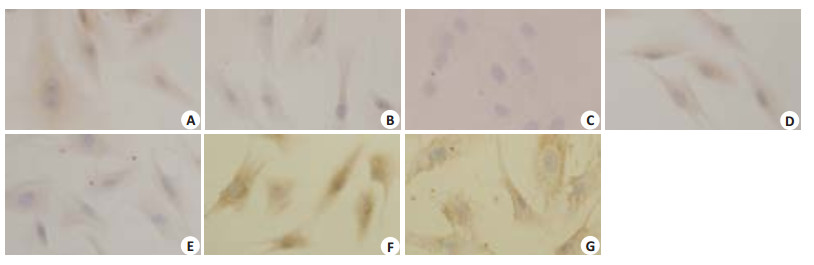
在正常情况下成纤维细胞能够表达Ⅲ型胶原(COL-3),当受到外界刺激后其表达发生改变。COL-3的ICC结果显示:HSF接受3种不同剂量的IR照射,在照射后12 h后COL-3表达均有下降,照射20 min和30 min组与对照组相比,有显著性差异(P < 0.05或P < 0.01),但在照射24 h后COL-3表达随着IR照射剂量的增加逐渐升高,与对照组相比,差异有统计学意义(P < 0.05,表 3,图 5)。
| 表 3 COL-3在IR照射组和对照组的表达情况 Table 3 Expression of collagen III in IR-irradiated cells and control cells |
|
图 5 COL-3在IR照射组和对照组的表达情况 Figure 5 Expression of collagen III in IR-irradiated cells and control cells(Original magnification: ×40). A: 10 min-12 h; B: 20 min-12 h; C: 30 min-12 h; D: 10 min-24 h; E: 20 min-24 h; F: 30 min-24 h; G: Control. |
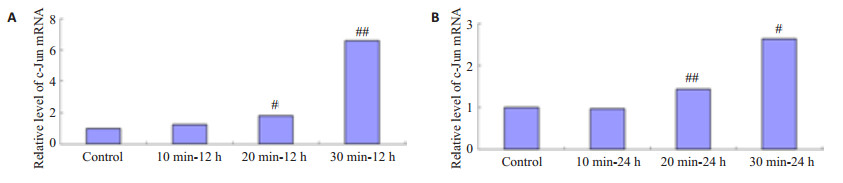
HSF接受3种不同剂量的IR照射,在照射后12 h和24 h后c-Jun mRNA均有升高,照射20 min和30 min组与对照组相比,有显著性差异(P < 0.05或P < 0.01),c-Jun mRNA表达随着IR照射剂量的增加逐渐增高,且IR照射后12 h HSF的c-Jun mRNA表达升高最明显(图 6)。
|
图 6 IR照射HSF后12 h和 24 h c-Jun mRNA的表达水平 Figure 6 c-Jun mRNA expression level in HSFs exposed to IR irradiation for12 h(A) and24 h(B) (Mean±SD, n=3). #P < 0.05 vs control group; ##P < 0.01 vs control group. |
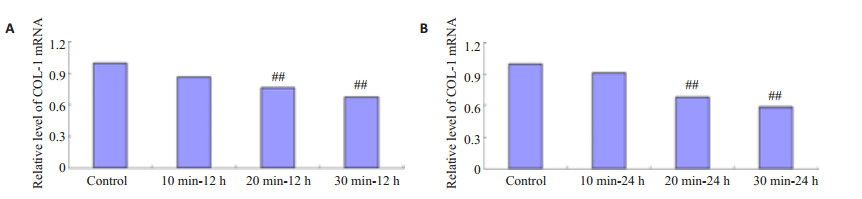
HSF接受3种不同剂量的IR照射,在照射后12 h和24 h后COL-1 mRNA均有下降,照射20 min和30 min组与对照组相比,有显著性差异(P < 0.01),COL-1 mRNA表达随着IR照射剂量的增加逐渐增高,且IR照射后24 h HSF的COL-1 mRNA表达降低最明显(图 7)。
|
图 7 IR照射HSF后12 h和24 h COL-1 mRNA的表达水平 Figure 7 Collagen I mRNA expression level in HSFs exposed to IR irradiation for 12 h(A) and 24 h(B) (Mean±SD, n=3). ##P < 0.01 vs control group. |
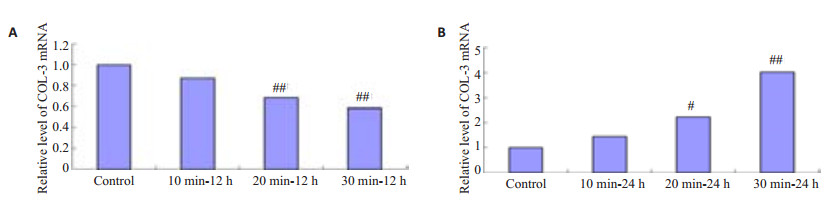
HSF接受3种不同剂量的IR照射,在照射后12 h后COL-3 mRNA均有下降,照射20 min和30 min组与对照组相比,有显著性差异(P < 0.01),而在IR照射后24 h后COL-3 mRNA表达随着照射剂量的增加逐渐上升,照射20 min和30 min组与对照组相比,有显著性差异(P < 0.05或P < 0.01,图 8)。
|
图 8 IR照射HSF后12 h和24 h COL-3 mRNA的表达水平 Figure 8 Collagen III mRNA expression level in HSFs exposed to IR irradiation for12 h(A) and24 h(B) (Mean±SD, n=3). #P < 0.05 vs control group; ##P < 0.01 vs control group. |
皮肤光老化表现为皮肤皱纹、下垂,松弛和色素沉着等。胶原蛋白和弹性蛋白维持皮肤的强度和弹性,它们的异常会引起明显的皮肤退行性改变,导致老化皮肤的出现[11-12]。皮肤光老化的形成不仅与UV辐射[13]有关,也与波长更长的IR辐射有关,IR破坏胶原蛋白代谢平衡,增加导致胶原蛋白降解的MMP-1的表达,并减少胶原蛋白本身的从头合成[14]。
IR产生热,增加受阳光照射皮肤的温度。Cho[15]发现,IR产生的热能引起热休克,增加人体MMP-1、MMP-3和MMP-9 mRNA和蛋白的表达水平,并快速激活MAPKs信号通路,引起I型胶原降解。Lan[16]发现热可增加真皮成纤维细胞中MMP-1和MMP-3 mRNA的表达,降低抗氧化酶活性,导致结缔组织降解。Schroeder[5]发现IR诱导MMP-1表达上调,而MMP-1的抑制剂TIMP-1表达并没有增加,从而导致胶原蛋白的降解。而长期IR照射无毛小鼠诱发皱纹形成,并增强UV诱导的无毛小鼠皱纹形成和皮肤增厚。IR治疗增加UV诱导的真皮胶原蛋白和弹性纤维降解[17]。从这些结果,证明IR可单独诱发皮肤皱纹形成,也可增强UV诱导的皱纹形成。
我们的研究结果表明,IR照射成纤维细胞导致Ⅰ型胶原mRNA和蛋白表达水平下降,并随着IR照射剂量的增加下降越明显,在IR照射后12 h和24 h这两个时间点的Ⅰ型胶原的表达逐渐下降,而在照射剂量为30 min的24 h这个时间点Ⅰ型胶原的表达下降最明显。Schroeder[18]研究发现IR辐射抑制Ⅰ型胶原合成,这与我们的研究结果是一致的,而Kim[19]却发现,IR刺激成纤维细胞合成Ⅰ型胶原蛋白和弹性蛋白,有益于改善皮肤的纹理和皱纹,可以用来治疗皮肤光老化,这可能与活体细胞和培养细胞对IR的吸收能力不同有关,主要可能与选用的IR波长及照射时间不同有关,本实验所用红外线仪波长为0.78~2.8 μm,接近日光中的红外线波长,有利于模拟日常生活中人体接收到的红外线照射,更真实的反应日光中的红外线对人体皮肤成纤维细胞的作用。
本研究发现,在IR照射成纤维细胞后12 h,Ⅲ型胶原mRNA和蛋白表达水平下降,并随着IR照射剂量的增加下降越明显,有趣的是,在24 h后Ⅲ型胶原mRNA和蛋白表达水平却出现升高,IR照射剂量越大升高越明显,这可能由于IR照射成纤维细胞引起炎症反应,导致Ⅲ型胶原合成增高。Ⅲ型胶原是幼稚、纤细的胶原纤维,Ⅰ型胶原合成减少,Ⅲ型胶原表达增加,二者比例失调[20],最终引起成熟的胶原纤维形成减少,导致皮肤出现松弛和皱纹等光老化外观。
在UV辐射对人皮肤影响的研究中,有证据表明,I型前胶原表达主要受转录过程调节,AP-1,是c-Jun和c-fos组成的蛋白质,负性调节I型前胶原基因转录[21]。UV辐照迅速上调人体皮肤内AP-1的表达,AP-1的增高主要表现为c-Jun表达的增加。在UV照射人体皮肤后24 h内c-Jun最大限度地提高,这种c-Jun持续性增高与观察到的前胶原基因表达持续性降低是一致的,Quan等[22]研究发现c-Jun对UV辐射原代人皮肤成纤维细胞中Ⅰ型前胶原基因表达起抑制作用。Wang和Park等[23-24]发现UV辐射诱导皮肤成纤维细胞中c-Jun快速表达,抑制内源性Ⅰ型和Ⅲ型前胶原基因表达,UV上调c-Jun表达和抑制Ⅰ、Ⅲ型前胶原表达的趋势是一致的。
我们研究发现IR与UV类似,IR照射成纤维细胞后c-Jun蛋白和mRNA表达均有升高,并随着IR照射剂量增加升高越明显,在IR照射后12 h和24 h这两个时间点c-Jun mRNA表达均有升高趋势,而在IR照射后12 h中c-Jun mRNA表达的增高最明显,其中30 min~12 h的c-Jun mRNA表达量是正常组的7倍,该结果与Kim[9]的动物实验结果有类似之处。本实验中,IR诱导c-Jun增高的趋势和Ⅰ型胶原降低的趋势一致,推测IR可能通过诱导c-Jun表达,抑制Ⅰ型胶原表达来促进皮肤光老化的发生。IR照射后Ⅲ型胶原表达先降低后又升高,而与c-Jun表达增高的趋势不同,Ⅲ型胶原表达先降低可能c-Jun表达增高有关,Ⅲ型胶原表达又升高可能与IR照射成纤维细胞后引起炎症反应有关。
综上所述,IR照射人皮肤成纤维细胞可能通过诱导c-Jun表达,抑制Ⅰ型胶原,扰乱Ⅲ型胶原,导致I型胶原和Ⅲ型胶原比例失调,引起皮肤光老化的发生。但IR引起皮肤光老化的具体分子机制,信号通路及上下游转录因子的调控机制,还有待进一步去研究发现。
| [1] |
Chen B, Li R, Yan N, et al. Astragaloside IV controls collagen reduction in photoaging skin by improving transforming growth factor-β/Smad signaling suppression and inhibiting matrix metalloproteinase-1[J].
Mol Med Rep,2015, 11 (5) : 3344-8.
( 0) 0)
|
| [2] |
Murakami H, Shimbo K, Inoue Y, et al. Importance of amino acid composition to improve skin collagen protein synthesis rates in UV-irradiated mice[J].
Amino Acids,2012, 42 (6) : 2481-9.
DOI: 10.1007/s00726-011-1059-z. ( 0) 0)
|
| [3] |
Sklar LR, Almutawa F, Lim HW, et al. Effects of ultraviolet radiation, visible light, and infrared radiation on erythema and pigmentation: a review[J].
Photochem Photobiol Sci,2013, 12 (1) : 54-64.
DOI: 10.1039/C2PP25152C. ( 0) 0)
|
| [4] |
Schroeder P, Calles C, Benesova T, et al. Photoprotection beyond ultraviolet radiation-effective sun protection has to include protection against infrared A radiation-induced skin damage[J].
Skin Pharmacol Physiol,2010, 23 (1) : 15-7.
DOI: 10.1159/000257259. ( 0) 0)
|
| [5] |
Schroeder P, Lademann J, Darvin ME, et al. Infrared radiation-induced matrix metalloproteinase in human skin: implications for protection[J].
J Invest Dermatol,2008, 128 (10) : 2491-7.
DOI: 10.1038/jid.2008.116. ( 0) 0)
|
| [6] |
Kim MS, Kim YK, Cho KH, et al. Regulation of type I procollagen and MMP-1 expression after single or repeated exposure to infrared radiation in human skin[J].
Mech Ageing Dev,2006, 127 (12) : 875-82.
DOI: 10.1016/j.mad.2006.09.007. ( 0) 0)
|
| [7] |
Darvin ME, Haag SF, Lademann J, et al. Formation of free radicals in human skin during irradiation with infrared light[J].
J Invest Dermatol,2010, 130 (2) : 629-31.
DOI: 10.1038/jid.2009.283. ( 0) 0)
|
| [8] |
Akhalaya MY, Maksimov GV, Rubin AB, et al. Molecular action mechanisms of solar infrared radiation and heat on human skin[J].
Ageing Res Rev,2014, 16 (14) : 1-11.
( 0) 0)
|
| [9] |
陈健霞, 荣新洲, 樊桂成, 等. 不同浓度腐胺对人皮肤成纤维细胞增殖、迁移和凋亡的影响[J].
南方医科大学学报,2015, 35 (5) : 758-62.
( 0) 0)
|
| [10] |
张亮平, 王洋, 雷睿, 等. 核因子I-C降低皮肤成纤维细胞对TGF-β的敏感性[J].
南方医科大学学报,2015, 35 (9) : 1245-50.
( 0) 0)
|
| [11] |
Chung JH, Eun HC. Angiogenesis in skin aging and photoaging[J].
J Dermatol,2007, 34 (9) : 593-600.
DOI: 10.1111/jde.2007.34.issue-9. ( 0) 0)
|
| [12] |
Diekmann J, Alili L, Scholz O, et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin[J].
Exp Dermatol,2016, 25 (1) : 56-61.
DOI: 10.1111/exd.2016.25.issue-1. ( 0) 0)
|
| [13] |
Hsu WL, Lu JH, Noda M, et al. Derinat protects skin against Ultraviolet-B (UVB)-Induced cellular damage[J].
Molecules,2015, 20 (11) : 20297-311.
DOI: 10.3390/molecules201119693. ( 0) 0)
|
| [14] |
Zegarska B, Jó?wicki W, Zegarski W, et al. Histopathological lesions in different types of skin aging[J].
Acta Dermatovenerol Alp Panonica Adriat,2010, 19 (2) : 17-21.
( 0) 0)
|
| [15] |
Cho S, Lee MJ, Kim MS, et al. Infrared plus visible light and heat from natural sunlight participate in the expression of MMPs and type I procollagen as well as infiltration of inflammatory cell in human skin in vivo[J].
J Dermatol Sci,2008, 50 (2) : 123-33.
DOI: 10.1016/j.jdermsci.2007.11.009. ( 0) 0)
|
| [16] |
Lan CC, Wu CS, Yu HS. Solar-simulated radiation and heat treatment induced metalloproteinase-1 expression in cultured dermal fibroblasts via distinct pathways: implications on reduction of sun-associated aging[J].
J Dermatol Sci,2013, 72 (3) : 290-5.
DOI: 10.1016/j.jdermsci.2013.07.015. ( 0) 0)
|
| [17] |
Kim HH, Lee MJ, Lee SR, et al. Augmentation of UV-induced skin wrinkling by infrared irradiation in hairless mice[J].
Mech Ageing Dev,2005, 126 (11) : 1170-7.
DOI: 10.1016/j.mad.2005.06.003. ( 0) 0)
|
| [18] |
Schroeder P, Calles C, Krutmann J. Prevention of infrared-A radiation mediated detrimental effects in human skin[J].
Skin Therapy Lett,2009, 14 (5) : 4-5.
( 0) 0)
|
| [19] |
Kim JE, Chang S, Won CH, et al. Combination treatment using bipolar radiofrequency-based intense pulsed light, infrared light and diode laser enhanced clinical effectiveness and histological dermal remodeling in Asian photoaged skin[J].
Dermatol Surg,2012, 38 (1) : 68-76.
DOI: 10.1111/j.1524-4725.2011.02149.x. ( 0) 0)
|
| [20] |
Nguyen TT, Eklouh-Molinier C, Sebiskveradze D, et al. Changes of skin collagen orientation associated with chronological aging as probed by polarized-FTIR micro-imaging[J].
Analyst,2014, 139 (10) : 2482-8.
DOI: 10.1039/c3an00353a. ( 0) 0)
|
| [21] |
Bae JY, Lim SS, Kim SJ, et al. Bog blueberry anthocyanins alleviate photoaging in ultraviolet-B irradiation-induced human dermal fibroblasts[J].
Mol Nutr Food Res,2009, 53 (6) : 726-38.
DOI: 10.1002/mnfr.v53:6. ( 0) 0)
|
| [22] |
Quan T, Qin Z, Xu Y, et al. Ultraviolet irradiation induces CYR61/ CCN1, a mediator of collagen homeostasis, through activation of transcription factor AP-1 in human skin fibroblasts[J].
J Invest Dermatol,2010, 130 (6) : 1697-706.
DOI: 10.1038/jid.2010.29. ( 0) 0)
|
| [23] |
Wang Y, Chen H, Wang W, et al. N-terminal 5-mer peptide analog P165 of amyloid precursor protein inhibits UVA-induced MMP-1 expression by suppressing the MAPK pathway in human dermal fibroblasts[J].
Eur J Pharmacol,2014, 734 : 1-8.
DOI: 10.1016/j.ejphar.2014.03.028. ( 0) 0)
|
| [24] |
Park JE, Pyun HB, Woo SW, et al. The protective effect of Kaempferia parviflora extract on UVB-induced skin photoaging in hairless mice[J].
Photodermatol Photoimmunol Photomed,2014, 30 (5) : 237-45.
DOI: 10.1111/phpp.2014.30.issue-5. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
