2. 海南医学院附属医院呼吸内科,海南 海口 570102
2. Department of Respiratory Medicine, Affiliated Hospital of Hainan Medical University, Haikou 570102, China
Toll样受体(TLR)是人体对抗外界细菌、病毒等侵入呼吸道天然免疫中的关键受体。其中,TLR4是第一个被发现的哺乳动物TLR,并广泛表达于气道上皮,在呼吸道粘膜免疫中作用突出[1]。微小RNA(miRNAs)是一类高度保守、长度在约20~24 nt的短小非编码调控单链RNA。其作用系通过与mRNA的3’-UTR端互补配对导致目标mRNA降解或抑制转录后翻译而导致靶基因沉默或表达下调。由于miR-155,miR-21,miR-164在诸多器官以及组织中被证实与TLR信号通路的调节相关,因此国外有学者将其称为“ 免疫敏感性microRNA”[2]。冷空气刺激为临床上慢性阻塞性肺疾病急性加重,支气管哮喘急性发作以及呼吸道感染等诸多疾病的重要诱因。同时,冷诱导下呼吸道内γ-干扰素(IFN-γ)基础水平的下调,是后续呼吸道病毒感染的始发诱因[3-4]。国外一些学者关注温度改变对哺乳动物细胞中microRNA表达量的影响,并在CHO-K1细胞系中证实了一些受温度影响的microRNA[5],miR-21即为该研究中所发现的冷敏感性microRNA之一。冷空气诱导气道免疫功能下降为重要而常见的临床现象,但目前对于其中详细的机制仍缺乏系统性的阐述,因此深入研究并完善呼吸道冷空气暴露引起气道粘膜屏障受损的分子机制具有重要的临床意义。为此,我们模拟冷空气暴露环境,通过体外试验研究冷刺激对气道上皮细胞TLR-4的影响,并进一步深入探讨冷敏感性micrRNA:miR-21在其中的介导作用。
1 材料和方法 1.1 细胞株与试剂材料人永生化气道上皮细胞株BEAS-2B(美国ATCC全球生物资源中心),人永生化支气管上皮细胞16HBE(本实验室冻存),10%胎牛血清(美国Sigma),DMEM培养液(美国Hyclone),双荧光素报告检测试剂盒(Dual-Luciferase ReporterAssay System)(美国Promega),All-in-One microRNA qPCR 检测试剂盒(美国GeneCopoeia),miR-155、miR-21、miR-164以及内参U6反转录、定量PCR引物均由上海吉凯基因化学技术有限公司合成,miR-21模拟物及阴性对照、miR-21抑制物及阴性对照均购自上海吉玛生物技术公司,研究中使用的一抗(兔抗人TLR-4 多克隆抗体ab13556,兔抗人MyD88 多克隆抗体ab2064)购自美国Abcam,二抗HRP标记山羊抗兔IgG以及内参兔抗人β-actin多克隆抗体均购自北京中杉金桥科技有限公司。
1.2 细胞培养于50 mL玻璃培养瓶中分别传代培养人气道上皮细胞株BEAS-2B及人支气管上皮细胞16HBE,加入含10%的胎牛血清的DMEM培养液,置于5% CO2,37 ℃细胞培养箱中培养,隔天换液,铺满瓶底80%时传代。于细胞对数生长期时调整细胞密度,种植于millicell上室,下室加入含有10% FBS的DMEM培养液,构建气-液双相培养的细胞生长环境。
1.3 实验分组与处理常温培养组的细胞在37 ℃,5% CO2下培养,低温培养组的细胞置于30 ℃,5% CO2下培养[6-7]。(1)冷刺激梯度试验:BEAS-2B细胞及16HBE细胞分别随机分为常温培养、低温刺激2、4、8、16、32 h的时间梯度;(2)双荧光素酶标记试验验证TLR-4 为miR-21 的直接靶基因:野生型TLR-4 组(BEAS-2B或16HBE细胞转染含野生型TLR-4 3’UTR 端序列的荧光素酶报告载体pMir-Glo-WTTLR-4);突变体TLR-4 组(BEAS-2B 或16HBE细胞转染含突变型TLR-4 3’UTR端序列的荧光素酶报告载体pMir-Glo-MutTLR-4);野生型TLR-4+miR-21 模拟物组;野生型TLR-4+miR-21 模拟物对照物组;突变型TLR-4+miR-21模拟物组;突变型TLR-4+miR-21模拟物对照物组;(3)证实低温刺激可下调气道上皮TLR-4/MyD88免疫信号通路:①常温培养组;②低温培养组;③miR-21模拟物常温组(常温培养BEAS-2B或16HBE细胞转染miR-21模拟物);④miR-21抑制物常温组(常温培养BEAS-2B或16HBE细胞转染miR-21抑制物);⑤miR-21 模拟对照物常温组(常温培养BEAS-2B或16HBE细胞转染miR-21模拟对照物);⑥miR-21抑制物低温组(低温培养BEAS-2B或16HBE细胞转染miR-21 抑制物);⑦miR-21 抑制对照物低温组(低温培养BEAS-2B或16HBE细胞转染miR-21 抑制对照物)。每实验组均设置5个复孔(n=5)用于统计学分析,重复3次试验。
1.4 细胞转染转染所使用miR-21 模拟物、模拟物对照、miR-21抑制物和抑制物对照由上海吉玛生物技术有限公司合成。BEAS-2B或16HBE细胞转染前加入无双抗无血清的DMEM培养液培养24 h 后备转染。取去酶灭菌EP管A加入1.5 μL寡聚物使用DMEM稀释至50 μL;取去酶灭菌EP 管B加入lipofectamine2000 1.5 μL 用DMEM稀释至50 μL。混匀AB管,室温下孵育20 min。细胞弃培养基,无双抗无血清的DMEM培养液洗3次,将100 μL转染试剂加至细胞中,置培养箱中培养18 h后换正常培养基。
1.5 双荧光素酶标记试验含野生型TLR-4 3’UTR端序列的荧光素酶报告载体pMir-Glo-WTTLR-4 以及miR-21 结合位点突变的pMir-Glo-MutTLR-4表达质粒由上海吉玛生物技术有限公司合成。以表达海肾荧光素酶的载体pRL-TK作为内参对照。将miR-21模拟物、模拟物对照分别与荧光素酶报告载体共转染入BEAS-2B或16HBE细胞中,采用Promega 公司的Dual-Lucifersae Reporter AssaySystem(E1910)进行样品Lucifersae活性检测。
1.6 RNA的提取以及逆转录实时定量PCR(RT-qRCR)测定各组细胞miRNA的表达情况按细胞总RNA提取试剂盒Trizol说明,提取各实验组细胞的总RNA,紫外分光广度仪测定A260/A280在1.8~2.0之间。取2 μg总RNA按All-in-One microRNAqPCR试剂盒说明进行反转录。反应条件如下:37 ℃ 1 h,85 ℃ 5 min。所得cDNA用双蒸水稀释5倍后用于后续检测,剩余部分冻存-20 ℃待用。按All-in-OnemiRNA qRT-PCR试剂盒说明,取2 μL cDNA进行qPCR,检测各标本miR-155、miR-21、miR-164的表达情况,反应条件如下:95 ℃ 10 min,95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,第2步至3步骤循环40次。设置U6为内参计算相对表达量。相对表达量计算公式=2-ΔΔCT,ΔCT=CT(miR)-CT(U6),ΔΔCT=ΔCT(实验组)-ΔCT(对照组)。
1.7 Western Blot法检测各组细胞TLR-4、MyD88蛋白水平PBS洗涤去培养液细胞,使用预冷的改良RIPA裂解液(含蛋白酶抑制剂)冰上裂解细胞30 min,10 000 g,4 ℃离心10 min。转移上清液,加入5×上样缓冲液煮沸10 min。BCA 法标化各实验组蛋白。按碧云天SDS-PAGE制胶试剂盒说明,制备10%的分离胶和浓缩胶,加样行聚丙酰胺凝胶电泳,切胶,250 mA恒流电转至PVDF膜(TLR-4 100 min,MyD88 40 min),封闭后用相应一抗孵育过夜(1∶1000,内参为1∶300),TBST洗膜3次后。按1∶2000加入二抗羊抗兔IgG孵育2 h,洗膜后用增敏化学发光法鉴定,拍照分析。
1.8 统计学分析运用SPSS 13.0统计学软件对数据进行统计学分析,结果采用均数±标准差表示。多组数据间差异分析采用多组间单因素方差分析,多组样本之间比较采用SNK-q检验;两组间单因素分析采用t检验。以P<0.05为差异具有统计学意义。
2 结果 2.1 冷刺激的细胞活性检测使用MTT法检测1~32 h冷刺激的细胞活性,以确定适宜刺激时间。每个冷刺激时间组细胞均以相应时间常规培养(37 ℃)为对照,计算相对存活率。研究表明,给予冷刺激2~16 h细胞活性较常规培养均无显著差异(P>0.05);延长冷刺激至32 h,BEAS-2B 细胞(0.82±0.09)以及16HBE细胞活性(0.73±0.13)较对应常规培养BEAS-2B(1.0±0.08)及16HBE(1.0±0.11)组降低(均P<0.05)。兼顾最大冷暴露以及细胞活性,故后续试验给予16 h的冷暴露。
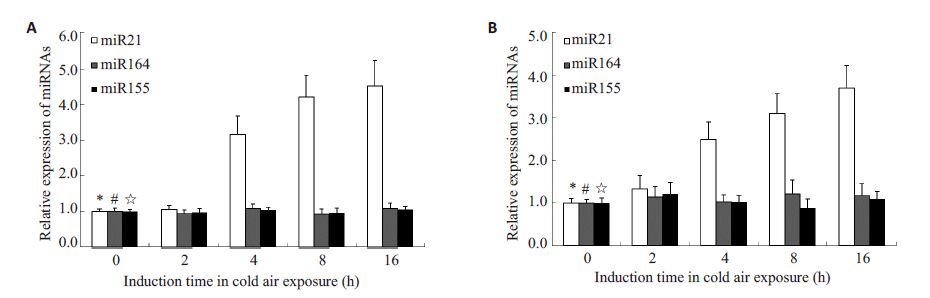
2.2 RT-qPCR法检测冷刺激对细胞miRNA表达的影响采用30 ℃恒温气-液双相培养BEAS-2B及16HBE细胞株,并设置常规培养(37 ℃)为对照。数据显示,低温刺激2 h 后BEAS-2B及16HBE细胞内miR-21 水平逐渐升高,在刺激16 h分别为各自对照组的4.53±0.71、3.69±0.53倍。而miR-164及miR-155水平在低温刺激下无明显改变(P均>0.05,图 1)。
|
图 1 各组microRNA相对表达水平 Figure 1 Relative expression levels of microRNAs in deferent groups. A: BEAS-2B cells; B: 16HBE cells. The relative expression levels of miR-21 at 4, 8, and 16 h were significantly different from that at 0 h (*P<0.05). The relative expression levels of miR-164 showed no such time-dependent variations (#P>0.05), nor did the expression levels of miR-155 (☆P>0.05). n=5. |
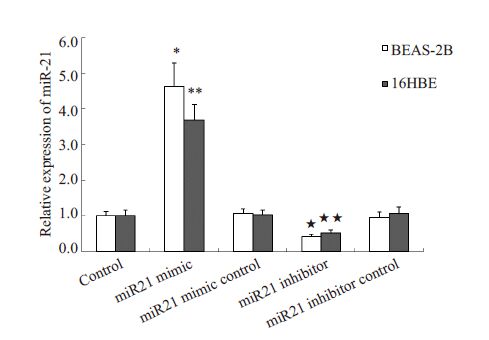
通过查询miRNA数据库http://www.microrna.org/microrna 获悉,TLR-4 可能为miR-21 的靶基因。通过对结合位点进行突变(图 2)并将其插入到荧光报告载体中,成功构建了野生型以及3’UTR端突变型TLR-4报告质粒。预先,我们以miR-21 模拟物、miR-21 模拟对照物,miR-21 抑制物、miR-21 抑制对照物转染BEAS-2B以及16HBE细胞,RT-qPCR分别检测miR-21表达量。结果提示miR-21 模拟物可显著提升BEAS-2B以及16HBE细胞内miR-21水平,而miR-21抑制物可部分抑制内源性miR-21的表达(图 3)。

|
图 2 miR-21和TLR-4 3’UTR的结合位点及突变位点序列 Figure 2 Sequences of 3’UTR in TLR-4 binding with miR-21. |
|
图 3 RT-qPCR法检测各组细胞内miR-21表达水平 Figure 3 Expression level of miR-21 in each group. *P<0.05, ★P<0.05, BEAS-2B cells vs control group. **P<0.05, ★ ★ P<0.05 16HBE cells vs control group. |
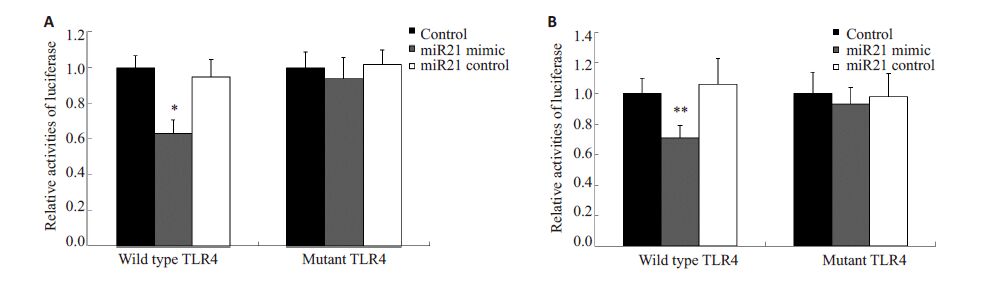
miR-21 模拟物与野生型TLR-4 共转染的BEAS-2B以及16HBE细胞荧光素酶活性明显下降(P均<0.05),而突变型与miR-21 模拟物共转染的BEAS-2B或16HBE细胞荧光素酶活性未见明显变化(P均>0.05,图 4)。这表明,miR-21可以直接靶向TLR-4。
|
图 4 双荧光素酶报告基因检测TLR-4为miR-21的靶基因 Figure 4 Dual luciferase reporter assay demonstrating the direct binding of TLR-4 and miR-21. A: In BEAS-2B cells, the relative activities of luciferase in cells transfected with wild-type TLR-4 and miR21 mimic were significantly different from those in cells transfected with wild-type TLR-4 (*P<0.05); B: In 16HBE cells, luciferase activities differed significantly between cells transfected with wild-type TLR-4 and miR21 mimic and those transfected with wild-type TLR-4 (**P<0.05). |
各实验组采用Western Blot法检测TLR-4/MyD88信号蛋白的表达水平。以常温培养组细胞作为对照,低温刺激(30 ℃,16 h)可下调BEAS-2B 以及16HBE 细胞中的TLR-4 水平(分别为各自对照组的0.69±0.08、0.73±0.10),同时降低MyD88 蛋白的水平(分别为各自对照组的0.72±0.07、0.62±0.08);转染miR-21 模拟物的BEAS-2B细胞在常温培养中出现了TLR-4(0.63±0.08)以及MyD88(0.66±0.06)水平的下调;同样,转染miR-21 模拟物的16HBE 细胞在常温培养中亦出现了TLR-4(0.70 ± 0.09)以及MyD88(0.67±0.07)水平的下调。而转染miR-21 抑制物的BEAS-2B 或16HBE 细胞在低温培养下,TLR-4(BEAS-2B 0.87±0.09,16HBE 0.91±0.10)以及MyD88(BEAS-2B 0.81±0.09,16HBE 0.85±0.12)水平高于低温培养下的野生型细胞(P<0.05,图 5)。

|
图 5 Western Blot法检测各实验组TLR-4以及MyD88的水平 Figure 5 Synthesis levels of TLR-4/MyD88 protein detected by Western blotting. L1: Cells cultured at 37 ℃; L2: Cells cultured at 30 ℃; L3: Cells transfected with miR-21 mimic and cultured at 37 ℃ ; L4: Cells transfected with miR-21 inhibitor and cultured at 37 ℃; L5: Cells transfected with miR-21 control and cultured at 37 ℃ ; L6: Cells transfected with miR-21 inhibitor and cultured at 30 ℃ ; L7: Cells transfected with miR-21 inhibitor control and cultured at 30 ℃. |
冷空气刺激为呼吸道疾病的重要始发诱因,受凉后诱发的呼吸道感染,是临床工作中常见的病理现象。国外一些学者通过建立动物模型,监测冷空气刺激后气道内温度变化。研究显示,当实验动物吸入4 ℃冷空气时,气道温度大致在30 ℃[6-7]。考虑到哺乳动物的呼吸道对冷空气的生理代偿作用,故本研究使用气-液双相培养气道上皮细胞系,30 ℃作为低温模拟刺激,使之更贴近生理状态下冷空气暴露的气道内环境。
TLR-4为气道上皮细胞以及肺泡巨噬细胞中重要的免疫受体,可识别一系列病原体相关分子模体(PAMP),例如脂多糖、呼吸道合胞病毒、支原体、衣原体等,通过TLR-4/MyD88 依赖的信号链,激活NF-κB或MAPK启动相应的免疫防御反应[8-9]。基础表达水平的TLR-4维系着良好的气道粘膜天然免疫屏障功能,研究提示TLR-4不仅为呼吸道病毒感染后,免疫细胞分化成熟的重要调节因子,同时也是一些下呼吸道定植菌,例如铜绿假单胞菌、鲍曼不动杆菌的重要感受器。国外不少研究者认为TLR-4与LPS结合所释放的炎症因子的降低可直接评估为免疫功能的降低[10],故可认为TLR-4是气道上皮免疫屏障的“门户分子”[11-12]。本研究发现,30 ℃低温可诱导气道上皮细胞中TLR-4 以及MyD88蛋白水平的下降,这种气道上皮免疫屏障分子的的缺乏可能为冷诱导激发呼吸道病毒感染、定植的前提。临床工作中,下呼吸道G-定植菌感染是COPD、支气管扩张等慢性气道炎症疾病急性加重的重要因素[13],TLR-4作为LPS的重要受体,其基础水平维系着此类疾病缓解期的下呼吸道微生态平稳。本研究结果显示低温诱导气道上皮细胞中TLR-4/MyD88基础水平下降,这可能为冷空气诱导上述气道慢性炎症性疾病急性加重的重要上游分子机制。
miR-21是近年来国内外研究较多的microRNA之一,在呼吸道相关疾病中,特发性肺纤维化(IPF)患者血miR-21水平升高,并且miR-21升高程度与FVC下降及IPF的影像学分型相关[14]。本研究通过比对microRNA在线数据库http://www.microrna.org/microrna 发现TLR-4 可能为miR-21 的靶基因,通过构建含TLR-43’-UTR端和预测结合位点突变的报告质粒,并进行双荧光素酶标记试验,在人气道上皮细胞系中证实了miR-21为TLR-4的直接靶向microRNA,该结果进一步佐证了国外学者关于miR-21 为TLR相关信号通路重要调节因子的发现,并可从另一方面解释国外学者报道的miR-21前体预处理后部分抑制LPS对细胞内NF-κB活化的现象[15]。有国外学者在CHO-K1细胞系中研究低温刺激对microRNA表达谱的影响,总结了一系列在低温诱导下表达量变化的microRNA。这些microRNA对低温刺激较为敏感,31 ℃环境中即能诱发其表达量的改变[5],本研究的焦点miR-21 即为其中之一。研究中,我们检测了目前国内外有报道的TLR相关信号通路的主要调节microRNA(miR-21、miR-164及miR-155),结果显示在气道上皮细胞中低温刺激可诱导miR-21表达量上调,并呈时间依赖性,在30 ℃、4 h刺激时miR-21表达量显著增高,16 h约为常温对照的4.53倍。而其余两种TLR信号链调节因子miR-164及miR-155均对冷诱导不敏感。本研究进一步通过设计miR-21模拟物、miR-21抑制物及其对照,证实了低温刺激可通过上调气道上皮细胞内源性miR-21的表达水平,于转录后层面下调气道上皮TLR-4蛋白的基础水平,进而降低抗病毒蛋白-MyD88[16]水平;转染miR-21抑制物可部分抑制冷诱导的TLR-4/MyD88蛋白分子下调,表明miR-21在冷诱导气道上皮TLR-4/MyD88 下调过程中的重要意义。本研究通过体外细胞实验,从气道粘膜固有免疫的分子学层面,microRNA定向调节视角,解析了冷诱导气道上皮免疫功能下降的分子机制,从分子学水平为临床干预冷敏气道提供新的思路。
| [1] | John G, Yildirim AO, Rubin BK, et al. TLR-4-mediated innate immunity is reduced in cystic fibrosis airway cells[J]. Am J Respir Cell Mol Biol, 2010, 42 (4): 424-31. DOI: 10.1165/rcmb.2008-0408OC. |
| [2] | Quinn SR, O'neill LA. A trio of microRNAs that control Toll-like receptor signalling[J]. Int Immunol, 2011, 23 (7): 421-5. DOI: 10.1093/intimm/dxr034. |
| [3] | Meng H, Lee Y, Ba Z, et al. In vitro production of IL-6 and IFN-γ is influenced by dietary variables and predicts upper respiratory tract infection incidence and severity respectively in young adults[J]. Front Immunol, 2015, 6 (9): 94. |
| [4] | Eccles R, Wilkinson JE. Exposure to cold and acute upper respiratory tract infection[J]. Rhinology, 2015, 53 (2): 99-106. |
| [5] | Gammell P, Barron N, Kumar N, et al. Initial identification of low temperature and culture stage induction of miRNA expression in suspension CHO-K1 cells[J]. J Biotechnol, 2007, 130 (3): 213-8. DOI: 10.1016/j.jbiotec.2007.04.020. |
| [6] | Hayama N, Kondo T, Kobayashi I, et al. Dynamic analysis of airway temperature in dogs breathing cold air[J]. Nihon Kokyuki Gakkai Zasshi, 2002, 40 (9): 738-43. |
| [7] | Bolger C, Tufvesson E, Anderson SD, et al. Effect of inspired air conditions on exercise-induced bronchoconstriction and urinary CC16 levels in athletes[J]. J Appl Physiol(1985), 2011, 111 (4): 1059-65. DOI: 10.1152/japplphysiol.00113.2011. |
| [8] | Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors[J]. Nat Immunol, 2010, 11 (5): 373-84. DOI: 10.1038/ni.1863. |
| [9] | Medzhitov R, Preston-Hurlburt P, Janeway CA. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity[J]. Nature, 1997, 388 (6640): 394-7. DOI: 10.1038/41131. |
| [10] | Kumpf O, Hamann L, Schlag PM, et al. Pre-and post operative cytokine release after in vitro whole blood lipopolysaccharide stimulation and frequent Toll-like receptor 4 polymorphisms[J]. Shock, 2006, 25 (2): 123-8. DOI: 10.1097/01.shk.0000190823.44030.e6. |
| [11] | John G, Chillappagari S, Rubin BK, et al. Reduced surface toll-like receptor-4 expression and absent interferon-γ-inducible protein-10 induction in cystic fibrosis airway cells[J]. Exp Lung Res, 2011, 37 (6): 319-26. DOI: 10.3109/01902148.2011.569968. |
| [12] | Baharom F, Thomas S, Bieder A, et al. Protection of human myeloid dendritic cell subsets against influenza A virus infection is differentially regulated upon TLR stimulation[J]. J Immunol, 2015, 194 (9): 4422-30. DOI: 10.4049/jimmunol.1402671. |
| [13] | Finney LJ, Ritchie A, Pollard E, et al. Lower airway colonization and inflammatory response in COPD: a focus on Haemophilus influenzae[J]. Int J Chron Obstruct Pulmon Dis, 2014, 9 (9): 1119-32. |
| [14] | Li P, Li J, Chen T, et al. Expression analysis of serum microRNAs in idiopathic pulmonary fibrosis[J]. Int J Mol Med, 2014, 33 (6): 1554-62. |
| [15] | Sheedy FJ, Palsson-Mcdermott E, Hennessy EJ, et al. Negative regulation of TLR4 via targeting of the proinflammatory tumor suppressor PDCD4 by the microRNA miR-21[J]. Nat Immunol, 2010, 11 (2): 141-7. DOI: 10.1038/ni.1828. |
| [16] | Warner N, Núñez G. MyD88: a critical adaptor protein in innate immunity signal transduction[J]. J Immunol, 2013, 190 (1): 3-4. DOI: 10.4049/jimmunol.1203103. |
 2016, Vol. 36
2016, Vol. 36

