乳腺癌的浸润和转移是一个复杂的过程。在这个过程中,癌细胞基底膜以及周围间质的降解被认为是最关键的步骤[1]。肿瘤周围基底膜和间质的降解需要多种酶参与,其中最重要的酶类是基质金属蛋白酶家族(MMPs),其中,膜型基质金属蛋白酶-1(MT1-MMP)又起着一种核心的调控作用。我们前期研究[2]发现,(MT1-MMP)是可以激活胶原酶2(MMP-2),降解肿瘤周围间质屏障,增强乳腺癌细胞株侵袭能力,说明其在乳腺癌浸润和转移过程中发挥重要的作用。但是,MT1-MMP在乳腺癌组织中的细胞来源和表达定位尚有很多争议,这也影响它在临床应用中的检测标准和规范问题。本研究主要探讨MT1-MMP在乳腺癌组织中的表达模式,为深入研究其临床意义提供参考。
1 材料和方法 1.1 临床资料和标本收集南方医院2008 年8 月~2010 年1 月乳腺癌手术标本43例。标本于手术中取得并立即放于含有RNA保护液的瓶中,保存于-80 ℃深低温冰箱,同时收集相应的石蜡标本。
1.2 主要试剂免疫组化MT1-MMP一抗为NeoMarkers 公司的兔抗人单克隆抗体,二抗试剂盒采用福建迈新公司的SP超敏试剂盒(Cat.NO:Kit-9720)。半定量RT-PCR的Trizol和逆转录试剂盒分别由Invitrogen公司和MBI公司生产。Taq酶和DNA Marker分别由Promega公司和广州华美公司提供。PCR引物用Primer 5.0软件设计后由上海生物工程公司合成。pPST18质粒及原位杂交试剂盒购自罗氏公司[3]。
1.3 免疫组化检测乳腺癌中MT1-MMP蛋白的表达标本经常规脱水、固定、石蜡包埋,连续切片,厚度4 μm,行病理常规染色检查及免疫组化研究。免疫组化染色采用SP法,MT1-MMP抗原经高压修复,兔抗人单克隆MT1-MMP抗体浓度是1∶60,按照说明书进行操作,严格控制时间及温度,每次染色均设阳性及阴性对照。结果判定:以胞膜呈清晰棕色为阳性。
1.4 半定量RT-PCR 检测乳腺癌中MT1-MMP mRNA的表达将保存于-80 ℃冰箱的肿瘤组织按Trizol试剂盒说明抽提组织总RNA,MT1-MMP 引物序列采用:5'-CAGAGAAGGCACACAAACGA-3'; 5'-CACTGGTGAGACAGGCTTGA-3',扩增产物大小为172 bp;GAPDH 的序列采用:5'-CGGAGTCAACGGATTTCGTAT-3';5'-AGCCTTCTCCATGGTGGTGAAGAC-3',扩增产物大小为320 bp。反应条件为:94 ℃预变性5 min;94 ℃ 50 s、57 ℃ 1 min、72 ℃ 1 min进行30个循环;72 ℃延伸10 min。产物于2%琼脂糖凝胶电泳后染色、摄片。将MT1-MMP和GAPDH电泳条带平均光密度及面积进行相乘,乘积相对比值(MT1-MMP/GAPDH)表示MT1-MMP mRNA的相对表达量[4]。
1.5 原位杂交检测乳腺癌中MT1-MMP mRNA的表达根据GenBank 所列MT1-MMP 编号Z48481.1 的序列,将其中2483 到2884cDNA片断克隆到pPST18质粒,质粒采用T7 RNA聚合酶扩增并按照说明书用地高辛标记RNA探针。组织冰冻切片二甲苯脱蜡、梯度乙醇水化,蛋白酶K 37 ℃消化30 min,4%多聚甲醛4 ℃固定5 min,加预杂交液45 ℃孵育2 h。然后,玻片加地高辛标记的浓度为10 ng·μL-1探针缓冲液,阴性对照加无探针的杂交缓冲液,湿盒中45 ℃孵育15 h。含RNA酶A的NTE缓冲液37 ℃作用30 min,加地高辛检测抗体4 ℃孵育过夜。玻片加入新鲜配制的NBT-BCIP显色液显色液中,于室温避光显色2 h,苏木素淡染,水洗,封片。
1.6 统计方法采用SPSS11.0统计软件进行处理,计量资料采用算术均数±标准差描述,两组样本间均数的比较采用独立样本T检验。规定 P <0.01为差异有统计学意义。
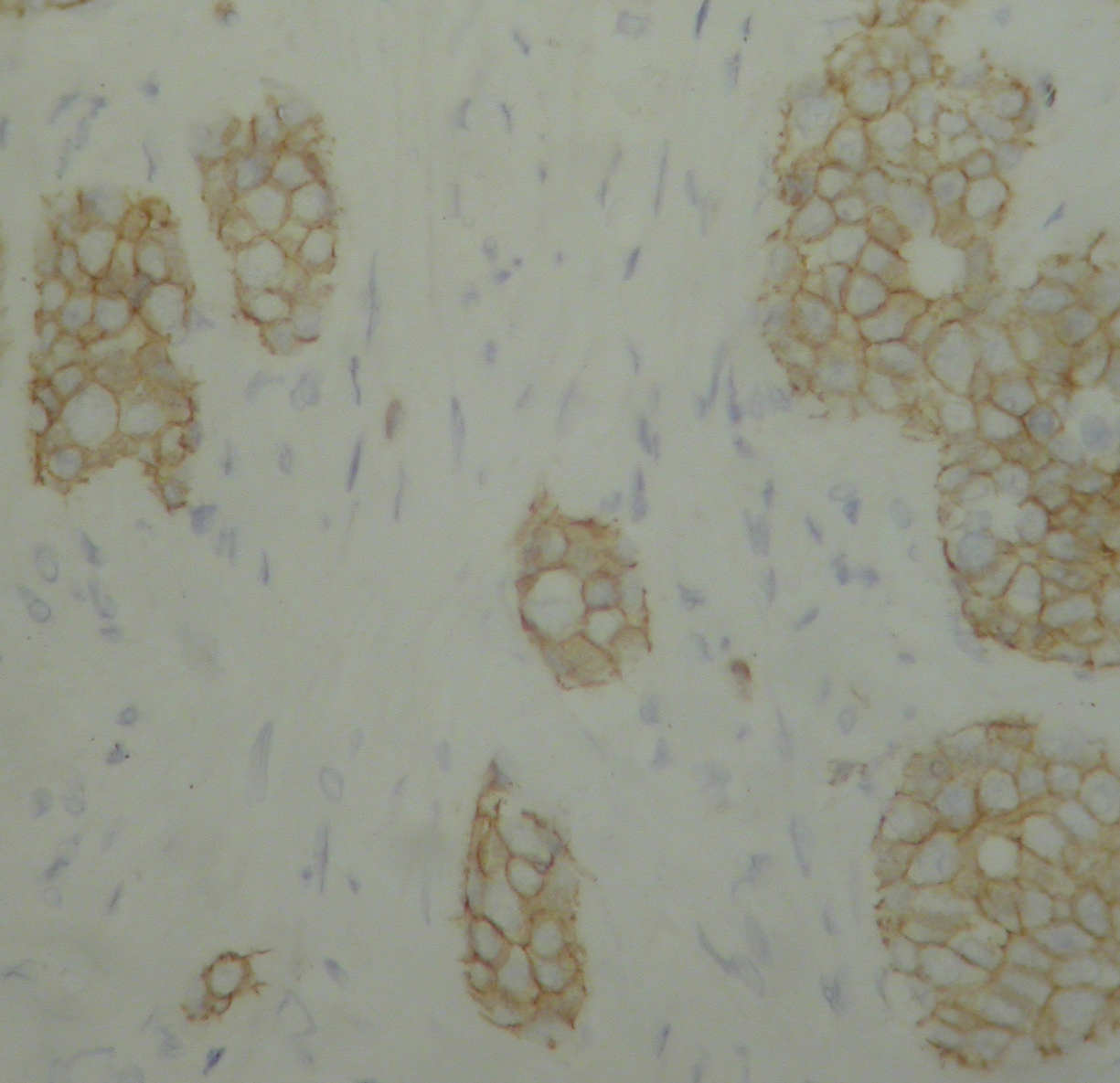
2 结果 2.1 免疫组化检测MT1-MMP蛋白的表达采用免疫组化方法检测MT1-MMP白表达,结果发现乳腺癌患者中MT1-MMP阳性率为51.2%,阳性染色定位于肿瘤细胞胞膜(图 1)。
|
图 1 MT1-MMP在乳腺癌组织中的免疫组化染色 Figure 1 Immunohistochemical staining of MT1-MMP in breast cancer tissue (Original magnification: ×200). |
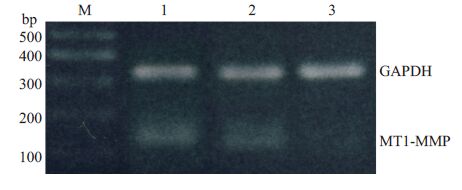
采用RT-PCR 方法检测乳腺癌中MT1-MMPmRNA的表达,结果发现所有乳腺癌患者的肿瘤组织中都可以检测到MT1-MMP mRNA表达,但是不同患者的MT1-MMP mRNA表达强度不同(图 2)。
|
图 2 乳腺癌组织中MT1-MMP mRNA 的RTPCR 扩增产物电泳图 Figure 2 Electrophoresis of RT-PCR amplification products of MT1-MMP in breast cancer tissue. M:marker; l, 2, 3: Breast cancer tissues from different patients. |
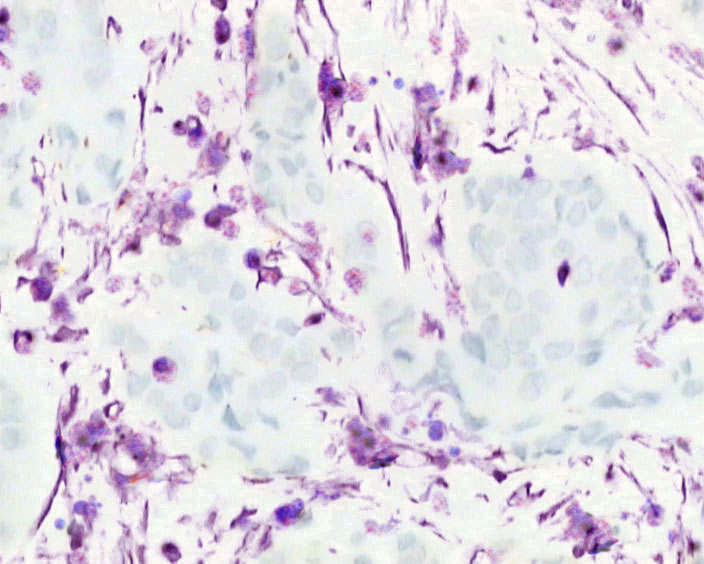
采用原为杂交的方法,阳性表达的MT1-MMPmRNA位于乳腺癌癌巢周围间质细胞的胞质,呈紫蓝色。MT1-MMP mRNA在全部乳腺癌标本中均呈阳性表达(图 3)。
|
图 3 MT1-MMP在乳腺癌组织中的原位杂交染色 Figure 3 In situ hybridization of MT1-MMP in breast cancer tissue (Original magnification: ×200). |
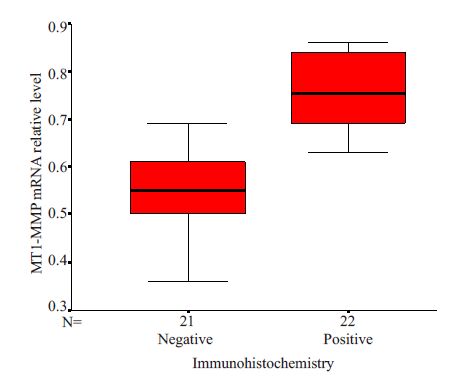
在MT1-MMP 免疫组化染色阳性的乳腺癌中,MT1-MMP mRNA 相对表达量的均数为0.759 ±0.0802,在MT1-MMP免疫组化染色阴性的乳腺癌中,MT1-MMP mRNA 相对表达量的均数为0.547 ±0.0886,两者比较有显著的统计学意义( P <0.01,图 4)。
|
图 4 MT1-MMP mRNA相对表达量与蛋白质免疫组化表达的关系 Figure 4 Association of relative expression of MT1-MMP mRNA and immunohistochemical positivity of its protein expression. P<0.01 negative group compared with positive group. |
MT-MMPs是MMPs一个亚族[5],因其位于细胞膜而得名,现在已经发现6 个成员,分别称为MT1-MMP~MT6-MMP [6]。其中,MT1-MMP是以酶原形式产生的,MT1-MMP活化后可以通MMP-2,降解肿瘤周围的间质成分[2];还可以直接降解肿瘤间质中如玻璃粘连蛋白、层粘连蛋白-1、和Ⅰ、Ⅱ、Ⅲ型胶原等成分[7],从而在乳腺癌的浸润和转移过程中发挥重要的作用[8]。但是,目前关于MT1-MMP在乳腺癌组织中的细胞来源和表达定位尚存在争议,故本研究同时用免疫组化、RT-PCR 和原位杂交的方法研究MT1-MMP 蛋白和mRNA在乳腺癌中表达特点,以期探讨其在乳腺癌组织中的来源和活性定位。
免疫组化是检测肿瘤组织中蛋白表达定位的直观而简洁的方法,故本研究首先采用免疫组化的方法研究MT1-MMP蛋白在乳腺癌中表达的表达定位。我们检测了43 例乳腺浸润性导管癌中MT1-MMP蛋白的表达,发现MT1-MMP蛋白的染色位于癌组织中的肿瘤细胞内,且表达于细胞膜。这与Temma等[9]和Ogura等[10]的研究报道一致。Jones等[11]虽然也发现MT1-MMP蛋白在位于肿瘤细胞,但是他们检测到的胞膜和胞浆都有表达。而Koenig等[12]的研究结论却完全不同,他们报道MT1-MMP蛋白的阳性染色位于乳腺癌癌巢周围的间质细胞中。更有趣的是,Jiang等[13]的研究发现在乳腺癌的肿瘤细胞和癌巢周围的间质细胞中都可以检测到MT1-MMP的阳性染色。由此可见,一个简单的免疫组化检测却发现不同的研究报道的MT1-MMP在乳腺癌组织中表达的定位如此的迥然不同。
mRNA携带者蛋白质的氨基酸序列的信号,一种蛋白应该是在mRNA所在的细胞中合成的。因此,检测mRNA所在的位置是检测其翻译的蛋白的位置的一种常用的办法。本研究中采用原位杂交的方法检测MT1-MMP mRNA表达于肿瘤周围的间质细胞。这方面的研究结论却比较一致,目前绝大多数文献都报道MT1-MMP mRNA定位于由乳腺癌癌巢周围的间质细胞[14-15]。
结合上面的研究结果,可以做这样一种设想:乳腺癌细胞周围的间质细胞是产生MT1-MMP的场所,而之所以间质细胞产生MT1-MMP也是乳腺癌肿瘤细胞分泌某些生物因子刺激癌巢周围的间质细胞产生的[5]。这样,采用原位杂交方法检测到MT1-MMP mRNA时,染色就位于癌巢周围的间质细胞。MT1-MMP蛋白由间质细胞合成后以原酶的形式分泌的,然后弗林蛋白酶激活[1]后锚定到肿瘤细胞胞膜发挥作用,所以MT1-MMP从产生到发挥作用,是从间质细胞还是在肿瘤细胞的一个过程,因此,无论间质细胞还是在肿瘤细胞都可能检测到MT1-MMP蛋白。在哪个细胞检测到,关键在于抗体识别的抗原肽段。MT1-MMP在间质细胞产生时是原酶的形式,如果用识别MT1-MMP前肽域抗原肽段的抗体检测MT1-MMP蛋白的表达,阳性染色应该位于间质细胞;如果用识别MT1-MMP激活后才能暴露的抗原肽段,检测到MT1-MMP蛋白阳性染色就会位于肿瘤细胞。其实,不同抗体识别不同形式蛋白的现象在Proulx-Bonneau等[16]研究VEGF-C在乳腺癌中的表达时也有提及,只是很少有人注意这项研究而已。
无论采用半定量RT-PCR还是原位杂交的方法,本研究发现所有乳腺癌患者肿瘤组织中都可以检测到MT1-MMP mRNA的表达,与Ueno 等[17]的报道一致。但是,采用免疫组化方法检测MT1-MMP蛋白的阳性率仅为51.2%。而且,进一步分析发现,在MT1-MMP免疫组化阳性和阴性两组患者中MT1-MMP mRNA相对表达量有明显差别,在有MT1-MMP蛋白表达的乳腺癌患者中,肿瘤组织的MT1-MMP mRNA表达水平也高,这说明,乳腺肿瘤的癌细胞在刺激间质细胞的活动时,可能存在不同的调节机制,能够刺激间质细胞表达MT1-MMP蛋白的乳腺癌有更大的侵袭性和更差的预后,这也是不同乳腺肿瘤生物学的差异的一个表现。
综上所述,MT1-MMP在乳腺癌组织中表达有独特的特点:MT1-MMP蛋白以原酶形式由肿瘤组织中的间质细胞产生,激活后在肿瘤细胞膜表面发挥作用。这提示我们在用免疫组化的方法研究MT1-MMP蛋白在乳腺癌中表达的临床意义时,一定注意抗体针对的肽段不同,MT1-MMP蛋白表达的位置不同,研究的结论也会存在差异;同时也提示,在应用MT1-MMP作为乳腺癌临床预后判断因子的时候,要注意检测标准化的问题。
| [1] | Jacob A, Prekeris R. The regulation of MMP targeting to invadopodia during cancer metastasis[J]. Front Cell Dev Biol, 2015, 3 : 4. |
| [2] | 姚广裕, 曾木圣, 林鹏, 等. 膜型基质金属蛋白酶-1对乳腺癌细胞浸润能力的影响[J]. 中华肿瘤杂志, 2006 (9): 650-3. |
| [3] | 赵志龙, 张丽芳, 张佳, 等. Shh与MMP2在人食管鳞癌组织中的表达及意义[J]. 南方医科大学学报, 2013 (7): 1008-11. |
| [4] | 陈玉姣, 欧阳晴晴, 王然, 等. 肿瘤坏死因子-α对骨髓源性肥大细胞表达MMP-3、MMP-9、IL-17的影响[J]. 南方医科大学学报, 2015 (11): 1633-7. |
| [5] | Yamamoto K, Murphy G, Troeberg L. Extracellular regulation of metalloproteinases[J]. Matrix Biol, 2015, 44-46 : 255-63. DOI: 10.1016/j.matbio.2015.02.007. |
| [6] | D'addio F, Margonato D, Pensato U, et al. Novel therapeutic and diagnostic management of heart transplant patients[J]. Heart Lung and Vessels, 2015, 7 (3): 198-207. |
| [7] | Paz H, Pathak N, Yang J. Invading one step at a time: the role of invadopodia in tumor metastasis[J]. Oncogene, 2014, 33 (33): 4193-202. DOI: 10.1038/onc.2013.393. |
| [8] | 李姝君, 沈湘, 杨志雄, 等. MMP2过表达在子宫内膜腺癌的临床意义[J]. 南方医科大学学报, 2014 (3): 423-5. |
| [9] | Temma F, De Carvalho FC, Gomes ES, et al. Protein expression of MMP-2 and MT1-MMP in actinic keratosis, squamous cell carcinoma of the skin, and basal cell carcinoma[J]. Int J Surg Pathol, 2015, 23 (1): 20-5. DOI: 10.1177/1066896914540998. |
| [10] | Ogura S, Stawikowski MJ, Fields GB. Monitoring and inhibiting MT1-MMP during cancer initiation and progression[J]. Cancers (Basel), 2014, 6 (1): 416-35. DOI: 10.3390/cancers6010416. |
| [11] | Jones X, Gao X, Zhou L, et al. PDGF-BB-induced MT1-MMP expression regulates proliferation and invasion of mesenchymal stem cells in 3-dimensional collagen via MEK/ERK1/2 and PI3K/AKT signaling[J]. Cell Signal, 2013, 25 (5): 1279-87. DOI: 10.1016/j.cellsig.2013.01.029. |
| [12] | Koenig GC, Rowe RG, Day SM, et al. MT1-MMP-dependent remodeling of cardiac extracellular matrix structure and function following myocardial infarction[J]. Am J Pathol, 2012, 180 (5): 1863-78. DOI: 10.1016/j.ajpath.2012.01.022. |
| [13] | Jiang L, Wang H, Wang L, et al. High-affinity peptide against MT1-MMP for in vivo tumor imaging[J]. J Control Release, 2011, 150 (3): 248-55. DOI: 10.1016/j.jconrel.2011.01.032. |
| [14] | Londero AP, Calcagno A, Grassi T, et al. Survivin, MMP-2, MT1-MMP, and TIMP-2: their impact on survival, implantation, and proliferation of endometriotic tissues[J]. Virchows Arch, 2012, 461 (5): 589-99. DOI: 10.1007/s00428-012-1301-4. |
| [15] | Alcantara MB, Dass CR. Regulation of MT1-MMP and MMP-2 by the serpin PEDF: a promising new target for metastatic cancer[J]. Cell Physiol Biochem, 2013, 31 (4/5): 487-94. |
| [16] | Proulx-Bonneau S, Pratt J, Annabi B. A role for MT1-MMP as a cell death sensor/effector through the regulation of endoplasmic reticulum stress in U87 glioblastoma cells[J]. J Neurooncol, 2011, 104 (1): 33-43. DOI: 10.1007/s11060-010-0468-2. |
| [17] | Ueno K, Wong P, Ma J, et al. MT1-MMP modulates melanoma cell dissemination and metastasis through activation of MMP2 and RAC1[J]. Pigment Cell Melanoma Res, 2014, 27 (2): 287-96. DOI: 10.1111/pcmr.12201. |
 2016, Vol. 36
2016, Vol. 36

