2. 解放军总医院重症医学科,北京 100853
2. Department of Critical Care Medicine, the Chinese PLA General Hospital, Beijing 100853, China
高迁移率族蛋白B1(HMGB1)不仅是一种重要的晚期炎症介质,还具有调节机体免疫的功能,在炎症反应及肿瘤发展机制方面具有重要作用[1-2]。应用抗HMGB1抗体进行被动免疫治疗,对严重内毒素血症、脓毒症、关节炎以及LPS诱导的急性肺损伤都有积极的治疗作用[3]。即使抗体应用时机较晚,肿瘤坏死因子水平已恢复正常,抗HMGB1抗体仍可显著改善症状和预后。如何进一步明确HMGB1的合成释放调控机制,对于寻找针对脓毒症、肿瘤免疫调控等方面的治疗策略具有重要意义。
研究显示,活化T细胞核因子2(NFAT2)是淋巴细胞内关键的转录调控因子,被T细胞受体(TCR)信号活化后,转位入核内调控免疫因子转录表达,属于经典的免疫调节蛋白[4],NFAT蛋白在静息状态下位于T淋巴细胞胞浆中,高度磷酸化,活化时被钙调蛋白依赖性磷酸酯酶(calcineurin)作用而发生去磷酸化,移位入细胞核,调节诸如IL-4、IL-2、IL-5、IL-13、GM-CSF、IL-3、TNF-α等重要免疫分子的表达[5-7]。既往资料显示[8],HMGB1与NFAT2存在一些共同的相互作用蛋白,二者有可能形成蛋白复合体。已证实[9],HMGB1可作为雌激素受体-α(estrogen receptor-α,ER)的共激活蛋白促进雌激素受体的转录活性。ER转录的关键步骤在于ER与雌激素反应元件(ERE)结合,从而启动下游基因转录表达。HMGB1蛋白可以显著促进ER与ERE的结合。另一方面,军事医学科学院的叶棋浓教授[10]研究表明,NFAT家族成员可与ER直接结合并相互影响信号通路。因此,有理由推测HMGB1可能与NFAT发生直接相互作用。另有资料表明[11],一种HMGB1/2 家族中DNA结合蛋白成员——DSP1(DSP1中含有与HMG序列相似的结构域),可与Rel同源域家族成员发生相互作用。而NFATs结构中含有Rel相似结构域(Rel similardomain,RSD),结构上的特点提示二者可能直接相互作用。
研究发现,HMGB1可促进NFAT2参与调控白介素-2的转录表达[12]。HMGB1为非组蛋白DNA调节蛋白,可进入细胞核内参与基因的调控,但目前对于NFAT2对HMGB1的影响机制尚缺乏研究。本实验构建NFAT2和HMGB1的真核表达质粒,观察NFAT2对HMGB1释放的影响,初步揭示NFAT2对HMGB1的调控作用。
1 材料和方法 1.1 材料 1.1.1 基因序列人全长PSH140C-Flag-NFATC1(NM_006162.3)质粒由华盛顿大学Feng Chen博士惠赠。NFAT2的基因全长序列在GenBank中基因登录号为U08015,其开放读码框从240 到2390 位[13];在Medline 的GenBank 数据库中获取人HMGB1 的基因全长序列,基因库登录号为BC066889,其开放读码框从80到727位。
1.1.2 sRNAi 干扰质粒NFAT2 及HMGB1 的sRNAi引物、sRNAi 空白质粒购于GenePharma 公司(上海,中国)。sRNAi 引物的基因序列如下:HMGB1 siRNA正义序列为5'GGGAGGAGCAUAAGAAGAATT3',反义5'UUCUUCUUAUGCUCCUCCCTT3'。NFAT2siRNA 正义序列5'AGCGGAGGAAGAACACUAUTT3',反义5'AUAGUGUUCUUCCUCCGCUTT3'。用于构建sRNAi质粒的2.1-U6neo 载体购于Ambion公司(德克萨斯州,美国)。
1.2 方法 1.2.1 细胞转染培养人单核粒细胞系THP-1细胞及人胚胎肾细胞系HEK293T细胞,细胞用含有10%的新生牛血清和双抗DMEM培养基培养。在转染前24 h用不含双抗、含10%新生牛血清的相应培养基将细胞接种在6 cm小皿中,接种时机以转染时细胞密度达到90%为准。将DNA用80 μL不含双抗和血清的培养基稀释,再用80 μL 相同的培养基稀释2.5 μL Lipofectamine2000,立即将二者混合,室温放置20 min 后,加入到含有0.8 mL 培养基和10%新生牛血清的6 cm 小皿中,4 h 后更换培养基。实验时应用100 ng/mL 脂多糖进行刺激,在不同的时间点收集细胞以及细胞培养上清。
1.2.2 免疫共沉淀(co-IP)实验细胞转染后24 h,取出培养皿并收集细胞,行超声破碎留取上清。上清体积约450 μL,其中从上清中吸取30 μL 留作电泳加样(input),其余约420 μL上清用于进行IP实验。每个样本中加入15 μL带琼脂糖珠子的抗体进行沉降,沉降完毕后将样品加入上样缓冲液,充分混匀,煮沸后离心,取10 μL进行Western blotting印迹分析,应用相应的抗体进行检测。
1.2.3 裂解细胞提取核蛋白操作过程注意迅速并保持低温。刺激完毕后倒掉培养液,采用预冷的PBS液(含1 mmol/L NaF、1 mmol/L Na3VO4)洗涤刺激后细胞3遍,每瓶加入800 μL细胞匀浆缓冲液,用细胞刮刀迅速收集细胞。吸出后置于EP管中,冰浴摇震20 min,再加入1/10~1/5体积的75%蔗糖溶液,混匀,12 000 r/min离心10 min后去除上清。在离心沉淀物中加入30 μL的核蛋白提取缓冲液并于4 ℃冰浴摇震1 h,12 000 r/min离心30 min,取上清即为核蛋白溶液。取4 μL核蛋白上清,用去离子水稀释100倍,以紫外分光光度计测A280值,结果乘以50,即为核蛋白提取原液中蛋白浓度,单位为μg/μL。
1.2.4 Western blotting 检测免疫沉降物中目标蛋白水平吸取10 μL离心上清,进行10%聚丙烯酰胺凝胶电泳。电泳完毕后进行转膜,电转完毕后取出硝酸纤维素膜,应用特异性抗体及带荧光素酶的二抗进行结合。在暗室中,采用化学发光反应试剂盒进行检测。
1.2.5 统计学方法所有实验重复4次,数据以均数±标准差表示,采用SPSS16.0统计软件,进行单因素方差分析。P<0.05表示差异有统计学意义。
2 结果 2.1 脂多糖刺激可促进THP-1细胞释放HMGB1应用100 ng/mL的脂多糖对THP1细胞进行刺激,在刺激后不同时间点收集细胞进行检测。结果显示,脂多糖刺激后6~24 h,细胞内的HMGB1 水平逐渐下降(图 1A,P<0.05),同时,细胞培养上清中的HMGB1 蛋白水平却逐渐升高(图 1B,P<0.05)。两种相反的变化趋势更证实了HMGB1可在脂多糖的刺激下由细胞内向细胞外释放。
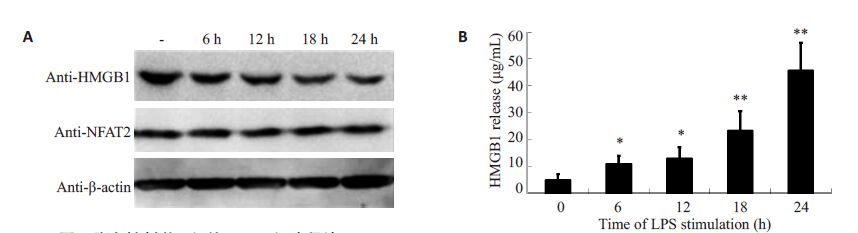
|
图 1 脂多糖刺激可促使THP-1细胞释放HMGB1 Figure 1 HMGB1 release from THP-1 cells in response to LPS stimulation. A: LPS stimulation decreased intracellularHMGB1 in THP-1 cells; B: LPS stimulation increased HMGB1 level in the culture supernatant. *P<0.05,**P<0.01. |
为了探讨脂多糖刺激对NFAT2与HMGB1在胞浆内相互作用的影响,应用100 ng/mL的脂多糖对THP1细胞进行攻击。结果显示(图 2),在静息细胞内,HMGB1 与NFAT2 有较强的结合条带,而脂多糖刺激可抑制二者相互结合。随着脂多糖刺激时间的延长,免疫沉降物中所能检测到的HMGB1 条带逐渐减弱。在脂多糖刺激后24 h,HMGB1 蛋白条带已经接近消失。这提示脂多糖刺激可减弱NFAT2 与HMGB1 之间的结合,并可能因此促进了HMGB1 向细胞外的释放。
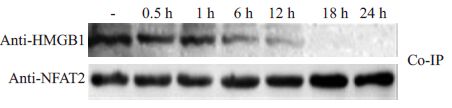
|
图 2 脂多糖刺激可抑制NFAT2与HMGB1在细胞浆内相互结合 Figure 2 LPS stimulation depressed bindingbetween NFAT2 and HMGB1. |
为了初步明确NFAT2与HMGB1在细胞核内相互作用情况,我们应用100 ng/mL的脂多糖对THP1细胞进行攻击。在脂多糖刺激的不同时间点收集细胞,提取胞核蛋白进行检测。结果显示(图 3),HMGB1 与NFAT2 没有相互结合,随着脂多糖刺激时间的延长,NFAT2蛋白在细胞核内的聚集有所增加,但没有发现二者的结合条带,这提示NFAT2 与HMGB1 之间的相互作用并不发生在细胞核内。
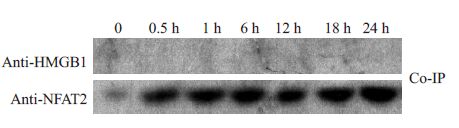
|
图 3 脂多糖刺激下HMGB1与NFAT2在细胞核内相互作用情况 Figure 3 No binding between HMGB1 and NFAT2was detected in the cell nuclei. |
为了探讨NFAT2 对HMGB1 释放的影响,应用NFAT2的sRNAi质粒抑制THP-1细胞中内源性NFAT2的表达。sRNAi质粒转染24 h后,收集THP-1细胞及其培养上清液,检测HMGB1 蛋白水平。结果显示,在NFAT2 受到抑制的细胞内,HMGB1 蛋白水平显著下降;而HMGB1受到抑制的细胞内,NFAT2蛋白水平没有变化(图 4A,P>0.05)。NFAT2-sRNAi质粒可导致细胞培养上清的HMGB1蛋白浓度上升(图 4B,P<0.05)。HMGB1及NFAT2相应的sRNAi质粒可显著抑制其基因的转录水平(图 4C,P<0.01)。
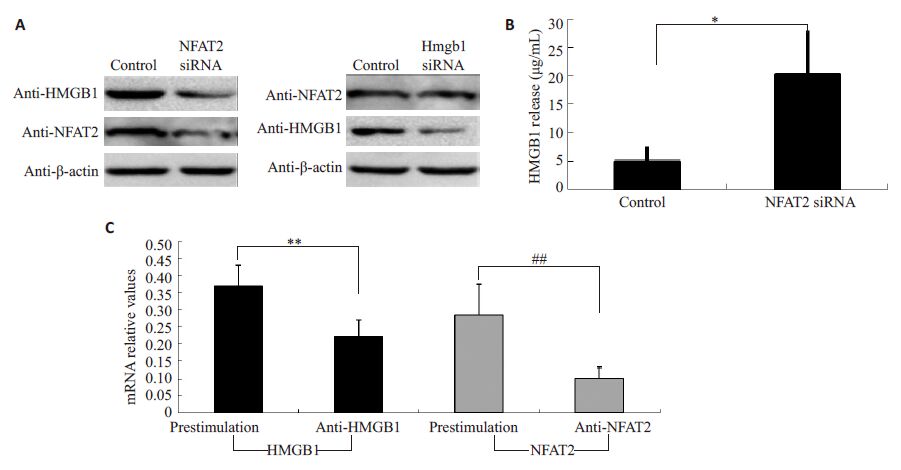
|
图 4 抑制NFAT2可促进HMGB1向细胞外释放 Figure 4 Inhibition of NFAT2 promoted HMGB1 release from THP-1 cells. A: Effect of NFAT2-siRNA and HMGB1-siRNAon HMGB1 and NFAT2 in THP-1 cells,respectively; B: NFAT2 inhibition increased extra-cellular HMGB1 protein level;C: Inhibition of HMGB1 and NFAT2 using siRNA plasmids. *P<0.05,**P<0.01,##P<0.01. |
HMGB1是一种非组蛋白DNA结合蛋白,在细胞核内可协调DNA结构解旋并启动基因转录。不仅如此,HMGB1还可由细胞核进入细胞浆,在细胞受到相应刺激后可释放到细胞外,具有广泛的生物学功能。如果能够明确HMGB1 合成释放的调控机制,则可为以HMGB1为靶点的治疗策略提供思路和线索[14-15]。研究显示[12-13, 16],脂多糖、肿瘤坏死因子、白介素等多种因素可通过激活核因子-κB、Janus激酶-信号转导和转录激活子等通路导致HMGB1 的合成释放。已证实,HMGB1 出入细胞核主要是通过乙酰化的机制实现的。HMGB1本身具有2个非典型的核输出信号肽,在大多数细胞中,HMGB1动态的游走于细胞核及胞浆中,但核内聚集是一个主动过程,具有绝对优势,而出核则主要是被动扩散。去乙酰化时,入核增多;高度乙酰化时,出核增多[17]。
我们的前期研究发现,HMGB1 可促进NFAT2 参与调控白介素-2 的转录表达[18]。新近研究发现[19-21],NFAT2不仅是一种经典的免疫转录调节因子,还可以被炎症信号激活,参与炎症反应的调控。NFAT2可与STAT3形成蛋白复合物,在细胞核内影响染色体的转录表达。既往研究证实[16],STAT3可参与调控晚期炎症因子HMGB1的转录表达,并影响脓毒症大鼠的预后。因此,NFAT2极有可能参与HMGB1的信号调控,发挥其炎症调控作用。另有研究报道[22],NFAT2可以被炎症信号通路(如丝裂原活化蛋白激酶通路、核因子-κB通路)活化,参与调控下游的炎症反应。而且,研究发现NFAT2在细胞核内可作为架构蛋白与染色体相互作用[23],起到解旋并影响基因转录,这与HMGB1的细胞核内作用有类似之处,二者有可能通过相互作用,影响彼此的生物学功能。因此,本实验通过构建相应的真核表达质粒,进一步探讨NFAT2对HMGB1的调控作用。
本实验选用THP-1细胞来观察NFAT2与HMGB1之间的相互作用。单核巨噬细胞系THP-1细胞属于典型的炎症反应细胞,细胞内存在内源性NFAT2 与HMGB1 蛋白。脂多糖刺激可促进HMGB1 从THP-1细胞内向细胞外释放。随着脂多糖刺激时间的延长,细胞内的HMGB1水平逐渐下降,同时细胞培养上清中的HMGB1 蛋白水平上升。进一步实验显示,在静息THP-1细胞内,HMGB1与NFAT2相互结合。脂多糖刺激后,HMGB1与NFAT2的结合条带逐渐减弱,但是,在细胞核内没有检测到HMGB1与NFAT2的相互作用条带。这说明NFAT2在细胞浆内可能与HMGB1形成蛋白复合体,而脂多糖刺激可导致蛋白复合物解体,引起HMGB1蛋白向细胞外释放。为了从反面论证这种可能性,本实验构建了NFAT2 的sRNAi 质粒,用于抑制THP-1细胞内的NFAT2蛋白表达,观察对HMGB1释放的影响。实验结果显示,细胞内NFAT2的蛋白水平和基因转录水平受到抑制后,THP-1细胞内HMGB1蛋白水平显著下降,而细胞外培养液中的HMGB1蛋白浓度上升。这说明,随着NFAT2蛋白受到抑制,HMGB1在细胞内受到NFAT2 的影响减小,向细胞外释放增加。NFAT2的存在对HMGB1的释放有较大影响。本实验结果初步探讨了NFAT2 在细胞浆内对HMGB1 的调控作用,为进一步研究HMGB1 释放的调控机制提供了线索。
| [1] | Musumeci D, Roviello GN, Montesarchio D. An overview on HMGB1 inhibitors as potential therapeutic agents in HMGB1- related pathologies[J]. PharmacolTher,2014, 141 (3) : 347-57. |
| [2] | 华胜妮, 肖芦山, 吴德华. HMGB1对人鼻咽癌细胞株C666-1体外增 殖的影响[J]. 南方医科大学学报,2015, 35 (11) : 1540-5. |
| [3] | Wang H, Yang H, Tracey KJ. Extracellular role of HMGB1 in inflammation and sepsis[J]. J Intern Med,2004, 255 : 320-31. DOI: 10.1111/jim.2004.255.issue-3. |
| [4] | Koch S, Reppert S, Finotto S. NFATc1 deletion in T lymphocytes inhibits the allergic trait in a murine model of asthma[J]. ClinExp Allergy,2015, 45 (8) : 1356-66. DOI: 10.1111/cea.12493. |
| [5] | Reppert S, Zinser E, Holzinger C, et al. NFATc1 deficiency in T cells protects mice from experimental autoimmune encephalomyelitis[J]. Eur J Immunol,2015, 45 (5) : 1426-40. DOI: 10.1002/eji.201445150. |
| [6] | Garaud S, Morva A, Lemoine S, et al. CD5 promotes IL-10 production in chronic lymphocytic leukemia B cells through STAT3 and NFAT2 activation[J]. J Immunol,2011, 186 (8) : 4835-44. DOI: 10.4049/jimmunol.1003050. |
| [7] | Srinivasan M, Frauwirth KA. Reciprocal NFAT1 and NFAT2 nuclear localization in CD8+ anergic T cells is regulated by subo- ptimal Calcium signaling[J]. J Immunol,2007, 179 (6) : 3734-41. DOI: 10.4049/jimmunol.179.6.3734. |
| [8] | Yamaguchi Y, Sakai E, Sakamoto H, et al. Inhibitory effects of tert-butylhydroquinone on osteoclast differentiation via up-regulation of heme oxygenase-1 and down-regulation of HMGB1 release and NFATc1 expression[J]. J ApplToxicol,2014, 34 (1) : 49-56. |
| [9] | Joshi SR, Sarpong YC, Peterson RC, et al. Nucleosome dynamics: HMGB1 relaxes canonical nucleosome structure to facilitate estrogen receptor binding[J]. Nucleic Acids Res,2012, 40 (20) : 10161-71. DOI: 10.1093/nar/gks815. |
| [10] | Qin X, Wang XH, Yang ZH, et al. Repression of NFAT3 transcriptional activity by estrogen receptors[J]. Cell Mol Life Sci,2008, 65 (17) : 2752-62. DOI: 10.1007/s00018-008-8273-1. |
| [11] | Martin D, Daulny A, Decoville M, et al. Mutagenesis analysis of the interaction between the dorsal rel homology domain and HMG boxes of DSP1 protein[J]. J Biochem,2003, 134 (4) : 583-9. DOI: 10.1093/jb/mvg177. |
| [12] | Kim YM, Kim JH, Park SW, et al. Retinoic acid inhibits tissue factor and HMGB1 via modulation of AMPK activity in TNF-α activated endothelial cells and LPS-injected mice[J]. Atherosclerosis,2015, 241 (2) : 615-23. DOI: 10.1016/j.atherosclerosis.2015.06.016. |
| [13] | Tan Y, Wang Q, She Y, et al. Ketamine reduces LPS-induced HMGB1 via activation of the Nrf2/HO-1 pathway and NF-κB suppression[J]. J Trauma Acute Care Surg,2015, 78 (4) : 784-92. DOI: 10.1097/TA.0000000000000588. |
| [14] | 戚之琳, 齐世美, 凌烈锋, 等. 瑞香素对HMGB1释放及HMGB1诱发 的炎症反应的双重抑制作用[J]. 南方医科大学学报,2015, 35 (11) : 1519-23. |
| [15] | 张丹丹, 赵海金, 周丽芹, 等. 高迁移率族蛋白B1 协同白介素-1β可增 加人气道上皮细胞白介素-8的表达[J]. 南方医科大学学报,2012, 32 (12) : 1764-7. |
| [16] | Hui L, Yao Y, Wang S, et al. Inhibition of Janus kinase 2 and signal transduction and activator of transcription 3 protect against cecal ligation and puncture-induced multiple organ damage and mortality[J]. J Trauma,2009, 66 (3) : 859-65. DOI: 10.1097/TA.0b013e318164d05f. |
| [17] | Yang Z, Li L, Chen L, et al. PARP-1 mediates LPS-induced HMGB1 release by macrophages through regulation of HMGB1 acetylation[J]. J Immunol,2014, 193 (12) : 6114-23. |
| [18] | Liu H, Yao YM, Ding LH, et al. High mobility group box-1 protein acts as a coactivator of nuclear factor of activated T cells-2 in promoting interleukin-2 transcription[J]. Int J Biochem Cell Biol,2009, 41 (3) : 641-8. DOI: 10.1016/j.biocel.2008.07.009. |
| [19] | Vaeth M, Schliesser U, Müller G, et al. Dependence on nuclear factor of activated T-cells (NFAT) levels discriminates conventional T cells from Foxp3 + regulatory T cells[J]. Proc Natl Acad Sci USA,2012, 109 (40) : 16258-63. DOI: 10.1073/pnas.1203870109. |
| [20] | Baumgart S, Chen NM, Siveke JT, et al. Inflammation-induced NFATc1-STAT3 transcription complex promotes pancreatic cancer initiation by KrasG12D[J]. Cancer Discov,2014, 4 (6) : 688-701. DOI: 10.1158/2159-8290.CD-13-0593. |
| [21] | 卢家美, 王小闯, 谢新明, 等. Calcineurin/NFAT信号通路上调5型磷 酸二酯酶的表达及介导内皮素-1诱导的肺动脉平滑肌细胞增殖[J]. 南方医科大学学报,2013, 33 (1) : 26-9. |
| [22] | Wei ZF, Tong B, Xia YF, et al. Norisoboldine suppresses osteoclast differentiation through preventing the accumulation of TRAF6- TAK1 complexes and activation of MAPKs/NF-κB/c-Fos/NFATc1 Pathways[J]. PLoS One,2013, 8 (3) : e59171. DOI: 10.1371/journal.pone.0059171. |
| [23] | Feske S, Giltnane J, Dolmetsch R, et al. Gene regulation mediated by Calcium signals in T lymphocytes[J]. Nat Immunol,2001, 2 (4) : 316-24. DOI: 10.1038/86318. |
 2016, Vol. 36
2016, Vol. 36

