白血病是儿童最常见的恶性肿瘤,严重威胁儿童健康。其中以急性淋巴细胞白血病最为常见。近年来,随着儿童白血病机制的研究和临床诊疗的发展,儿童急性B淋巴细胞白血病(B-ALL)患者的预后显著改善,其5年无病生存率达90%。但急性T 淋巴细胞白血病(T-ALL)生存率仅为60%~75%,T-ALL发生发展的具体机制亟待研究[1]。
Tal1,急性淋巴细胞白血病蛋白同系物1,是Ⅱ类碱性/螺旋-环-螺旋(bHLHⅡ)转录因子家族的重要成员[2],是造血过程中重要的转录因子,其高表达占儿童T-ALL的40%~60%[3]。现有研究证实Tal1高表达的T-ALL恶性程度高,预后不佳,5年生存率约为40%[3]。有文献报道,Tal1可以促进T-ALL细胞的增殖[4-5],而相关机制仍不清楚。本课题组通过建立Tal1 稳定转染的Jurkat细胞株,对其机制进行初步的研究,为后续的靶向治疗提供基础。
1 材料和方法 1.1 主要试剂及药物RPMI 1640 培养基和胎牛血清(Gibco);CCK-8试剂(凯基);anti-Tal1 抗体(Cell Signaling)和anti-GAPDH(北京中衫金桥);anti-CDKN2A抗体(武汉三鹰);anti-CDKN2B(Santa Cruz);RIPA细胞裂解液(百泰克);Trizol RNA提取液(Takara);逆转录提取试剂盒(Takara);Tal1过表达、Mock和siTal1慢病毒载体为吉凯公司构建;SYBR Green Ⅱ 试剂(Takara);引物(华大基因)。
1.2 细胞培养人急性T 淋巴细胞性白血病细胞Jurkat 细胞购自美国培养物集存库(ATCC)。细胞培养于含10%胎牛血清,青霉素100 U/mL 和链霉素100 μg/mL 的RPMI 1640 培养液中,细胞培养于37 ℃ 5% CO2条件中。
1.3 Tal1 稳定转染细胞株的建立在细胞培养对数生长期,准备96孔细胞板,3000细胞/孔;再根据Jukat 的MOI值,加入6×104 U慢病毒载体,100 μL Optimum培养基,100 μL Enhancer,和37 ℃5% CO2孵箱6 h。换10%胎牛血清,青霉素100 U/mL 和链霉素100 μg/mL 的RPMI 1640 培养液;8 h后行镜下荧光观察GFP 荧光表达的细胞比例,细胞扩大培养后,有限稀释法对荧光细胞的筛选,然后扩大培养即得稳定细胞株以备进一步验证Tal1的表达。
1.4 CCK8检测细胞增殖取对数期细胞96 孔板铺板,细胞3000/200 μL1640完全培养基每孔,每24 h加入10 μL CCK-8试剂混匀37 ℃ 5% CO2 孵育3 h 后,检测450 nm 吸光度(D450 nm),连续监测5 d。
1.5 细胞周期检测将待检测细胞去血清培养,同步化处理后,取2~5×105细胞用PBS洗2遍,弃上清,将细胞沉淀于70%乙醇混匀固定1 h,然后450 g 离心,弃上清,PBS 洗2 次,每次5 min。避光加入碘化丙啶(PI)染液,暗室混匀静置30 min,使用流式细胞仪进行检测。
1.6 Western blot检测Tal1、CDKN2A、CDKN2B的表达每50 μL 细胞沉淀加入250 μL RIPA 裂解液,冰上裂解30 min,每间隔5 min 震荡混匀1 次。4 ℃,12 000 r/min离心30 min,保留上清。用BCA法检测蛋白浓度,加入5×Loading Buffer 混匀后85 ℃煮沸5 min,取20 μg蛋白SDS-PAGE电泳,PVDF膜转膜,5%脱脂奶粉室温封闭1 h,加入一抗(Tal1 1∶700、CDKN2A 1∶500、CDKN2B 1∶20、GAPDH 1∶20 000),4 ℃孵育过夜,次日加入二抗(1∶5000)室温孵育l h,TBST充分洗涤后,用增强化学发光系统(ECL)检测膜上信号。
1.7 SYBR 荧光定量PCR 法检测Tal1、CDKN2A、CDKN2B基因mRNA水平(1) Trizol 法提取细胞总RNA;(2)RNA逆转录为cDNA;(3)Real-time RT-PCR:反应体系:12.5 μL SYBRⅡ,10.5 μL ddH20,1 μL cDNA,上下游引物(表 1)各0.5 μL。反应条件:95 ℃ 预变性5 min;95 ℃ 20 s,58 ℃20 s,72 ℃ 30 s,循环35次,每个循环结束检测荧光。
| 表 1 引物信息 Table 1 Sequences of the primers for RT-PCR |
实验结果采用SPSS17.0统计软件进行分析,实验独立重复3次,所有数据统计显示方差齐,采用单因素分析,组间两两比较采用t检验,P<0.05认为差异有统计学意义。
2 结果 2.1 Jurkat稳转细胞株的建立及Tal1的表达鉴定Real-time RT-PCR 和Western Blot 检测Tal1 在Jurkat-siTal1、Jurkat-mock1、Jurkat-T1 和Jurkat-mock2中mRNA和蛋白表达水平。结果显示Jurkat-siTal1中Tal1 的mRNA水平明显下降,而Jurkat-T1 细胞中的Tal1 mRNA水平明显升高(P<0.05)。Western Blot 结果与Real-time RT-PCR结果一致(P<0.05,图 1)。
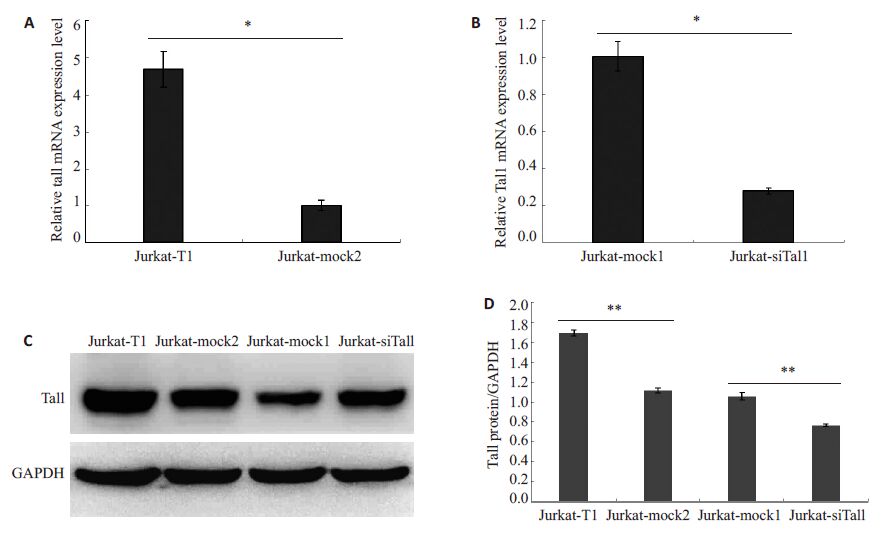
|
图 1 Jurkat稳转细胞株的建立及Tal1的表达鉴定 Figure 1 Expression of Tal1 in Jurkat cells infected by lentivirus vectors. A,B: Real-time RT-PCR results for Tal1 mRNAexpression standardized against GAPDH; C: Western blotting for Tal1 protein expression with GAPDH as the loadingcontrol. siTal1-control served as mock1 and T1-control as mock2; D: Statistical analysis of the protein levels in differentJurkat cells. *P<0.05,**P≤0.001. |
利用CCK-8 实验连续监测5 d Jurkat-T1、Jurkatmock2、Jurkat-siTal1 和Jurkat-mock1 组的A450值,结果显示Jurkat-siTal1 细胞中A450值从第2~5 天显著低于Jurkat-mock1细胞,而Jurkat-T1细胞的A450值从第2~5天显著高于Jurkat-mock2细胞(P<0.05,图 2)。
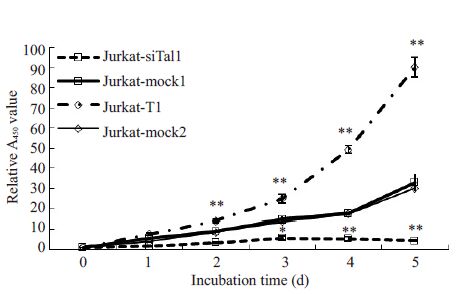
|
图 2 Tal1促进Jurkat细胞增殖 Figure 2 Statistical graph of cell proliferation in differentJurkat cells with CCK8 assay. *P<0.05 Jurkat-siTal1 vsJurkat-mock1; **P≤0.001 Jurkat-T1 vs Jurkat-mock2. |
使用流式细胞术PI染色检测不同Jurkat稳定转染细胞株的对数生长期24h时的细胞周期,结果显示细胞周期在Jurkat-siTal1与Jurkat-mock1相比时,G0/G1期显著增多,而S期显著减少,说明Jurkat-siTal1组G0/G1期向S 期的转换明显受到阻滞,而Jurkat-T1 与Jurkatmock2细胞周期相比,G0/G1期显著减少,而S期显著增多,说明Jurkat-T1 组G0/G1期向S 期的转换明显增加(P<0.05,图 3)。
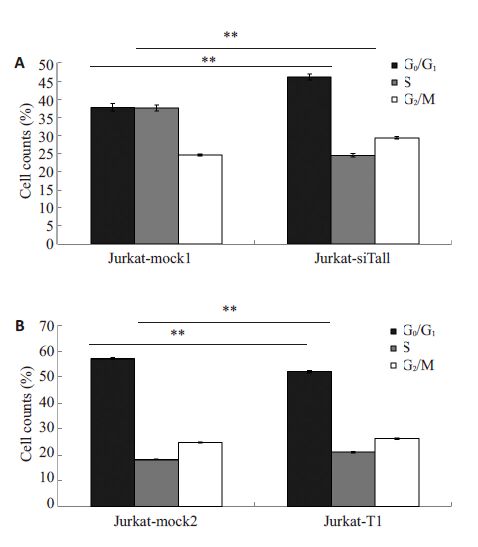
|
图 3 Tal1促进Jurkat 细胞G0/G1期向S期转换 Figure 3 Tal1 promotes cell cycle transition from G0/G1 phaseto S phase in Jurkat cells. A,B: Statistical graph of cell cyclein different Jurkat cells. *P<0.05. **P≤0.001. |
通过Real-time RT-PCR检测发现,Jurkat-siTal1与Jurkat-mock1组相比,CDKN2A和CDKN2B的mRNA表达水平显著增高,而Jurkat 细胞中Tal1 过表达后CDKN2A和CDKN2B的mRNA表达水平均显著降低。通过Western blot检测发现Jurkat-siTal1组CDKN2A和CDKN2B 的蛋白表达水平显著增高,Jurkat-T1 组CDKN2A和CDKN2B的蛋白表达水平显著降低(P<0.05,图 4)。
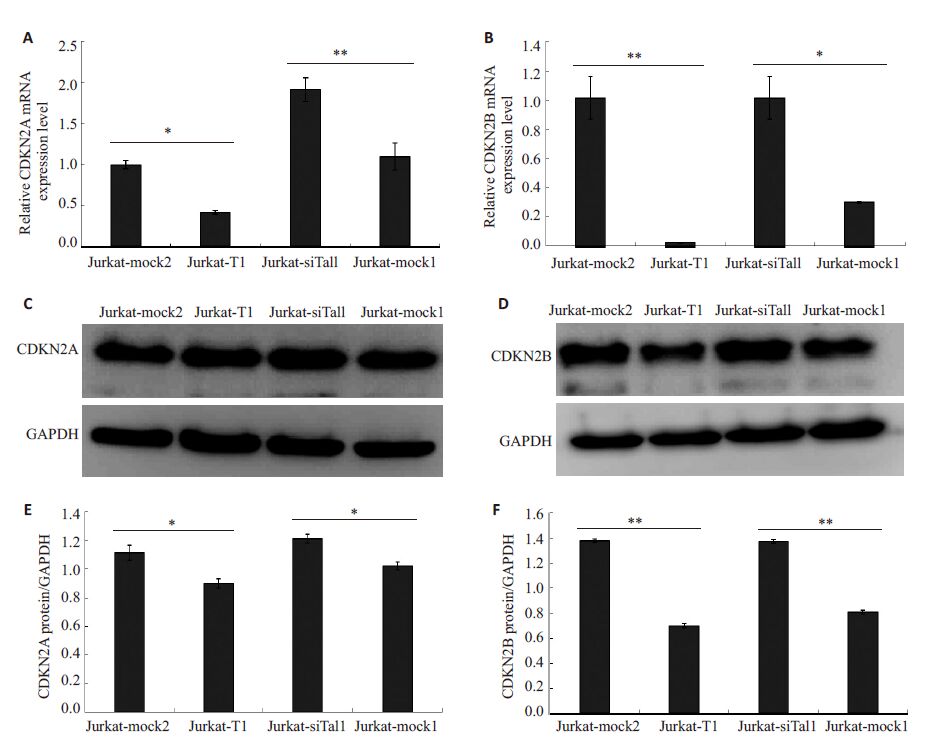
|
图 4 Jurkat细胞中Tal1抑制CDKN2A和CDKN2B表达 Figure 4 Tal1 inhibits genes expression of CDKN2A and CDKN2B in Jurkat cells. A,B: Real-time RT-PCR results for CDKN2Aand CDKN2B mRNA expression; C,D: Western blotting for CDKN2A and CDKN2B protein expression with GAPDH ascontrol. siTAL1-control served as mock1 and T1-control as mock2; E,F: Statistical graph of protein level in different Jurkatcells. *P<0.05. **P≤0.001. |
急性淋巴细胞白血病是儿童最常见的恶性肿瘤,分为急性B淋巴细胞白血病(B-ALL)和急性T淋巴细胞白血病(T-ALL),T-ALL发病率比B-ALL低,仅占ALL的15%~20%,但其预后不良[6]。目前研究发现,在65%的T-ALL病人中发生了Tal1的异常表达,且这种异常表达经常导致染色体的易位和缺失[7]。Tal1 是П类bHLH 家族的一种转录因子,它在造血早期具有重要的作用[8]。Tal1也是一种致癌基因,有文献报道Tal1的异常表达与T-ALL的不良预后有密切关系[9]。在我们的研究中Tal1表达促进T-ALL Jurkat细胞增殖与进展,也说明Tal1与T-ALL的发生发展有密切的关系。
文献报道,Tal1 过表达对一些细胞周期有促进作用[10-13]。我们检测了Jurkat稳定转染细胞的细胞周期,发现Tal1 在细胞分裂间期能够促进G0/G1期向S期转换。G1期在生长因子的刺激下,CyclinD表达,并能够与CDK4、CDK6结合形成复合物,从而促进G1期向S期的转换,而细胞内具有一组CDK 抑制因子,例如CDKN2A和CDKN2B,是CDK4特异性抑制物,能够与CyclinD竞争性结合CDK4,从而抑制细胞周期G1向S期转换[13-15],在我们的研究中,利用PCR和Western blot技术检测不同Jurkat 稳定转染细胞株中CDKN2A和CDKN2B的表达,发现在Tal1 过表达的Jurkat 细胞中CDKN2A和CDKN2B表达显著降低,而在Tal1敲低组中CDKN2A和CDKN2B的表达显著升高,这些研究表明Tal1可能通过抑制CDKN2A和CDKN2B表达,来促进Jurkat 细胞的增殖,为后续的研究奠定基础。
在本研究中,Jurkat-siTal1 与mock1 细胞株相比,CDKN2A和CDKN2B mRNA和蛋白的表达升高,而Jurkat-T1与mock2细胞株相比,CDKN2A和CDKN2B的表达下降,但mRNA水平变化明显,蛋白水平变化不是很明显,这可能是由于两个原因引起的,首先,真核基因表达的转录和翻译发生的时间存在时空间隔,mRNA达到峰值时蛋白量还在增加中;其次,在转录后又会有转录后加工、转录产物的降解、翻译、翻译后加工及修饰等,因此,转录水平和翻译水平并不完全一致。有研究者对124个T-ALL病例进行分析时发现,有64%肿瘤因为发生了CDKN2A基因重排,因此在DNA水平上其表达是缺失的;在超过60%肿瘤中CDKN2A 基因在mRNA水平上也不表达[16],这些发现说明了CDKN2A的缺失在T-ALL中具有重要作用。当然,Tal1也可能通过不同的信号通路来影响细胞的增殖。现有文献报道,Tal1 在细胞内环境的作用下可以与不同的复合DNA亚基结合,引起白血病的发生。Tal1与急性髓细胞白血病1蛋白(RUNX1)和ETS1(P54)能够发生相互作用,这些转录因子是Tal1调节T细胞分化时所要结合一些基因时所必需的,Tal1通过抑制T细胞分化从而引起T细胞肿瘤的形成[17]。在人类肿瘤和老鼠模型中,Tal1高表达与胸腺细胞CD4+CD8+阶段分化阻滞相关,而Jurkat细胞是CD4+CD8+T-ALL细胞,而且TAL1 异常表达,在多种T-ALL分子研究中被应用[2, 5],所以在我们的研究中应用了Jurkat 细胞作为研究对象。Jurkat 细胞属于WT型Tal1高表达的细胞株,为了更确切的说明Tal1对T-ALL细胞增殖的影响,下一步我们还需要选择一株Tal1缺失型细胞株HPB-ALL做进一步研究。
综上所述,本文发现Tal1可以通过抑制CDKN2A和CDKN2B表达来促进Jurkat细胞的增殖。但Tal1促进Jurkat细胞增殖的机制非常复杂,其他相关机制需要进一步研究。
| [1] | Sanda T, Lawton LN, Barrasa MI, et al. Core transcriptional regulatory circuit controlled by the TAL1 complex in human T cell acute lymphoblastic leukemia[J]. Cancer Cell,2012, 22 (2) : 209-21. DOI: 10.1016/j.ccr.2012.06.007. |
| [2] | Patel B, Kang Y, Cui K, et al. Aberrant TAL1 activation is mediated by an interchromosomal interaction in human T-cell acute lymphoblastic leukemia[J]. Leukemia,2014, 28 (2) : 349-61. DOI: 10.1038/leu.2013.158. |
| [3] | Look AT. Gene expression profiling in T-cell acute lymphoblastic leukemia[J]. Semin Hematol,2003, 40 (4) : 274-80. DOI: 10.1016/S0037-1963(03)00195-1. |
| [4] | Mansour MR, Sanda T, Lawton LN, et al. The TAL1 complex targets the FBXW7 tumor suppressor by activating miR-223 in human T cell acute lymphoblastic leukemia[J]. J Exper Med,2013, 210 (8) : 1545-57. DOI: 10.1084/jem.20122516. |
| [5] | Genesca E, Ribera J, Ribera JM. Acute lymphoblastic leukemia of T progenitors: From biology to clinics[J]. Med Clin (Barc),2015, 144 (5) : 223-9. DOI: 10.1016/j.medcli.2014.01.029. |
| [6] | Cardoso B, Almeida SD, Laranjeira A, et al. TAL1/SCL is downregulated upon histone deacetylase inhibition in T-cell acute lymphoblastic leukemia cells[J]. Leukemi,2011, 25 (8) : 1578-86. |
| [7] | Wilson NK, Miranda-Saavedra D, Kinston SA, et al. The transcriptional program controlled by the stem cell leukemia gene Scl/Tal1 during early embryonic hematopoietic development[J]. Blood,2009, 113 (22) : 5456-65. DOI: 10.1182/blood-2009-01-200048. |
| [8] | Kurukuti S, Saffrey P. Chromatin looping defines expression of TAL1, its flanking genes and regulation in T-ALL[J]. Blood,2013, 122 (26) : 4199-209. DOI: 10.1182/blood-2013-02-483875. |
| [9] | Benyoucef A, Calvo J, Renou L, et al. The SCL/TAL1 transcription factor represses the stress protein DDiT4/REDD1 in human hematopoietic stem/progenitor cells[J]. Stem Cells,2015, 33 (7) : 2268-79. DOI: 10.1002/stem.2028. |
| [10] | Chagraoui H, Kassouf M, Banerjee S, et al. SCL-mediated regulation of the cell-cycle regulator p21 is critical for murine megakaryopoiesis[J]. Blood,2011, 118 (3) : 723-35. DOI: 10.1182/blood-2011-01-328765. |
| [11] | Dey S, Curtis DJ, Jane SM, et al. The TAL1/SCL transcription factor regulates cell cycle progression and proliferation in differentiating murine bone marrow monocyte precursors[J]. Mol Cell Biol,2010, 30 (9) : 2181-92. DOI: 10.1128/MCB.01441-09. |
| [12] | Lacombe J, Herblot S, Rojas-Sutterlin SA, et al. SCL regulates the Quiescence and the Long-Term Competence of Hematopoietic Stem Cells[J]. Blood,2009, 114 (22) : 993. |
| [13] | Cicenas J, Kalyan K, Sorokinas A, et al. Highlights of the latest advances in research on CDK inhibitors[J]. Cancers (Basel),2014, 6 (4) : 2224-42. DOI: 10.3390/cancers6042224. |
| [14] | Kumari P, Pincha N. Inhibition of non-muscle myosin II leads to G0/ G1 arrest of Wharton's jelly-derived mesenchymal stromal cells[J]. Cytotherapy,2014, 16 (5) : 640-52. DOI: 10.1016/j.jcyt.2013.09.003. |
| [15] | Omura-Minamisawa M, Diccianni MB, Batova A, et al. Universal inactivation of both p16 and p15 but not downstream components is an essential event in the pathogenesis of T-cell acute lymphoblastic leukemia[J]. Clin Cancer Res,2000, 6 (4) : 1219-28. |
| [16] | Palii CG, Perez-Iratxeta C, Yao Z, et al. Differential genomic targeting of the transcriptionfactor TAL1 in alternate haematopoietic lineages[J]. EMBO J,2011, 30 . |
| [17] | Ferrando AA, Neuberg DS, Staunton J, et al. Gene expression signatures define novel oncogenic pathways in T cell acute lymphoblastic leukemia[J]. Cancer Cell,2002, 1 (1) : 75-87. DOI: 10.1016/S1535-6108(02)00018-1. |
 2016, Vol. 36
2016, Vol. 36

