2. 南方医科大学公共卫生与热带医学学院微生物学系, 广东 广州 510515 ;
3. 陕西省安康市疾病预防控制中心, 陕西 安康 725000
2. Department of Microbiology, School of Public Health and Tropical Medicine, Southern Medical University, Guangzhou 510515, China ;
3. Center for Disease Control and Prevention of Ankang, Ankang 725000, China
近年来,磷脂酰胆碱(PC)作为病原菌的一种重要 致病因子受到越来越多的重视。有文献报道PC不仅有 助于流感嗜血杆菌在呼吸道中持续存在,促进其粘附并侵入支气管上皮细胞[1-3],PC在体内和体外还与其生物 膜的成熟有关,可以使其生物膜密度增厚[4]。PC阳性的 流感嗜血杆菌导致渗出性中耳炎的持续性存在,愈合时 间延长[5]。
在口腔中的研究发现,PC在伴放线放线杆菌(Aa) 的致病过程中亦起到了重要作用[6-8]。龈沟液中PC抗体 水平明显高于血清中的水平。牙周附着丧失患者的PC 抗体水平明显高于牙周健康者。血清中的抗PC抗体可 能对携带PC 的Aa 菌株起到一定的调理素作用。Schenkein 等[9]还发现携带PC 的Aa 菌株与不携带PC 的Aa 菌株致病力有明显差异。他们通过透射电镜观 察到带有PC 的Aa 菌株可以侵入血管内皮细胞,而不 带有PC 的菌株不能侵入血管内皮细胞,可见PC可能 是Aa的重要致病因子。
目前PC在大部分病原菌的致病过程中的机制尚不 十分清楚,有文献报道,PC可能是通过细菌细胞壁的胆 碱成分通过与内皮细胞表面的血小板活化因子受体 (PAFR)结合来介导的[10-11]。血小板活化因子(PAF)中 含有磷脂酰胆碱成分,当细菌与宿主细胞作用时,细菌 中的磷脂酰胆碱通过模拟PAF,与PAFR结合,从而介导 细菌对宿主细胞的黏附和侵袭。然而关于PC如何在 Aa致病过程中起作用,PAFR是否参与了PC阳性Aa黏 附、侵袭宿主细胞的过程的鲜有文献报道,在本实验中 我们拟选用人脐静脉血管内皮细胞(HUVEC),建立体 外模型,研究PAFR 在PC 阳性Aa 菌株对HUVEC的 黏附和侵袭过程中的作用。
1 材料和方法 1.1 细胞株和细菌株PC 阳性Aa 菌株(HK1651:美国ATCC);PC 阴性 Aa菌株(ATCC29523:广东省微生物菌种保藏中心)。 人脐静脉血管内皮细胞(Human Umbilical Vein Endothelia Cell,HUVEC):购自中科院上海细胞所细 胞库。
1.2 主要试剂DMEM 培养基、胎牛血清、0.25% EDTA/胰酶均购 自Hyclone;二甲基亚砜(DMSO)购自北京鼎国昌盛生 物技术有限公司;噻唑蓝(MTT)、血小板活化因子受体 拮抗剂(CV-3988)购自Sigma;血小板活化因子受体抗 (anti-PAFR)购自药明康德新药开发有限公司。
1.3 细菌的黏附侵袭实验 1.3.1 细胞的准备将冻存的HUVEC复苏后至少传代 2次,将细胞以1×105/孔的浓度接种于24 孔细胞培养板 中,5% CO2,37 ℃孵育24 h,待长满细胞单层。实验前 用DMEM 培养基清洗3 次,分别加入含CV-3988(终浓 度分别为50、100、200、500 nmol/L)、PAFR 单克隆抗体 (终浓度为2.5 μg/mL)及TEPC-15(终浓度为2.5 μg/mL) 的完全培养基,作用30 min。
1.3.2 细菌的准备将PC 阳性和阴性菌株复苏后分别 倍比稀释接种到AAGM 平板上,5% CO2,37 ℃厌氧培 养3~5 d。先在平板上挑取细菌单克隆,以100∶1 接种 到脑心浸液培养基中,摇床37 ℃,250 r/min,摇12 h。 第2 天再把摇好的菌液取1~2 mL的脑心浸液培养基 中,同样条件继续摇12 h。实验前将菌液浓度调整到1× 109 cfu/Ml,备用。
1.4 细菌的体外黏附实验将细菌按照100∶1(MOI=100)的比例加入到每孔 细胞中去,37 ℃,5 % CO2孵育4 h,去掉培养基,1×PBS 清洗3 次,加入150 μL 0.5%Triton-X100,37 ℃孵育 15 min,然后加入350 μL去离子水,37 ℃孵育10 min,轻柔吹打混匀,取100 μL样品倍比稀释涂布AAGM平 板计算菌落数,作为黏附到细胞的细菌数。
1.5 细菌的体外侵袭实验将细菌按照100∶1 的比例加到每孔细胞,37 ℃,5% CO2孵育4 h,用1×PBS 清洗3 次,每孔加入1 mL 完全培养基,再加入终浓度为200 μg/mL的庆大霉素 37 ℃孵育2 h,杀死细胞外细菌,1×PBS清洗3次,加入 150 μL 0.5%Triton-X100,37 ℃孵育15 min,然后加入 350 μL去离子水,37 ℃孵育10 min,轻柔吹打混匀,取 100 μL样品倍比稀释涂AAGM平板计算菌落数,作为 侵袭到细胞内的细菌数。
黏附实验和侵袭实验3组菌各设3个复孔,重复实 验3次。设置对照组:不加处理剂组。
黏附率= 处理组黏附到细胞的细菌数/未处理组黏 附到细胞的细菌总数×100%
侵袭率= 处理组侵入细胞内的细菌数/未处理组侵 入细胞内的细菌总数×100%
1.6 MTT法检测细菌对细胞的活力影响 1.6.1 细胞的处理实验前1 d,将培养瓶里的细胞用 0.25%胰酶消化后计数,调整细胞悬液浓度,以1×105 个 细胞/孔的浓度接种于96孔板,5% CO2,37 ℃孵育。待 细胞贴壁后,分别加入CV-3988(终浓度分别为10、20、 50、100、200 nmol/L)及PAFR 单克隆抗体(终浓度为 2.5 μg/mL),作用30 min。
1.6.2 细菌的处理细菌的处理方法及步骤如上所述,调整细菌浓度为1×108 cfu/mL,取稀释好的菌液1 mL,8000 r/min离心5 min,弃掉上清,加入1 mL PBS重悬,离心3 次,取1 mL DMEM 培养基重悬,取100 μL (MOI=100)加入各孔中。5% CO2,37 ℃继续孵育12 h。 每孔加入MTT(5 g/L)20 μL,继续培养4 h,终止培养,小心吸去孔内培养液,每孔加入150 μL DMSO,置摇 床上低速振荡10 min,使结晶物充分溶解。置于酶联 免疫检测仪,选择490 nmol/L 处波长,空白孔调零,测 定各孔吸光度值(A),各组A值取平均值后,以下公 式计算存活细胞百分数,存活细胞%=A实验组/A 对 照组×100%。
每组同时设置调零孔(DMEM培养基)及对照组 (未加细菌菌液组),每组设定3个复孔,重复实验3次。
1.7 统计学处理数据均表示为均数±标准差,与常数组之间的比较 采用单样本t检验,用Bonferroni法校正检验水准;多组间比较采用单因素方差分析,不同处理组之间的两两比 较,方差齐时采用LSD法,方差不齐时采用Dunnett's T3 法。相关性分析采用Spearman 法。P<0.05 认为差异 有统计学意义。数据分析采用SPSS 13.0软件。
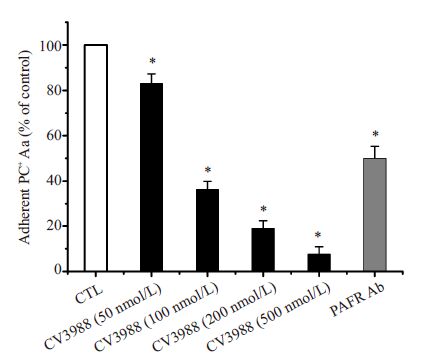
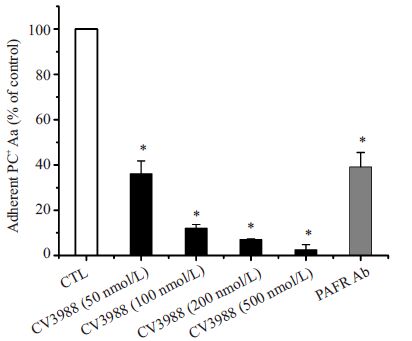
2 结果 2.1 PAFR对细菌黏附侵袭的影响为了研究PAFR是否参与了Aa对HUVEC的黏附 和侵袭过程,我们将HUVEC用PAFR拮抗剂(CV3988) 和抗PAFR抗体预处理30 min后,研究PC阳性Aa的黏 附率和侵袭率。经过对数据的统计分析我们发现,当 PAFR拮抗剂的浓度达到100 nmol/L时即可以显著的 减少Aa 对HUVEC 的黏附(36.29 ± 3.52)%和侵袭 (12.12±1.58)%(P<0.05)。同时根据相关性分析,黏附 率和侵袭率与CV3988的浓度均呈显著负相关(黏附率 r=-0.972,P=0.000;侵袭率r=-0.972,P=0.000),随着 PAFR拮抗剂浓度的升高,Aa对细胞的黏附率和侵袭率 逐渐下降,200 nmol/L时的黏附率和侵袭率分别降低为 对照组的(19.04±3.35)%和(7.08±0.29)%。当PAFR拮 抗剂的浓度为500 nmol/L 时,Aa 几乎不能够对 HUVEC进行黏附(7.69±3.19)%和侵袭(2.60±2.26)%,如图 1和图 2所示。
|
图 1 PC阳性Aa的相对黏附率 Figure 1 Relative adhesion of PC-positive Aa in cultured HUVECs (%,Mean±SD). The adhesion of Aa differed significantly between pretreated and unpretreated cells (*P<0.05) |
|
图 2 PC阳性Aa的相对侵袭率 Figure 2 Relative invasion of PC-positive Aa in cultured HUVECs (%,Mean±SD). The invasion rates differed significantly between pretreated and unpretreated cells (*P<0.05) 中文注解 英文注解 |
同样,用抗PAFR抗体预处理HUVEC后,与对照 组相比,Aa对HUVEC的黏附率和侵袭率均有显著的降 低,分别为(50.05±5.28)%和(39.09±6.50)%,明显的阻 止了Aa对宿主细胞的黏附和侵入(图 2)。
2.2 PAFR参与细菌诱导细胞损伤的研究为了研究PAFR是否参与了PC 阳性的Aa诱导的 细胞损伤的过程,我们将PAFR拮抗剂(CV3988)和抗 PAFR抗体作用于细胞后,采用MTT法分别分析了PC 阳性和阴性的Aa诱导的细胞损伤情况。
我们首先对HUVEC在不同的处理剂中的存活率 进行了分析,将结果进行统计学分析,发现HUVEC在 各种浓度的处理剂中的存活率无明显差异(P>0.05),如 表 1所示。从而排除了因处理剂对细胞的影响而引起 的各组间细胞存活率的差异。
| 表 1 无菌组细胞存活率(%)的比较 Table 1 Cell viability of HUVECs (%) treated with different concentrations of CV3988 (n=3,Mean±SD) |
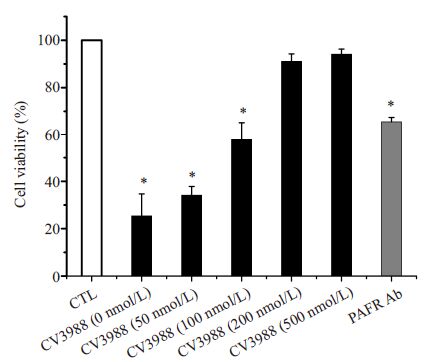
在PC 阳性的Aa 组,我们发现,各组间细胞存活 率有显著差异(F=87.749,P<0.001),用200 nmol/L 和 500 nmol/L 的PAFR拮抗剂和25 μg/mL抗PAFR抗体 预处理HUVEC后,细胞的存活率显著升高,从(25.39± 9.33)%分别升高到(91.12±3.14)%,(94.12±2.15)%和 (65.5±1.87)%(图 3)。对数据进行相关分析,细胞的存 活率与PAFR 拮抗剂之间存在显著正相关关系(r=0.938,P=0.000)由此可见,PAFR拮抗剂和抗PAFR抗 体有效的阻止了PC阳性的Aa诱导的细胞死亡。
|
图 3 PC阳性组细胞存活率 Figure 3 Cell viability of pretreated HUVECs after incubation with PC-positive Aa by MTT assay (Mean± SD). *P<0.05 vs CTL. |
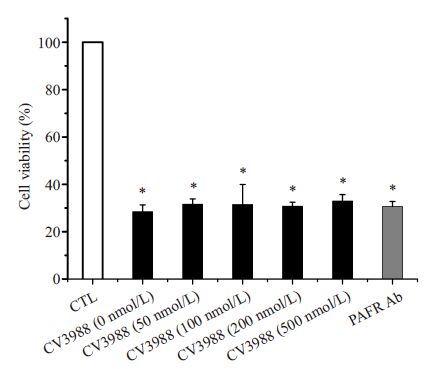
我们同时对PC 阴性的Aa 进行了研究及分析证 实了这一结果(图 4)。通过对预处理和未预处理组 进行相比,各组之间无统计学差异(F=0.437,P= 0.799),说明PC阴性的Aa感染HUVEC后,细胞存活 率并没有显著增加。对数据进行相关分析显示,细 胞存活率与PAFR拮抗剂之间无相关性(r=0.350,P= 0.200)。
|
图 4 PC阴性组细胞存活率 Figure 4 Cell viability of pretreated HUVECs following incubation with PC-negative Aa by MTT assay (Mean ± SD). *P>0.05 |
对宿主细胞的黏附和侵袭是各种病原菌发挥致病 作用的关键环节。目前认为Aa 侵入宿主细胞的过程是一个动态的、多步骤的、复杂的过程,Aa 在进入宿主细 胞的过程受到细胞表面受体的介导及调控[19-20]。
PAFR 属于G 蛋白偶联受体家族,通过与血小板活 化因子(PAF)结合介导细胞的内吞作用。Barbier 等[21] 报道PC 与PAFR 结合后可介导铜绿假单胞菌定植在 呼吸道上皮细胞。Schenkein等[9]曾经提出PC 阳性的 Aa 菌株对HUVEC 的黏附和侵袭可能也是通过PAFR 介导的。为此,我们在本实验中对PAFR是否介导了PC 阳性Aa的黏附侵袭过程进行了研究。我们在培养基中 加入PAFR 拮抗剂CV-3988,然后观察到当PAFR受到 抑制后Aa 对细胞的黏附和侵袭发生了明显下降,当 CV-3988 的浓度升高到一定程度时,几乎完全阻止了 Aa 对HUVEC的黏附和侵袭。为了进一步验证PAFR 参与了Aa 对HUVEC的黏附和侵袭,我们利用PAFR 抗体对PAFR进行了抑制,同样发现PAFR受到抑制后,Aa 的黏附、侵袭及细胞活力均受到了明显影响。这与 Smani等[22]的研究相似,PAFR介导了鲍氏不动杆菌对 人肺上皮细胞的黏附和侵袭的过程。
Smani 等[22-23]在实验中发现鲍氏不动杆菌表面的 PC与人肺上皮细胞表面的PAFR结合,引起一系列下游 信号通路的激活,完成细菌的内吞或跨膜过程,最终导 致了宿主细胞的死亡。我们在实验中检测了PAFR受 到抑制后Aa对细胞活力的影响,同样发现未处理组细 胞活力明显降低,可见PAFR受到抑制后,明显降低了 Aa对细胞的毒力作用。因此我们推测,当Aa 接触到 HUVEC 后,其表面的PC可能与细胞表面的PAFR结 合,从而传递信号给细胞膜,诱发一系列下游信号系统 的级联反应,使得Aa 对宿主细胞进行侵袭和杀伤,最终 导致了宿主细胞的死亡。
综上所述,本研究发现PAFR介导了Aa黏附和侵 袭HUVEC的过程。由于PAFR存在于多种内皮细胞和 上皮细胞表面,包括牙周黏膜上皮细胞等,因此,PAFR 可能同样介导了Aa对牙周组织的入侵过程,这为我们 研究Aa 在牙周病中的致病机制提供了新的思路。
| [1] | Swords WE, Buscher BA, Ver Steeg Ii K, et al. Non-typeable Haemophilus influenzae adhere to and invade human bronchial epithelial cells via an interaction of lipooligosaccharide with the PAF receptor[J]. Mol Microbiol,2000, 37 (1) : 13-27. DOI: 10.1046/j.1365-2958.2000.01952.x. |
| [2] | Krishnamurthy A, Kyd J. The roles of epithelial cell contact, respiratory bacterial interactions and phosphorylcholine in promoting biofilm formation by Streptococcus pneumoniae and nontypeable Haemophilus influenzae[J]. Microbes Infect,2014, 16 (8) : 640-7. DOI: 10.1016/j.micinf.2014.06.008. |
| [3] | Puig C, Marti S, Hermans PW, et al. Incorporation of phosphorylcholine into the lipooligosaccharide of nontypeable Haemophilus influenzae does not correlate with the level of biofilm formation in vitro[J]. Infect Immun,2014, 82 (4) : 1591-9. DOI: 10.1128/IAI.01445-13. |
| [4] | Hong W, Pang B, West-Barnette S, et al. Phosphorylcholine expression by nontypeable Haemophilus influenzae correlates with maturation of biofilm communities in vitro and in vivo[J]. J Bacteriol,2007, 189 (22) : 8300-7. DOI: 10.1128/JB.00532-07. |
| [5] | Fujita K, Hirano T, Kodama S, et al. Prognostic impact of phosphorylcholine expression in nontypeable Haemophilus influenzae in otitis media with effusion[J]. Acta Otolaryngol,2009, 129 (8) : 832-8. DOI: 10.1080/00016480802468195. |
| [6] | Schenkein HA, Gunsolley JC, Best AM, et al. Antiphosphorylcholine antibody levels are elevated in humans with periodontal diseases[J]. Infect Immun,1999, 67 (9) : 4814-8. |
| [7] | Schenkein HA, Berry CR, Purkall D, et al. Phosphorylcholinedependent cross-reactivity between dental plaque bacteria and oxidized low-density lipoproteins[J]. Infect Immun,2001, 69 (11) : 6612-7. DOI: 10.1128/IAI.69.11.6612-6617.2001. |
| [8] | Purkall D, Tew JG, Schenkein HA. Opsonization of actinobacillus actinomycetemcomitans by immunoglobulin G antibody reactive with phosphorylcholine[J]. Infect Immun,2002, 70 (11) : 6485-8. DOI: 10.1128/IAI.70.11.6485-6488.2002. |
| [9] | Schenkein HA, Barbour SE, Berry CR, et al. Invasion of human vascular endothelial cells by Actinobacillus actinomycetemcomitans via the receptor for platelet-activating factor[J]. Infect Immun,2000, 68 (9) : 5416-9. DOI: 10.1128/IAI.68.9.5416-5419.2000. |
| [10] | Krishnamurthy S, Behlke MA, Apicella MA, et al. Platelet activating factor receptor activation improves siRNA uptake and RNAi responses in well-differentiated airway epithelia[J]. Mol Ther Nucleic Acids,2014, 3 (8) : e175. |
| [11] | Gerber J, Redlich S, Ribes S, et al. Intrathecal treatment with the anti-phosphorylcholine monoclonal antibody TEPC-15 decreases neuronal damage in experimental pneumococcal meningitis[J]. Chemotherapy,2012, 58 (3) : 212-6. DOI: 10.1159/000337287. |
| [12] | Gilley RP, Orihuela CJ. Pneumococci in biofilms are non-invasive: implications on nasopharyngeal colonization[J]. Front Cell Infect Microbiol,2014, 4 (7) : 163. |
| [13] | Bougnères L, Girardin SE, Weed SA, et al. Cortactin and Crk cooperate to trigger actin polymerization during Shigella invasion of epithelial cells[J]. J Cell Biol,2004, 166 (2) : 225-35. DOI: 10.1083/jcb.200402073. |
| [14] | Patel JC, Galán JE. Manipulation of the host actin cytoskeleton by Salmonella-all in the Name of entry[J]. Curr Opin Microbiol,2005, 8 (1) : 10-5. DOI: 10.1016/j.mib.2004.09.001. |
| [15] | Kwok T, Backert S, Schwarz H, et al. Specific entry of Helicobacter pylori into cultured gastric epithelial cells via a zipper-like mechanism[J]. Infect Immun,2002, 70 (4) : 2108-20. DOI: 10.1128/IAI.70.4.2108-2120.2002. |
| [16] | Cossart P, Veiga E. Non-classical use of clathrin during bacterial infections[J]. J Microsc,2008, 231 (3) : 524-8. DOI: 10.1111/jmi.2008.231.issue-3. |
| [17] | Imamura K, Kokubu E, Kita D, et al. Cigarette smoke condensate modulates migration of human gingival epithelial cells and their interactions with Porphyromonas gingivalis[J]. J Periodontal Res,2015, 50 (3) : 411-21. DOI: 10.1111/jre.2015.50.issue-3. |
| [18] | Gutiérrez-Venegas G, Kawasaki-Cárdenas P, Garcés CP, et al. Actinobacillus actinomycetemcomitans adheres to human gingival fibroblasts and modifies cytoskeletal organization[J]. Cell Biol Int,2007, 31 (9) : 1063-8. DOI: 10.1016/j.cellbi.2007.03.028. |
| [19] | Meyer DH, Fives-Taylor PM. The role of Actinobacillus actinomycetemcomitans in the pathogenesis of periodontal disease[J]. Trends Microbiol,1997, 5 (6) : 224-8. DOI: 10.1016/S0966-842X(97)01055-X. |
| [20] | Meyer DH, Rose JE, Lippmann JE, et al. Microtubules are associatciated with intracellular movement and spread of the periodontopathogen Actinobacillus actinomycetemcomitans[J]. Infect Immun,1999, 67 (12) : 6518-25. |
| [21] | Barbier M, Oliver A, Rao J, et al. Novel phosphorylcholinecontaining protein of Pseudomonas aeruginosa chronic infection isolates interacts with airway epithelial cells[J]. J Infect Dis,2008, 197 (3) : 465-73. DOI: 10.1086/586912. |
| [22] | Smani Y, Docobo-Pérez F, López-Rojas R, et al. Platelet-activating factor receptor initiates contact of Acinetobacter baumannii expressing phosphorylcholine with host cells[J]. J Biol Chem,2012, 287 (32) : 26901-10. DOI: 10.1074/jbc.M112.344556. |
| [23] | Smani Y, Docobo-Pérez F, Mcconnell MJ, et al. Acinetobacter baumannii-induced lung cell death: role of inflammation, oxidative stress and cytosolic calcium[J]. Microb Pathog,2011, 50 (5) : 224-32. DOI: 10.1016/j.micpath.2011.01.008. |
 2016, Vol. 36
2016, Vol. 36

