羊痘病毒(Orf virus,ORFV)是一种亲上皮的副痘病毒,其宿主范围窄,仅限于绵羊和山羊,主要感染皮肤黏膜区域,不会引起全身性病毒播散[1]。羊痘病毒IA82(OV-IA82)为1982年爱荷华洲爆发的羊痘疮疾病中分离所得[2],其132基因(ORFV132)表达血管内皮生长因子(VEGF)[3],可以与血管内皮生长因子受体2(KDR)结合,促进血管内皮细胞增殖,增加血管通透性,引起充血水肿的炎症反应,是主要的致病性基因[4-5],但是该基因的位置非常适合表达外源抗原[6-9]。本研究的目标是在减毒羊痘病毒IA82△121[10]的基础上,敲除132基因,以构造高度减毒的外源基因表达载体IA82△121-V。然而,传统重组病毒筛选方法主要是新霉素抵抗和β-葡萄糖醛酸苷酶(neomycin resistance and β-glucuronidase,neo/gusA)蓝白斑筛选[11],该方法不易把握,操作麻烦,且耗时长。本研究利用绿色荧光蛋白(GFP)为报导基因,通过绿色荧光信号即可快速筛选出重组体IA82△121-V,极大地缩短了实验时间,加快了实验进程。
1 材料和方法 1.1 材料 1.1.1 病毒、细胞和质粒羊痘病毒IA82(40019122),减毒病毒株IA82△121、原代羊胚胎鼻甲细胞(Primaryovine fetal turbinate,OFTu)、质粒pSPV-EGFP 由南方医科大学生物技术学院实验室提供。人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购于澳赛尔斯生物技术有限公司。
1.1.2 主要试剂Top10菌株由南方医科大学细胞生物学教研室提供。病毒DNA提取试剂盒、PCR产物回收试剂盒、胶回收纯化试剂盒、DNA连接酶、限制性内切酶均购于TaKaRa公司。胎牛血清(Fetal bovine serum,FBS)、基础培养基(Minimum essential medium,MEM)、0.25%胰酶、转染试剂Lipofectamine 2000 等购于Life公司。低熔点琼脂糖购于Lonza公司,其它试剂均为进口分装或国产分析纯。
1.1.3 引物设计利用primer5.0 软件设计ORFV132、ORFV132左侧同源臂和右侧同源臂以及GFP引物,引物序列见表 1。引物由上海生工生物工程技术服务有限公司合成。
| 表 1 核苷酸引物和限制性内切酶 Table 1 Oligonucleotide primers and restriction enzymes |
按照试剂盒说明提取病毒IA82△121核酸。取核酸溶液2 μL,加入48 μL PCR反应混合液(含PrimeSTAR GXLDNA Polymerase 1 μL,Sense primer(132L-F 和132RF)1 μL,Anti-sense primer(132R-F和132R-R)1 μL,5×PrimeSTAR GXL Buffer 10 μL,dNTP Mixture 4 μL,DMSO 2.5 μL,Autoclaved distilled water 28.5 μL),采用降落PCR,反应条件如下:98 ℃预变性5 min,30个循环(98 ℃变性30 s,68 ℃退火30 s ,之后每一个循环降低0.5 ℃,72 ℃延伸1 min),10 个循环(98 ℃ 30 s,59 ℃ 30 s,72 ℃ 1 min),最后72 ℃ 10 min。1%琼脂糖凝胶电泳分析。
1.2.2 穿梭质粒的构建ORFV132左右同源臂的基因片段经纯化后,先用NsiⅠ和BglⅡ同时酶切ORFV132右侧同源臂的基因片段和pSPV-EGFP质粒,经DNA连接酶16 ℃作用1 h,转化宿主菌Top10,PCR、酶切及基因测序鉴定筛选pSPV-EGFP-132RF阳性克隆,并用试剂盒提取pSPV-EGFP-132RF 质粒。然后再用SpeⅠ和Stu Ⅰ酶切132 基因左侧同源臂的基因片段以及pSPV-EGFP-132RF 质粒,以上述相同的方法构建pSPV-132LF-EGFP-132RF质粒。
1.2.3 重组病毒体筛选(1) 细胞转染及同源重组:稀释羊痘病毒IA82△121,按感染复数(multiplicity ofinfection,MOI)为1 感染OFTu 细胞,根据标准的体外同源重组实验步骤[12]将质粒转染入OFTu细胞内,转染试剂使用Lipofectamine 2000。48 h 后,收集病毒液;(2)重组病毒体初筛:将上述收集的病毒液进行10-1~10-11稀释,加入96微孔板中,24 h后,观察荧光,刮取104以上稀释倍数的强荧光细胞,反复冻融细胞,收集病毒液,并进行下一轮96微孔板实验;(3)蚀斑实验:约2~3轮96微孔板有限稀释后,以6孔培养板蚀斑实验进一步分离纯化,具体操作步骤见参考文献[13]。经过3轮蚀斑筛选,将最后一轮收集的病毒进行扩大培养,提取核酸,进行PCR和基因测序验证。
1.2.4 PCR及基因测序验证按照试剂盒提取重组病毒IA82△121-V核酸。反应体系:DNA溶液2 μL ,48 μLPCR 反应混合液(Premix Taq 25 μL,Sense primer(132-F 和GFP-F)1 μL,Anti-sense primer(132-R 和GFP-R)1 μL,Autoclaved distilled water 21 μL),反应条件:94 ℃预变性3 min 后,30 个循环(94 ℃ 30 s,60 ℃30 s,72 ℃ 60 s),72 ℃延伸10 min。1%琼脂糖凝胶电泳分析并将PCR产物测序验证(上海生工生物工程技术服务有限公司)。
1.2.5 不同病毒滴度、细胞病变及蚀斑形态对比实验(1) 病毒滴度:将重组病毒IA82△121-V扩大培养,收集病毒液,利用之前建立的实验方法[10],用多步和一步生长曲线法比较重组体IA82△121-V的体外生长复制特性与羊痘病毒IA82、IA82△121的差异性,并用单向方差分析进行数据统计分析;(2)比较细胞病变及蚀斑形态:按MOI=10,用3 种不同的病毒IA82、IA82△121、IA82△121-V 分别感染OFTu 细胞,同时设置阴性对照,在显微镜下比较细胞病变形态,具体操作步骤见参考文献[14]。
1.2.6 HUVEC增殖实验按MOI=1,分别用IA82、IA82△121、IA82△121-V感染OFTu细胞,并设置PBS模拟病毒感染组,24 h 后,收集不同病毒的OFTu 细胞培养上清液,观察其促HUVECs增殖能力,具体操作步骤见参考文献[15],计算增殖指数=实验组的增殖系数/标准对照组的增殖系数,用单向方差分析进行数据统计分析。
2 结果 2.1 降落PCR扩增ORFV132左右同源臂经过降落PCR扩增后,凝胶电泳分析结果显示,ORFV132左右同源臂在约1 kp处有一特异亮带,其大小与目的片段相符(图 1)。
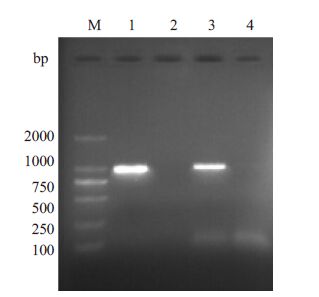
|
图 1 羊痘病毒IA82型132基因左侧同源臂和右侧同源臂的扩增 Figure 1 Amplification products of the flankingregions of ORFV132 by PCR. M: DL2000 DNAMarker; 1,3: Left and right flanking regions ofthe ORFV132,respectively; 2,4: Negative control |
ORFV132左右同源臂的PCR产物按先后顺序定向插入pSPV-EGFP质粒中,分别获得pSPV-EGFP-132RF质粒及pSPV-132LF-EGFP-132RF质粒。pSPV- EGFP-132RF和pSPV-132LF-EGFP-132RF质粒经PCR 、酶切和基因测序鉴定,均与预期结果吻合(图 2,表 2)。
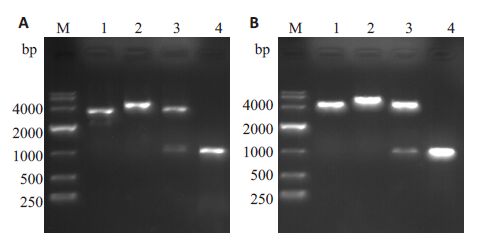
|
图 2 穿梭质粒pSPV-EGFP-132RF 和pSPV-132LF-EGFP-132RF的PCR和酶切鉴定 Figure 2 Identification of the shuttle plasmids pSPV-EGFP-132RF and pSPV-132LF-EGFP-132RF by PCR and restrictionenzyme analysis. A: pSPV-EGFP-132RF (4.5 kb). M: DL10000DNA Marker; 1: pSPV-EGFP (3.5 kb); 2: Digestion with BglII;3: Digestion with BglII and NSiI; 4: Right flanking region ofORFV132 (1 kb); B: pSPV-132LF-EGFP-132RF (5.5 kb). M:DL10000 DNA Marker; 1: pSPV-EGFP-132RF (4.5 kb); 2:Digestion with SpeI; 3: Digestion with SpeI and StuI ; 4: Leftflanking regions of ORFV132 (1 kb). |
| 表 2 比较pSPV-EGFP 和pZIPPY-neo/gus两种标记方法获取重组羊痘病毒的差异性 Table 2 Comparison of rORFVs obtained using the pSPV-EGFP and pZIPPY-neo/gus vectors |
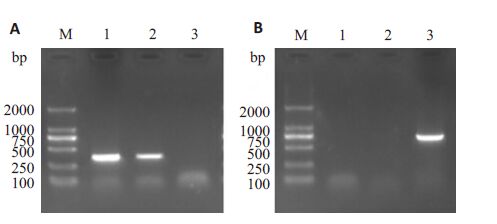
经过2轮96微孔板稀释和3轮6孔板蚀斑纯化后,成功筛选出重组病毒IA82△121-V,经扩大培养,在倒置荧光显微镜下观察到大量荧光信号(图 3),收集病毒液,提取核酸,经过PCR验证,ORFV132已敲除并且检测到GFP基因(图 4),与测序结果一致。
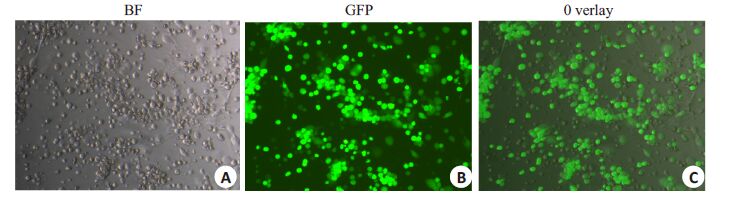
|
图 3 通过倒置荧光显微镜观察IA82△121-V感染后的OFTu细胞病变 Figure 3 Fluorescent microscopy showing the cytopathic effects (CPE) of OFTu cells infected withIA82 △ 121-V. A: CPE observed by bright-field microscopy (Original magnification: × 100); B:Blue-field microscopy of the same field in A; C: Merged image |
|
图 4 通过PCR 验证病毒IA82、IA82 △121 and IA82 △121-V中ORFV132及GFP的存在情况 Figure 4 PCR detection of ORFV132 and GFP gene in IA82,IA82△ 121and IA82 △ 121-V. A: PCR to confirm the absence ofORFV132; B: PCR to confirm the presence of GFP. M:DL2000 DNAMarker; 1: IA82; 2: IA82△121; 3: IA82△121-V. |
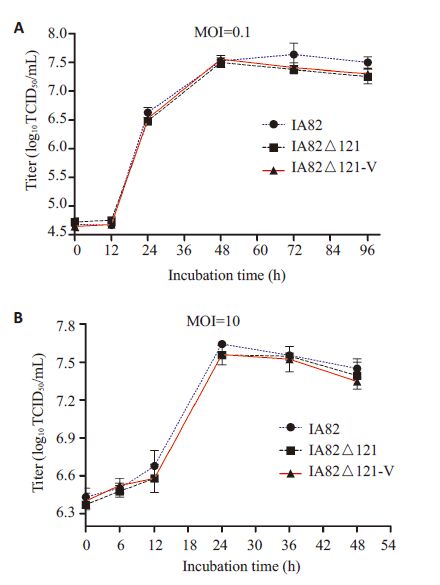
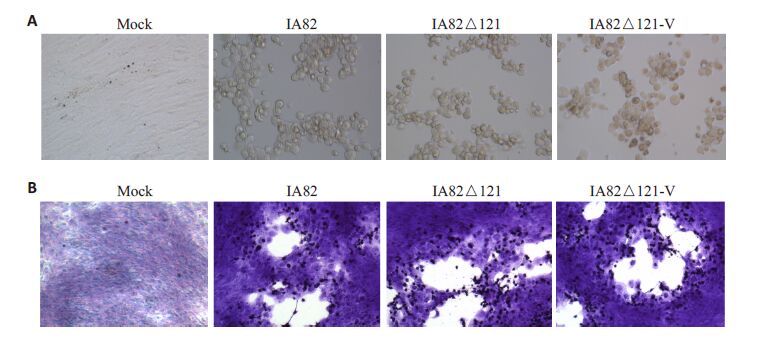
(1)不同病毒滴度的数据统计结果表明羊痘病毒IA82△121-V和IA82及IA82△121的感染复制能力无显著性差异(P>0.05),3种病毒的生长趋势一致,无显著性差异(图 5)。该结果与国外的实验报导相符[5, 16];(2)在显微镜下,IA82、IA82△121、IA82△121-V 感染的OFTu 细胞病变无显著性差异,其形态均由梭形细胞变成扁圆形细胞(图 6A),3种病毒的噬斑形状和大小无显著性差异,空白斑上残留的感染细胞均呈扁圆形(图 6B)。
|
图 5 重组羊痘病IA82△121-V的体外生长复制特点 Figure 5 Multi-step (A) and one-step (B) growth curvesof OFTu cells infected with wild-type (IA82),attenuated mutant (IA82 △ 121),and highlyattenuated mutant (IA82△121-V) virus. |
|
图 6 羊痘病毒IA82、IA82△121、IA82△121-V感染OFTu细胞后的病变形态和蚀斑形态 Figure 6 CPE and plaque morphology of orf virus IA82、IA82△121、IA82△121-V in OFTu cells. A: CPE ofthe orf viruses at 48 h after infection (MOI=10) (Original magnification: ×200); B: Plaque morphologyof the orf viruses at 72 h after infection. The cells were fixed with formaldehyde (4.0%) and stainedwith 1% crystal violet (Original magnification: ×100). |
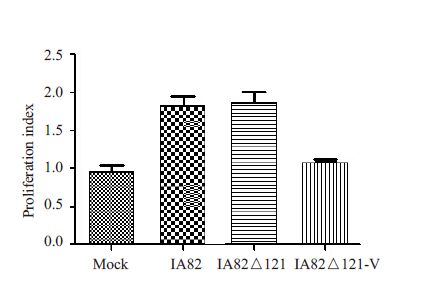
根据数据统计分析,4种滤液(PBS、IA82、IA82△121、IA82△121-V)促血管内皮细胞增殖能力不同,差异具有统计学意义(P<0.05)。实验发现,未敲除ORFV132的羊痘病毒IA82、IA82△121均可以促进HUVECs增殖,其增殖指数约为对照组的2倍,缺失ORFV132的重组体IA82△121-V促HUVECs增殖能力明显下降,与对照组无显著差别(图 7),该结果与国外的实验报导相符[5, 15]。
|
图 7 羊痘病毒IA82、IA82△121、IA82△121-V 的OFTu细胞培养液促人脐静脉内皮细胞增殖能力 Figure 7 Proliferation of HUVECs stimulated withthe culture supernatants from OFTu cells infectedby orf virus IA82,IA82△121 and IA82△121-V. |
GFP 作为一种报告分子,广泛运用于细菌[17]、植物[18]及外科手术[19]等研究,其在蛋白表达检测、蛋白和细胞荧光示踪以及蛋白质的结构及功能研究中具有重要意义。本研究中,我们利用GFP作为报导基因成功筛选出重组病毒IA82△121-V,其ORFV132 的敲除以及GFP的存在已经通过PCR和基因测序验证。在之前的研究中,利用传统的同源重组筛选方法,重组羊痘病毒IA82Δ002 ,IA82Δ024,IA82Δ120,IA82Δ121至少需要17-20轮的蚀斑筛选(每1轮蚀斑需要4~5 d)[13],甚至20轮噬斑筛选仍然无法纯化病毒,如IA82Δ012、IA82Δ113、IA82Δ116[13]。然而,利用绿色荧光蛋白作为报导基因,只需要2 周左右的时间即可分离出目标重组病毒,极大地节约了时间。本实验证实以绿色荧光信号为报导基因的重组病毒筛选方法具有以下优点:直观:通过荧光信号即可以判断同源重组效率的高低,为进行下一轮筛选实验提供参考依据,比传统方法更直观,操作性更强;快速:重组病毒的筛选时间短,蚀斑筛选时间不超过15 d,而传统的蚀斑筛选方法需要3~4 个月的时间;廉价:不需要借助贵重仪器即可分离重组病毒。虽然以GFP为报导基因,借助流式细胞分选仪,可以快速分选出重组病毒,但是流式细胞分选仪价格昂贵,而且病毒分选存在污染问题,因此不易推广使用;科学:利用荧光信号进行蚀斑筛选不需要添加抗生素和反应底物,比传统方法更科学,更经济。
通过体外实验,初步证明ORFV132非羊痘病毒生长复制的必需基因,且外源基因GFP的插入并不会影响病毒感染复制特性,但ORFV132的敲除可以使病毒减少VEGF 的分泌,减轻了病毒的毒力。羊痘病毒的VEGF基因位点非常适合表达不同的外来抗原,国外利用减毒的羊痘病毒D1701-V为载体成功表达了针对疱疹病毒[6]、兔出血热疾病病毒[7]、狂犬病病毒[8]、甲型流感病毒H5N1和H1N1的疫苗[9],其免疫保护作用持久稳定,不需要佐剂即能强力诱导Th1-Th2平衡的先天免疫和获得性免疫反应。短期的羊痘病毒感染不能诱导特异性中和抗体的产生,因此可以使用同一或不同的该病毒重组体反复接种免疫[20]。此外,羊痘病毒只在胞浆中复制,不会插入宿主细胞染色体引起基因突变,是理想的克隆表达载体[21]。目前,商品化的杆状病毒、慢病毒是比较成熟的外源蛋白包装系统,但是,由于慢病毒能整合入染色体,而杆状病毒只能感染昆虫细胞,因此以这两种病毒为载体的疫苗不可用于临床实验。后续研究中,我们将利用高度减毒的羊痘病毒表达载体IA82△121-V,同时表达手足口病EV71 和CA16 的VP1 蛋白,VP1是EV71和CA16的主要抗原表位[22-23]。如果同时针对这两种病毒的双价疫苗研制成功,将来还可能为其它的主流型病毒提供有效的疫苗技术平台。作为一种新型的外源基因表达载体,羊痘病毒的研究仍局限于科研实验阶段,其生物性能需要不断验证。这方面的工作将在后续实验中不断加以完善,从而使羊痘病毒更好地运用于临床疫苗候选物研究。
致谢: 感谢南方医科大学生物技术学院罗树红教授提供羊痘病毒野生株及△121突变株;感谢南方医科大学基础医学院曾位森教授提供Top10。| [1] | Büttner M, Rziha HJ. Parapoxviruses: from the lesion to the viral genome[J]. J Vet Med B Infect Dis Vet Public Health,2002, 49 (1) : 7-16. DOI: 10.1046/j.1439-0450.2002.00539.x. |
| [2] | Delhon G, Tulman ER, Afonso CL, et al. Genomes of the parapoxviruses ORF virus and bovine papular stomatitis virus[J]. J Virol,2004, 78 (1) : 168-77. DOI: 10.1128/JVI.78.1.168-177.2004. |
| [3] | Li W, Hao W, Peng Y, et al. Comparative genomic sequence analysis of Chinese orf virus strain NA1/11 with other parapoxviruses[J]. Arch Virol,2015, 160 (1) : 253-66. DOI: 10.1007/s00705-014-2274-1. |
| [4] | Wise LM, Veikkola T, Mercer AA, et al. Vascular endothelial growth factor (VEGF)-like protein from orf virus NZ2 binds to VEGFR2 and neuropilin-1[J]. Proc Natl Acad Sci USA,1999, 96 (6) : 3071-6. DOI: 10.1073/pnas.96.6.3071. |
| [5] | Savory LJ, Stacker SA, Fleming SB, et al. Viral vascular endothelial growth factor plays a critical role in orf virus infection[J]. J Virol,2000, 74 (22) : 10699-706. DOI: 10.1128/JVI.74.22.10699-10706.2000. |
| [6] | Fischer T, Planz O, Stitz L, et al. Novel recombinant parapoxvirus vectors induce protective humoral and cellular immunity against lethal herpesvirus challenge infection in mice[J]. J Virol,2003, 77 (17) : 9312-23. DOI: 10.1128/JVI.77.17.9312-9323.2003. |
| [7] | Rohde J, Schirrmeier H, Granzow H, et al. A new recombinant Orf virus (ORFV, Parapoxvirus) protects rabbits against lethal infection with rabbit hemorrhagic disease virus (RHDV)[J]. Vaccine,2011, 29 (49) : 9256-64. DOI: 10.1016/j.vaccine.2011.09.121. |
| [8] | Amann R, Rohde J, Wulle U, et al. A new rabies vaccine based on a recombinant ORF virus (parapoxvirus) expressing the rabies virus glycoprotein[J]. J Virol,2013, 87 (3) : 1618-30. DOI: 10.1128/JVI.02470-12. |
| [9] | Rohde J, Amann R, Rziha HJ. New Orf virus (Parapoxvirus) recombinant expressing H5 hemagglutinin protects mice against H5N1 and H1N1 influenza A virus[J]. PLoS One,2013, 8 (12) : e83802. DOI: 10.1371/journal.pone.0083802. |
| [10] | Diel DG, Luo S, Delhon G, et al. Orf virus ORFV121 encodes a novel inhibitor of NF-kappaB that contributes to virus virulence[J]. J Virol,2011, 85 (5) : 2037-49. DOI: 10.1128/JVI.02236-10. |
| [11] | Dvoracek B, Shors T. Construction of a novel set of transfer vectors to study vaccinia virus replication and foreign gene expression[J]. Plasmid,2003, 49 (1) : 9-17. DOI: 10.1016/S0147-619X(02)00154-3. |
| [12] | Earl PL, Moss B, Wyatt LS, et al. Generation of recombinant vaccinia viruses[Z]. John wiley & Sons, Inc, 2001. |
| [13] | Ning Z, Peng Y, Hao W, et al. Generation of recombinant Orf virus using an enhanced green fluorescent protein reporter gene as a selectable marker[J]. BMC Vet Res,2011, 7 : 80. DOI: 10.1186/1746-6148-7-80. |
| [14] | Diel DG, Delhon G, Luo S, et al. A novel inhibitor of the NF- kappa B signaling pathway encoded by the parapoxvirus orf virus[J]. J Virol,2010, 84 (8) : 3962-73. DOI: 10.1128/JVI.02291-09. |
| [15] | Meyer M, Clauss M, Lepple-Wienhues A, et al. A novel vascular endothelial growth factor encoded by Orf virus, VEGF-E, mediates angiogenesis via signalling through VEGFR-2 (KDR) but not VEGFR-1 (Flt-1) receptor tyrosine kinases[J]. EMBO J,1999, 18 (2) : 363-74. DOI: 10.1093/emboj/18.2.363. |
| [16] | Rziha H, Henkel M, Cottone R, et al. Generation of recombinant parapoxviruses: non-essential genes suitable for insertion and expression of foreign genes[J]. J Biotechnol,2000, 83 (1/2) : 137-45. |
| [17] | Englert DL, Jayaraman A, Manson MD. Microfluidic techniques for the analysis of bacterial chemotaxis[J]. Methods Mol Biol,2009, 571 : 1-23. DOI: 10.1007/978-1-60761-198-1. |
| [18] | Reichel C, Mathur J, Eckes P, et al. Enhanced green fluorescence by the expression of an Aequorea Victoria green fluorescent protein mutant in mono- and dicotyledonous plant cells[J]. Proc Natl Acad Sci USA,1996, 93 (12) : 5888-93. DOI: 10.1073/pnas.93.12.5888. |
| [19] | Kishimoto H, Zhao M, Hayashi K, et al. In vivo internal tumor illumination by telomerase-dependent adenoviral GFP for precise surgical navigation[J]. Proc Natl Acad Sci USA,2009, 106 (34) : 14514-7. DOI: 10.1073/pnas.0906388106. |
| [20] | Haig DM, Mcinnes CJ. Immunity and counter-immunity during infection with the parapoxvirus orf virus[J]. Virus Res,2002, 88 (1/ 2) : 3-16. |
| [21] | Brun A, Albina E, Barret T, et al. Antigen delivery systems for veterinary vaccine development[J]. Vaccine,2008, 26 (51) : 6508-28. DOI: 10.1016/j.vaccine.2008.09.044. |
| [22] | 宋远斌, 何思杰, 余楠, 等. 柯萨奇病毒A16型VP1-VP4基因克隆及 其表达产物的抗原相关性分析[J]. 南方医科大学学报,2012 (12) : 1713-7. |
| [23] | 宋远斌, 余楠, 何思杰, 等. 肠道病毒71型VP1~VP4基因克隆及其表 达产物的免疫原性[J]. 南方医科大学学报,2011 (11) : 1846-50. |
| [24] | Diel DG, Luo S, Delhon G, et al. A nuclear inhibitor of NF-kappaB encoded by a poxvirus[J]. J Virol,2011, 85 (1) : 264-75. DOI: 10.1128/JVI.01149-10. |
 2016, Vol. 36
2016, Vol. 36

