产单核细胞李斯特菌(Listeria monocytogenes,LM)是一种可广泛传播的食源性病原微生物,能引起新生儿和成人的严重感染,如胃肠道疾病、脓毒症和致死性脑膜炎[1-3]。食源性疾病死亡中近30%是由李斯特菌病引起的[4]。LM是细胞内感染菌,能感染吞噬细胞、上皮细胞、内皮细胞、肝细胞和实质细胞等,胞内感染的病原菌不仅能损伤宿主细胞,还能造成感染的复发和再感染。尽管LM菌株几乎对所有的广谱抗生素敏感,但李斯特菌病的死亡率仍然很高[5-7],这一方面是因为绝大多数抗生素对细胞内感染的病原菌作用有限,另一方面宿主对该菌的防御机制尚未弄清。因此,研究和发展新型药物是临床治疗李斯特菌病迫切需要解决的问题。
对于胞内感染菌的化学治疗效果依赖于宿主蛋白和抗生素二者的作用。c-Met即是已知能在LM侵入哺乳动物细胞中起重要作用的宿主蛋白。c-Met是一种由c-met原癌基因编码的蛋白产物,为间质细胞来源的肝细胞生长因子/分散因子(human hepatocyte growth factor/scatter factor,HGF/SF)的受体,具有酪氨酸激酶活性,与多种癌基因产物和调节蛋白相关,参与细胞信号转导、细胞骨架重排的调控,与细胞增殖、分化和运动有关[8-9]。
病原菌通过其自身摄入和转运穿越正常防御组织屏障而侵入宿主组织器官。但某些病原菌可进行生物模拟,模拟与宿主受体相应的天然配体分子,这种现象在细菌通过转胞吞作用侵袭上皮或内皮细胞过程中可以见到。LM的内化素B(internalins B,InlB),和天然配体肝细胞生长因子/分散因子一样,能与HGF/SF受体c-Met 结合,通过一系列信号转导使细菌侵入宿主细胞:InlB的LRR结构域(亚单位)与c-Met胞外域结合,激活自身c-Met酪氨酸磷酸化,Gab1、Cbl和Shc的募集和磷酸化,及包含有衔接子和PI3K亚单位p85的复合物形成[10],通过拉链式的吞噬作用介导细菌进入宿主细胞。我们的体外初步实验表明(结果尚未发表):c-Met抑制剂17-AAG能有效阻断LM对人脑微血管内皮细胞(human brain microvessel endothelial cell,HBMEC)的侵袭,提示c-Met抑制剂代表了一种作用于宿主因子的新型抗感染治疗策略。
卡博替尼(Cabozantinib)是一种口服的多种受体酪氨酸激酶抑制剂,美国食品药品管理局(FDA)已批准卡博替尼用于转移性甲状腺髓样癌的治疗。细胞和动物实验已证实卡博替尼能够异常调节Met信号通路,从而抑制肿瘤细胞的增殖[11-12]。近期临床研究证明卡博替尼能够治疗甲状腺髓样癌和前列腺癌,并且具有安全剂量范围[13-14]。本研究拟运用动物体内模型,验证c-Met抑制剂卡博替尼对李斯特菌体内感染的阻断作用,探讨卡博替尼作为LM感染治疗药物的可行性。
1 材料和方法 1.1 材料 1.1.1 菌株和试剂采用的产单核细胞李斯特菌ATCC株13932(血清型4b)由美国南加州大学洛杉矶儿童医院黄胜和教授提供;卡博替尼(XL-184)购自Santa 公司;氨苄青霉素、依文思蓝购自Sigma;BioswampNF-κB p65ELISA试剂盒、博士德IL-10ELISA试剂盒均购自广州鼎国生物科技有限公司。其他生化试剂均为国产分析纯。
1.1.2 实验动物C57BL/6 小鼠,6 周龄,雌性,体质量18~22 g,由南方医科大学实验动物中心提供。
1.2 方法 1.2.1 菌株培养将LM划线接种于BHI固体培养基,37 ℃恒温培养16 h后,挑取单一菌落于BHI液体培养基中37 ℃、180 r/min振荡培养2代,再重新接种于新鲜的BHI液体培养基中,摇至对数生长期,10 000 r/min离心3 min后,无菌PBS洗涤3次,稀释菌液至5×106 CFU/mL备用。
1.2.2 生存曲线分析将小鼠随机分为4 组:卡博替尼组、氨苄青霉素组、卡博替尼联合氨苄青霉素组、PBS对照组,每组9只,每只小鼠腹腔注射1×106 CFU LM,并分别在感染后6、12、24 h给药,各组分别灌胃给予卡博替尼20 μg/g、腹腔注射氨苄青霉素20 μg/g、灌胃卡博替尼20 μg/g后腹腔注射20 μg/g氨苄青霉素、以及腹腔注射等量PBS。每天记录观察小鼠的临床症状和生存情况,共5 d。
1.2.3 血液、脑组织细菌计数取20只小鼠,随机分为卡博替尼组、氨苄青霉素组、卡博替尼联合氨苄青霉素组、PBS对照组,每组5只。每组小鼠腹腔注射LM 100 μL(5×106 CFU/mL),分别在感染后2、6、24 h给药,给药方式同1.2.2。给菌后48 h,用氯胺酮和利多卡因麻醉,无菌打开其胸腔,暴露心肺,用1 mL注射器从心尖处抽取200 μL血液,倍比稀释后,涂布于BHI固体培养基进行细菌计数。用剪刀或针尖刺破心脏右心耳,并从心尖处注入30 mL预冷PBS,直到小鼠肺部变白为止,说明体循环灌注冲洗效果良好。灌洗后无菌打开头颅,取出脑组织,用组织匀浆器研磨,倍比稀释后,涂布于BHI固体培养基,计数细菌菌落数。
1.2.4 IL-10和NF-κB p65的检测同1.2.3法给菌和用药,48 h后采集小鼠心脏血液,于2~8 ℃ 5200 r/min离心15 min,30 min内收集血清,用IL-10ELISA试剂盒检测IL-10量。取出小鼠脑组织用于HE染色,再用200 μLPBS冲洗脑室和颅腔以收集脑脊液(CSF),10 μL CSF中含有10个红细胞的标本视为污染标本,然后用小鼠NF-κB p65ELISA试剂盒测定脑脊液中p65的含量。
1.2.5 HE染色同1.2.3法给菌和用药,48 h后无菌采集脑组织,于10%甲醛固定后,经水洗、脱水、透明、浸蜡、包埋、修块、切片、贴片、烤片、HE染色、封片后,于显微镜下进行病理观察。
1.2.6 脑组织中依文思蓝含量的测定脑组织中EB含量用于评价血脑屏障(BBB)通透性。同1.2.3法给菌和用药,48 h后解剖小鼠。小鼠于解剖前3 h腹腔注射EB(50 μg/g),存活3 h后,麻醉,用30 mL预冷PBS心脏灌注,打开头颅,取出脑组织,放入含有1 mL去离子甲酰胺的EP管内,50 ℃水浴48 h,5200 r/min离心10 min,取上清液,620 nm分光光度计测定吸光度,根据吸光度在绘制的标准曲线中查得EB的浓度。
1.2.7 统计方法结果用均数±标准差表示,运用GraphPad Prism 5软件进行统计学分析,两组的比较运用t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 各组生存曲线分析注射1×106 CFU LM后12 h,PBS组个别小鼠开始出现明显的发抖、蜷缩、抱团等临床症状,食欲下降,精神萎靡,且24 h 内死亡3 只小鼠,120 h 内死亡率达到77.7%;卡博替尼组小鼠死亡率较对照组有所降低,仅为33.3%;氨苄青霉素单独用药组死亡率仅为11.1%;卡博替尼联合氨苄青霉素组小鼠120 h 内均未出现死亡(图 1)。
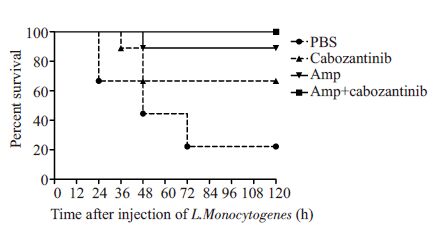
|
图 1 各组生存曲线比较 Figure 1 Survival curve in each group |
解剖小鼠后,取其血液和脑组织细菌计数。结果显示(图 2):卡博替尼组血液细菌量比PBS对照组明显降低(5.72±0.43 log10CFU vs 7.33±0.26 log10CFU,*P<0.05);卡博替尼组脑组织细菌量相比PBS对照组也显著降低(3.26±0.37 log10CFU vs 5.64±0.13 log10CFU,***P<0.001)。氨苄青霉素组血液和脑组织细菌量均显著低于PBS组(2.89±1.23 log10CFUvs 7.33±0.26 log10CFU,**P<0.01;0.82±0.50 log10CFU vs 5.64±0.13 log10CFU,***P<0.001)。卡博替尼联合氨苄青霉素组小鼠血液和脑组织均未有细菌生长,显著低于卡博替尼单独用药组(***P<0.001),表明卡博替尼联合氨苄青霉素用药能够增强对LM胞内感染的阻断作用。
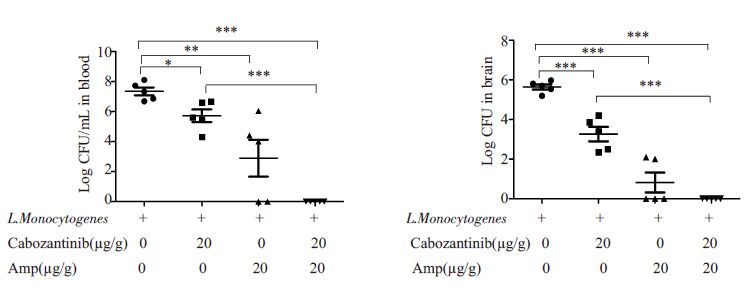
|
图 2 卡博替尼和氨苄青霉素对细菌载量的影响 Figure 2 Effect of cabozantinib and Amp on bacterial loads,*P<0.05,**P<0.01,***P<0.001 |
检测不同组小鼠血清IL-10量,结果发现(图 3):卡博替尼组IL-10 量比PBS 对照组明显降低(1001.9±440.31 pg/mL vs 1604.9±36.40 pg/mL,*P<0.05);氨苄青霉素组IL-10量也显著低于PBS组(551.85±588.67 pg/mL vs1604.9±36.40 pg/mL,**P<0.01)。卡博替尼联合氨苄青霉素组小鼠IL-10量,相比PBS组和卡博替尼单独用药组均显著减少(16.04±2.55 pg/mLvs 1604.9±36.40 pg/mL,***P<0.001;16.04±2.55 pg/mL vs 1001.9±440.31 pg/mL,**P<0.01)。
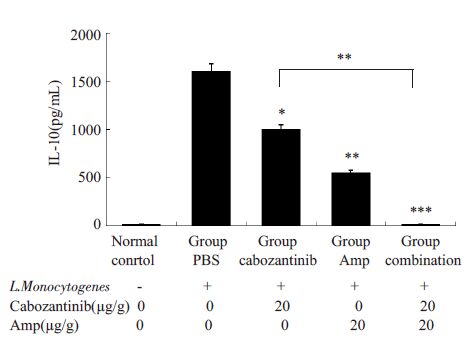
|
图 3 血清IL-10细胞因子量 Figure 3 Serum IL-10 level in each group (*P<0.05,**P<0.01,***P<0.001) |
通过检测脑脊液中NF-κB p65平均含量,结果发现(图 4):卡博替尼组NF-κB p65量比PBS对照组明显降低(45.34±9.63 ng/mL vs 67.50±10.06 ng/mL,**P<0.01);氨苄青霉素组NF-κB p65量也低于PBS对照组(22.16±10.30 ng/mL vs 67.50±10.06 ng/mL,***P<0.001)。卡博替尼联合氨苄青霉素组NF-κB p65含量最低,相比于卡博替尼单独用药组差异具有统计学意义(15.62±3.60 ng/mLvs 45.34±9.63 ng/mL,***P<0.001)。NF-κB p65量反映中枢神经系统炎症情况,结果表明卡博替尼能够减轻小鼠中枢神经系统的炎症反应,且与氨苄青霉素联合用药效果更佳。
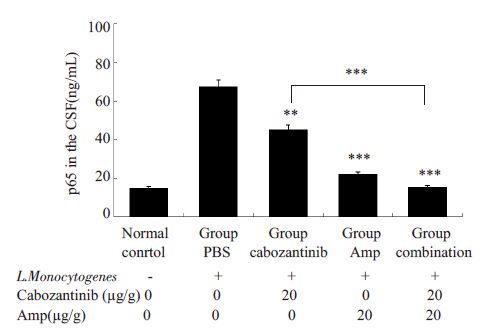
|
图 4 脑脊液NF-κB p65量 Figure 4 Level of NF-κB (p65) in the cerebrospinal fluid ineach group (**P<0.01,***P<0.001). |
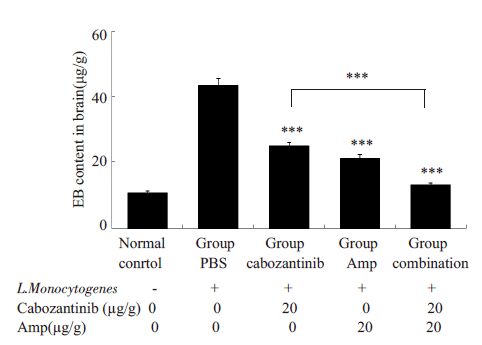
各组小鼠脑组织中EB 含量测定结果(图 5)发现:卡博替尼组比PBS 组EB 含量明显降低(24.83±4.11 μg/g vs 43.37±6.63 μg/g,***P<0.001);氨苄青霉素组EB含量也低于PBS 组(21.12±2.86 μg/g vs 43.37±6.63 μg/g,***P<0.001)。卡博替尼联合氨苄青霉素组脑组织EB含量下降最为明显,与卡博替尼单独用药组差异具有统计学意义(12.94±3.26 μg/g vs 24.83±4.11 μg/g,***P<0.001)。
|
图 5 脑组织EB含量 Figure 5 EB content in the brain in each group (***P<0.001) |
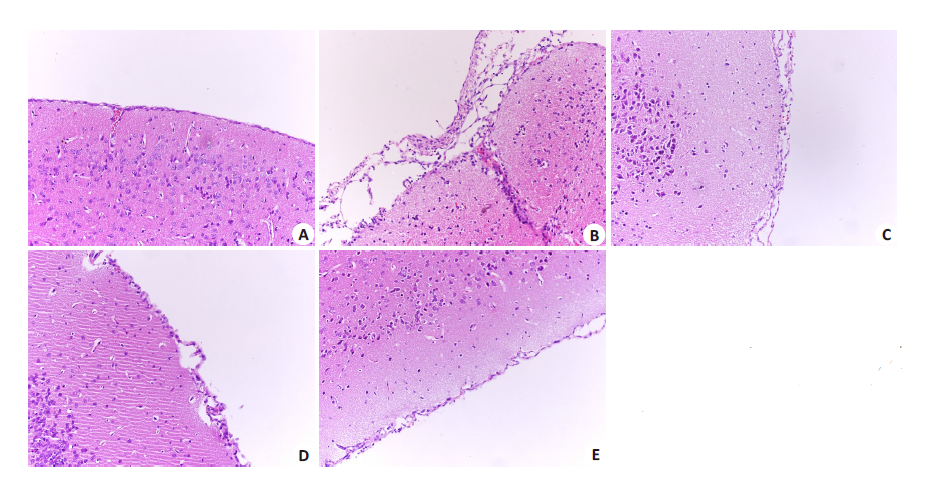
PBS对照组脑组织出现较多炎性粒细胞浸润,脑膜水肿,增厚;卡博替尼和氨苄青霉素单独用药组炎性粒细胞相对减少,脑组织病理变化减轻;联合用药组仅见少量的炎症细胞,脑膜病理变化不明显(图 6)。
|
图 6 脑组织的病理分析 Figure 6 Histological analysis of the braintissues (Original magnification: ×200). A:Normal brain tissues; B: PBS group; C:Cabozantinib group; D: Amp group; E:Cabozantinib plus Amp group |
目前,针对包括LM在内的细胞内感染菌,宿主介导地抑制细胞信号通路激活的抗菌治疗方法日益广泛[15-17]。在人类肿瘤的形成和转移过程中,c-Met被异常激活所产生的异常信号是最常见的改变之一,c-Met介导的信号传导通路在LM入侵宿主细胞过程中同样重要[18]。c-Met抑制剂卡博替尼作为可能的新型抗菌药物具有两个优点,一方面卡博替尼是一种小分子抑制剂,可以穿过血脑屏障,在治疗LM引发的中枢神经系统感染上很有优势。另一方面,InlB是LM侵入细胞所必须的。作为InlB受体,c-Met是阻断LM胞内感染药物的良好靶点。由于卡博替尼和抗生素具有不同的代谢机制、靶点以及胞内/胞外浓度比,预期卡博替尼可有效地阻断胞内感染,补充抗生素胞内分布较少的缺点,因此它们之间很可能形成良好的协同或叠加效应。
血脑屏障是维持中枢神经系统内环境稳定的一道屏障,NF-κB的活化以及EB含量能够反映中枢神经系统炎症以及血脑屏障的通透性[19-20]。IL-10是一种多功能负性调节因子,主要由Th2细胞、活化的B细胞、单核细胞、巨噬细胞产生。LM感染会导致巨噬细胞、DC细胞分泌IL-10的产量增多,进而促使宿主免疫细胞凋亡[21]。本研究以C57BL/6雌性小鼠为研究对象,比较了不同组小鼠的生存率、血液和脑组织细菌载量、血清IL-10量、脑脊液中NF-κB p65含量和脑组织中EB含量以及脑病理变化程度,结果显示:卡博替尼组、氨苄青霉素组、联合用药组3组小鼠的生存率相比PBS组增高,血液和脑细菌量、IL-10量、NF-κB p65和EB含量显著地低于PBS对照组,脑组织病理变化也相对减轻,说明卡博替尼能够抵抗产单核细胞李斯特菌引起的菌血症和脑膜炎。同时研究发现,联合用药组效果明显优于单独用药组,说明卡博替尼与氨苄青霉素可能具有一定的协同作用。
综上所述,本研究通过小鼠体内试验,证明了卡博替尼能够抑制LM感染所引起的菌血症和脑膜炎,对研发针对细胞内感染病原菌的抗感染药物有积极意义。
| [1] | Posfay-Barbe KM, Wald E. Listeriosis[J]. Pediatr Rev,2004, 25 (5) : 151-9. DOI: 10.1542/pir.25-5-151. |
| [2] | Singh AK, Ulanov AV, Li Z, et al. Metabolomes of the psychrotolerant bacterium Listeria monocytogenes 10403S grown at 37 °C and 8 °C[J]. Int J Food Microbiol,2011, 148 (2) : 107-14. DOI: 10.1016/j.ijfoodmicro.2011.05.008. |
| [3] | Drevets DA, Bronze MS. Listeria monocytogenes: epidemiology, human disease, and mechanisms of brain invasion[J]. FEMS Immunol Med Microbiol,2008, 53 (2) : 151-65. DOI: 10.1111/j.1574-695X.2008.00404.x. |
| [4] | Drevets DA, Dillon MJ, Schawang JE, et al. IFN-gamma triggers CCR2-independent monocyte entry into the brain during systemic infection by virulent Listeria monocytogenes[J]. Brain Behav Immun,2010, 24 (6) : 919-29. DOI: 10.1016/j.bbi.2010.02.011. |
| [5] | Eder JP, Vande Woude GF, Boerner SA, et al. Novel therapeutic inhibitors of the c-Met signaling pathway in cancer[J]. Clin Cancer Res,2009, 15 (7) : 2207-14. DOI: 10.1158/1078-0432.CCR-08-1306. |
| [6] | Penduka D. Evaluation of the anti-Listeria potentials of some plant-derived triterpenes[Z], 2014: 37. |
| [7] | Pensinger DA, Aliota MT, Schaenzer AJ, et al. Selective pharmacologic inhibition of a PASTA kinase increases Listeria monocytogenes susceptibility to β-lactam antibiotics[J]. Antimicrob Agents Chemother,2014, 58 (8) : 4486-94. DOI: 10.1128/AAC.02396-14. |
| [8] | 陈俊忠, 赵勇, 徐嘉凤, 等. 肝细胞生长因子及其受体在胃癌组织中的表达[J]. 南方医科大学学报,2007, 27 (11) : 1771-3. |
| [9] | Dortet L, Veiga E, Bonazzi M, et al. CD44-independent activation of the Met signaling pathway by HGF and InlB[J]. Microbes Infect,2010, 12 (12/13) : 919-27. |
| [10] | Jiwani S, Wang Y, Dowd GC, et al. Identification of components of the host type IA phosphoinositide 3-kinase pathway that promote internalization of Listeria monocytogenes[J]. Infect Immun,2012, 80 (3) : 1252-66. DOI: 10.1128/IAI.06082-11. |
| [11] | Weitzman SP, Cabanillas ME. The treatment landscape in thyroid cancer: a focus on cabozantinib[J]. Cancer Manag Res,2015, 7 : 265-78. |
| [12] | Sun Y, Sun L, An Y, et al. Cabozantinib, a novel c-Met inhibitor, inhibits colorectal cancer development in a xenograft model[J]. Med Sci Monit,2015, 21 : 2316-21. DOI: 10.12659/MSM.893590. |
| [13] | Wang X, Wang S, Ma J, et al. Pharmacokinetics in rats and tissue distribution in mouse of berberrubine by UPLC-MS/MS[J]. J Pharm Biomed Anal,2015, 115 : 368-74. DOI: 10.1016/j.jpba.2015.07.031. |
| [14] | Smith DC, Smith MR, Sweeney C, et al. Cabozantinib in patients with advanced prostate cancer: results of a phase II randomized discontinuation trial[J]. J Clin Oncol,2013, 31 (4) : 412-9. DOI: 10.1200/JCO.2012.45.0494. |
| [15] | Czy DM, Potluri LP, Jain-Gupta N, et al. Host-directed antimicrobial drugs with broad-spectrum efficacy against intracellular bacterial pathogens[J]. MBio,2014, 5 (4) : e01514-34. |
| [16] | Chiu HC, Soni S, Kulp SK, et al. Eradication of intracellular Francisella tularensis in THP-1 human macrophages with a novel autophagy inducing agent[J]. J Biomed Sci,2009, 16 (1) : 110. DOI: 10.1186/1423-0127-16-110. |
| [17] | Collier MA, Gallovic MD, Peine KJ, et al. Delivery of host cell-directed therapeutics for intracellular pathogen clearance[J]. Expert Rev Anti Infect Ther,2013, 11 (11) : 1225-35. DOI: 10.1586/14787210.2013.845524. |
| [18] | Banerjee M, Copp J, Vuga D, et al. GW domains of the Listeria monocytogenes invasion protein InlB are required for potentiation of Met activation[J]. Mol Microbiol,2004, 52 (1) : 257-71. DOI: 10.1111/j.1365-2958.2003.03968.x. |
| [19] | Yu JY, Zhang B, Peng L, et al. Repositioning of memantine as a potential novel therapeutic agent against meningitic E. coli-Induced pathogenicities through Disease-Associated alpha7 cholinergic pathway and RNA Sequencing-Based transcriptome analysis of host inflammatory responses[J]. PLoS One,2015, 10 (5) : e0121911. DOI: 10.1371/journal.pone.0121911. |
| [20] | 阮林, 韦力, 廉春蓉, 等. 全脑照射后血脑屏障改变对放射性脑损伤 的影响[J]. 中国神经精神疾病杂志,2011 (10) : 591-5. |
| [21] | Carrero JA, Unanue ER. Mechanisms and immunological effects of apoptosis caused by Listeria monocytogenes[J]. Adv Immunol,2012, 113 : 157-74. DOI: 10.1016/B978-0-12-394590-7.00001-4. |
 2016, Vol. 36
2016, Vol. 36

