2. 海南医学院附属医院耳鼻咽喉科, 海南 海口 570102 ;
3. 海南省农垦总局医院耳鼻咽喉科, 海南 海口 570311
2. Department of Otolaryngology, Affiliated Hospital of Hainan Medical University, Haikou 570102, China ;
3. Department of Otolaryngology, Hainan Provincial Nongken General Hospital, Haikou 570311, China
喉癌是严重影响人类健康的疾病之一,在过去的十年间,喉癌的外科治疗技术不断更新,多种治疗方式不断改进,使得喉癌患者的喉功能保存率及生存质量获得不断提高。但是,大宗病例的调查显示,喉癌患者的生存率仍无明显改善[1-2]。目前普遍认为恶性肿瘤的发生发展是一个复杂的、多步骤过程,是正常细胞在内外环境因子的作用下发生基因突变或基因表达异常后逐渐演变而形成的生长失控的异常细胞集合体。P53基因是迄今为止已发现的与人类肿瘤发生相关性最高的抑癌基因,P53信号通道在肿瘤发生过程起着至关重要的作用[3]。而作为P53上游的共济失调毛细血管扩张突变基因(ATM)和生殖器形成抑制基因-1(SMG-1),同属于PIKK家族。ATM基因作为重要的细胞周期检测点激酶,其在头颈鳞癌方面的研究,主要集中于与辐射激活的磷酸化P53、P21蛋白的相互作用,这可能与头颈肿瘤的放射敏感性相关。而新近发现的SMG-1基因,已经有证据表明其也能够调控P53信号传导通路,引起细胞周期的阻滞,为DNA修复提供时间。近期的研究表明,ATM、SMG-1基因表达及调控异常与肿瘤的发生密切相关[4-5]。迄今为止,国内外缺乏针对喉癌中SMG-1、ATM和P53蛋白共同表达的相关研究。本研究通过免疫组化法检测喉鳞癌组织中SMG-1、ATM和P53蛋白的表达,探讨三者与喉癌临床病理、预后的关系以及三者之间的相关性,为喉癌的基础研究提供新的资料。
1 资料和方法 1.1 标本来源以2006 年1 月1 日~2009 年8 月31 日在海南医学院附属医院耳鼻咽喉科及海南省农垦总局医院耳鼻咽喉科住院手术的喉癌患者为研究对象。病例入选条件:原发灶病理确诊为喉鳞状细胞癌且术前未经放疗及化疗。符合条件的病例63例,全部为男性;年龄42~79岁,中位年龄59岁;声门上型27例,声门型35例,声门下型1 例;按照UICC(2002)分期标准:T1N0M0 11 例,T1N1M0 4例,T1N2M0 1例,T2N0M0 13例,T2N1M01 例,T2N2M0 1 例,T3N0M0 5 例,T3N1M0 9 例,T4N0M0 5例,T4N1M0 5例,T4N2M0 8例。高分化鳞状细胞癌30例,中分化鳞状细胞癌25例,低分化鳞状细胞癌8例。63例中,单纯手术36例,综合治疗27例。手术方式包括喉裂开声带癌切除、部分喉切除、喉全切除。颈淋巴结清扫术式包括择区性颈清扫、改良根治性颈清扫及根治性颈清扫。SMG-1、ATM、P53癌旁正常对照组各30 例标均来源于同时段同医院喉癌术中所取,肉眼观察距肿瘤边缘至少2 cm以上,显微镜下检查证实没有癌细胞。
1.2 方法所有标本均在24 h内取相应癌组织,经4%的中性甲醛固定、石蜡包埋制成3~4 μm厚的切片,抗原修复采用高温高压0.01 mol/L EDTA 修复2 min,3% H2O2(0.01 M PBS稀释)室温封闭10 min;一抗(兔抗-ATM,1∶75稀释,Abcam公司;兔抗-SMG-1,1∶75稀释,Abcam公司;兔抗-P53,1∶150 稀释,Abcam 公司)室温孵育60 min;二抗(辣根过氧化物酶标记的羊抗兔IgG,按照GTvisionTM试剂盒说明书操作)室温孵育40 min;DAB显色;苏木精复染;脱水,封片,显微镜观察。
1.3 结果判定标准所有切片均采用双盲法由两位高年资病理科医师阅片,意见不一致时请第3位病理科医师看片,以有两个相同意见为准。SMG-1阳性染色可出现于细胞核和细胞质,而P53 和ATM阳性染色主要出现于细胞核。在400倍光镜下至少观察10个视野,每视野至少含100个肿瘤细胞,计算阳性细胞百分率。阳性细胞百分率即为同类细胞10个高倍视野阳性细胞数的均数。
SMG-1结果判定[5]:(1)阴性,胞质及胞核无染色,与背景无明显差别;(2)弱阳性,胞质及胞核染色强度微弱(淡黄色),阳性细胞数少于50%;(3)中阳性,胞质及胞核染色强度较强(黄色或棕黄色),阳性细胞数少于40%;(4)强阳性,胞质及胞核染色强度较强(褐色或棕褐色),阳性细胞数大于40%。
ATM结果判定[6]:采用半定量法,阳性细胞为细胞核呈淡黄色、黄色或棕褐色。阳性细胞计分标准,无染色为0 分,≤10%为1 分,11~33%为2 分,34~66%为3分,>66%为4分。0分为阴性,1~4分为阳性。
P53结果判定[7]:采用半定量法,阳性细胞为细胞核呈淡黄色、黄色或棕褐色。阳性细胞计分标准,≤5%为0 分,6~25%为1 分,26~50%为2 分,51~75%为3分,>75%为4分。0分为阴性,1~4分为阳性。
1.4 统计学方法采用IBM SPSS19.0软件进行数据分析,喉癌组与对照组之间,以及各临床因素分组之间的组间比较,为计数资料,故采用χ2检验或Fisher's精确概率法。资料的相关性采用χ2检验,以Pearson相关系数表示关联程度。生存分析采用Kaplan-Meier法,以P<0.05为差异有统计学意义。
2 结果 2.1 SMG-1、ATM和P53在喉鳞癌中的表达SMG-1阳性细胞表现为细胞核和(或)细胞质着褐色、棕褐色或棕黄色,ATM及P53阳性细胞表现为细胞核着褐色、棕褐色或棕黄色(图 1)。喉癌组织和癌旁正常组织中,SMG-1的表达率分别为36.5%和73.3%,两者比较,差异有统计学意义(χ2=11.035,P<0.001)。ATM表达率分别为41.3%和83.3%,差异有统计学意义(χ2=14.520,P<0.001)。P53 表达率分别为57.1%和20.0%,差异有统计学意义(χ2=11.321,P<0.001)。
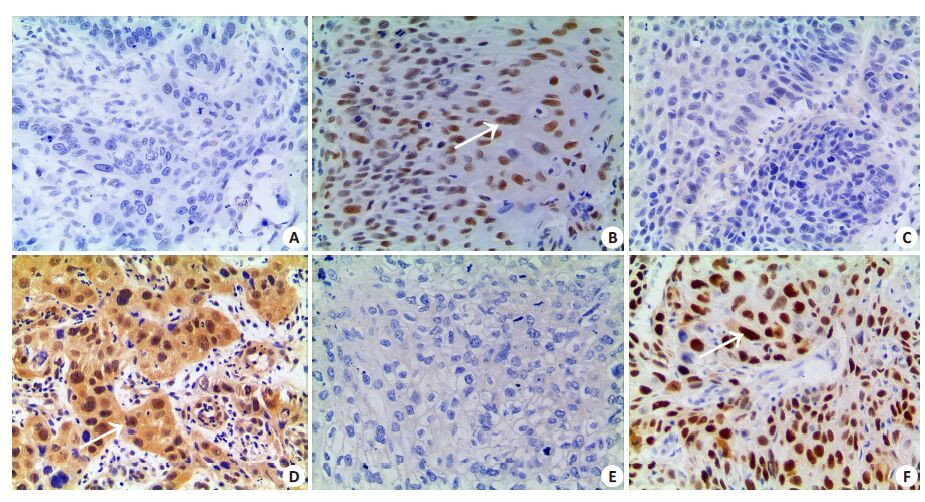
|
图 1 ATM、SMG-1、P53 蛋白在喉鳞癌中的表达 Figure 1 The expression of ATM、SMG-1 and P53 in LSCC (Immunohistochemistry,original magnification: × 200). A: ATM,negtiveexpression; B: ATM,positive expression; C: SMG-1,negtive expression; D: SMG-1,positive expression; E: P53,negtive expression; F:P53 Possitive expression. Whitearrow: Typical positive cell. |
经χ2检验,SMG-1 在不同原发部位(χ2=3.958,P=0.047)及T分期(χ2=5.107,P=0.024)中的表达差异有统计学意义。在年龄(χ2=0.107,P=0.743)、N 分期(χ2=3.210,P=0.073)及病理分级(χ2=0.001,P=0.980)中的表达差异无统计学意义。ATM在不同年龄(χ2=1.777,P=0.183)、肿瘤原发部位(χ2=1.732,P=0.188)、T分期(χ2=0.111,P=0.916)、N分期(χ2=0.281,P=0.596)以及病理分级(χ2=0.101,P=0.751)中的表达均无统计学差异。P53在不同年龄(χ2=0.205,P=0.650)、肿瘤原发部位(χ2=2.363,P=0.124)、T分期(χ2=2.800,P=0.094)、N分期(χ2=0.644,P=0.422)以及病理分级(χ2=0.896,P=0.344)中的表达均无统计学差异(表 1)。
| 表 1 SMG-1、ATM、P53表达与临床病理特征关系 Table 1 Relationship between the clinicopathological factors and the expressions of ATM,SMG-1,and P53 |
Kaplan-Meier分析结果显示,喉癌SMG-1 蛋白表达阳性组5 年生存率为30.4%,阴性组5 年生存率为67.5%,喉癌SMG-1蛋白表达阴性组5年生存率明显高于阳性组,二者相比有统计学意义(χ2=10.921,P=0.001)。ATM蛋白表达阳性组5年生存率为65.4%,阴性组5年生存率为45.9%,喉癌ATM蛋白表达阳性组5年生存率高于阴性组,但二者相比无统计学意义(χ2=2.011,P=0.156)。P53 蛋白表达阳性组5 年生存率为63.9%,阴性组5年生存率为40.7%,喉癌P53蛋白表达阳性组5年生存率高于阴性组,但二者相比无统计学意义(χ2=3.777,P=0.052,图 2)。
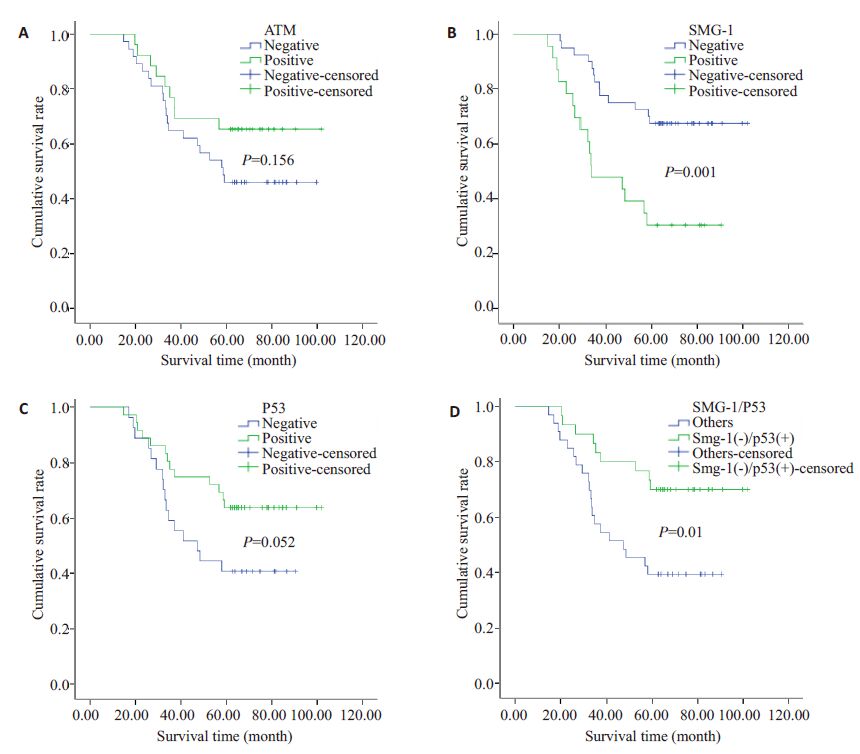
|
图 2 喉癌3种蛋白表达与生存率关系 Figure 2 Relationship of ATM,SMG-1,and P53 with the patients' survival. A: Survival curves of different ATMstatus; B: Survival curves of different SMG-1 status; C: Survival curves of different P53 status; D: Survivalcurves of different SMG-1/P53 status. |
SMG-1阳性表达23例中,6例P53阳性表达,17例P53阴性表达;SMG-1阴性表达40例中,30例P53阳性表达,10 例P53 阴性表达。两者表达呈负相关(χ2=14.266,P<0.001),Pearson 相关系数r=-0.476。由于二者表达呈负相关,因此我们又将资料分为二者共同表达异常组(即SMG-1表达阴性,P53表达阳性)和其他组,进行生存分析,结果显示,SMG-1/P53共同表达异常组,5年生存率为70.0%,其他组5年生存率为39.4%,二者相比有统计学意义(χ2=6.703,P=0.010,图 2D)。SMG-1阳性表达23例中,8例ATM阳性表达,15例ATM阴性表达;SMG-1阴性表达40例中,18例ATM阳性表达,22例ATM 阴性表达,两者之间无相关(χ2=0.629,P=0.428)。ATM阳性表达26例中,16例P53阴性表达,10例P53阳性表达;ATM阴性表达37例中,20例P53阳性表达,17 例P53 表达表达,两者之间无相关(χ2=0.349,P=0.555)。
3 讨论p53是目前研究最多的抑癌基因,其突变已被证明与多种肿瘤发病相关[8-9]。目前研究显示,p53与喉癌也有相关性。Guo等[10]发现58.7%喉癌存在P53蛋白的过度表达。在正常细胞和组织中,野生型p53蛋白半衰期很短,约20 min,不易检出,而突变后的p53半衰期延长,可长达24 h,容易检测。因而,经免疫组化方法检测出来的p53均为突变型p53[11],其在细胞恶变的过程中,起到了原癌基因的作用。本组资料,突变型p53在喉鳞癌和正常喉组织中的阳性表达率分别为57.1%和20%,两者差异具有统计学意义(P<0.05),提示突变型p53 蛋白的过度表达与喉癌的发生有内在关系。但其表达与临床病理因素无关。这与任晓彤等[12]及Cabanillas等[13]的研究结果一致,提示喉癌中突变型P53 表达可能受到多种因子的调节。尤其是在P53 信号传道通路中,位于其上游的PIKKs家族中的SMG-1、ATM以及ATR 基因等均被证明参与调控多种恶性肿瘤的DNA损伤反应,可能与肿瘤的发生发展有关。
目前,抑癌基因ATM缺失或低表达,已经被证明与人类多种恶性肿瘤相关。ATM 位于人类染色体11q22-23 区域上,包含66个外显子,开放读码框有9168个核苷酸,编码的蛋白分子量约为350 000,包含3056个氨基酸。由于人类染色体11q22-23 区域的缺失和突变出现在很多肿瘤中,如淋巴瘤、白血病、乳腺癌、宫颈癌、卵巢癌、胃癌等,因而推测共济失调毛细血管扩张症患者由于ATM 功能丧失导致肿瘤易感性显著升高。近期鲁强等[14]报道,卵巢癌组织中ATM表达缺失率明显升高且与肿瘤淋巴结转移及病理分级相关。He等[15]的研究显示,在口腔鳞状细胞癌中,31.5%为ATM蛋白表达缺失或低表达,而这种表达异常与肿瘤的组织学分化以及淋巴结受侵均有相关性。目前认为ATM主要是通过调控DDR通路而发挥其抑癌作用[16-17]。本组资料显示,ATM蛋白在喉鳞癌和正常喉组织中的阳性表达率分别为41.3%和83.3%,差异有统计学意义(P<0.05)。但其表达与临床病理因素无关。这与Lee等[18]和Lim等[19]的研究结果一致。提示ATM蛋白表达缺失在喉癌为一普遍现象。本组Kaplan-Meier生存分析结果显示,ATM表达与患者预后无关,这与Lim等[19]在头颈鳞癌中的研究结果相一致。
SMG-1基因是近年新发现的PIKKs家族成员。位于人类染色体16p12.3。过去,人们对于SMG-1的认识主要在于其参与的无义介导的mRNA降解(non-sensemRNA decay NMD)。近年来研究发现,SMG-1实际上也是抑癌基因,而其抑癌效应与NMD途径并无关联。最新研究显示,SMG-1不仅能够介导包括DNA和RNA损伤在内的一系列应激反应[20],还参与调控细胞生长和增殖,与多种恶性肿瘤的发生发展关系密切[21]。目前研究认为,SMG-1通过感知DSBs,将DNA损伤信号转导到下游靶蛋白并通过级联放大反应启动应激系统,其中主要是诱导p53基因第15位丝氨酸位点(serine 15)的磷酸化[20],通过P53信号传导通路对P21的调控,引起细胞周期的阻滞,为DNA修复提供时间。由于SMG-1定位于细胞核和细胞浆,而P53、P21均定位于细胞核,当SMG-1表达异常时,可能导致细胞核内整个网络紊乱,影响细胞的转化与增殖,引起肿瘤的发生。因此,SMG-1的抑癌效应与NMD途径并无关联。目前关于喉癌与SMG-1 表达异常关系的研究未见报道。Gubanova等[5]研究发现,HPV16/18表达阳性组头颈鳞癌预后优于HPV16/18 表达阴性组,进一步研究显示HPV16/18阳性组存在SMG-1基因启动子甲基化,导致SMG-1表达下调,而下调了SMG-1表达的头颈鳞癌细胞株,其放射敏感性得到了提高。Oliveira等[22]研究发现,敲除了SMG-1基因后,U20s骨肉瘤细胞对TNF-α诱导其凋亡的速度及程度均明显增加,SMG-l发挥的抗TNF-α诱导的凋亡效应是通过调节凋亡抑制因子FLIP(FADD样白介素-l β转换酶抑制蛋白)的降解来完成的,这进一步证实了上述的假设。本组资料中,SMG-1蛋白在喉癌和正常喉组织中的阳性表达率分别为36.5%和73.3%(P<0.05),SMG-1表达与肿瘤原发部位及T分期有关,声门型喉癌SMG-1蛋白表达缺失率高于声门上、下型喉癌。T1+T2期喉癌SMG-1蛋白表达缺失率高于T3+T4期喉癌。此T分期与SMG-1蛋白表达关系的结果,似乎与SMG-1的抑癌作用相矛盾。但也提示SMG-1基因在肿瘤发生发展中作用的复杂性,其表达结果可能受到多种上游基因的调控及影响。由于本组病例数较少,目前国内外也未见有其他关于SMG-1与喉癌临床病理因素相关性的报道,因而此结果尚有待于下一步的研究确认。Kaplan-Meier生存分析显示,喉癌SMG-1蛋白表达阳性组的5年生存率为30.4%,而阴性组5年生存率为67.5%,阴性组5年生存率明显高于阳性组,差异有统计学意义(P<0.05)。结果提示SMG-1蛋白表达缺失的喉癌患者预后较好。这与Gubanova等[5]在头颈鳞癌中的研究结果一致。本组资料三个蛋白相关性分析显示,SMG-1与P53的表达呈负相关。结合目前国内外文献报道,我们初步判断,SMG-1作为重要的抑癌基因,在受到外来或内源性因子(可能是HPV病毒蛋白)的调控下,SMG-1基因启动子发生甲基化,导致其表达缺失,无法启动P53网络应激系统而导致肿瘤的发生。但是肿瘤细胞中SMG-1的表达缺失又降低了细胞的辐射保护作用,表现为对放疗的敏感性增强,进而影响患者的预后。SMG-1参与的DDR途径以及通过细胞因子介导的凋亡应激反应,既与恶性肿瘤的发生发展有关,又与肿瘤的放射敏感性相关,这表明SMG-1的功能具有多元性及复杂性,可能在喉癌中扮演重要的角色。对其机制的进一步探讨,特别是对喉鳞癌中SMG-1、P53 的变化与功能及其与HPV关系的研究,可为进一步阐明喉癌的发生发展及预后带来新的思路。
| [1] | Macneil SD, Liu K, Shariff SZ, et al. Secular trends in the survival of patients with laryngeal carcinoma, 1995-2007[J]. Curr Oncol,2015, 22 (2) : e85-99. DOI: 10.3747/co.22.2361. |
| [2] | Van Dijk BA, Karim-Kos HE, Coebergh JW, et al. Progress against laryngeal cancer in The Netherlands between 1989 and 2010[J]. Int J Cancer,2014, 134 (3) : 674-81. DOI: 10.1002/ijc.28388. |
| [3] | Zhang J, Shen L, Sun LQ. The regulation of radiosensitivity by p53 and its acetylation[J]. Cancer Lett,2015, 363 (2) : 108-18. DOI: 10.1016/j.canlet.2015.04.015. |
| [4] | Demoulin B, Hermant M, Castrogiovanni C, et al. Resveratrol induces DNA damage in colon cancer cells by poisoning topoisomerase II and activates the ATM kinase to trigger p53-dependent apoptosis[J]. Toxicol In Vitro,2015, 29 (5) : 1156-65. DOI: 10.1016/j.tiv.2015.04.015. |
| [5] | Gubanova E, Brown B, Ivanov SV, et al. Downregulation of SMG-1 in HPV-positive head and neck squamous cell carcinoma due to promoter hypermethylation correlates with improved survival[J]. Clin Cancer Res,2012, 18 (5) : 1257-67. DOI: 10.1158/1078-0432.CCR-11-2058. |
| [6] | Lee HE, Han N, Kim MA, et al. DNA damage response-related proteins in gastric cancer: ATM, Chk2 and p53 expression and their prognostic value[J]. Pathobiology,2014, 81 (1) : 25-35. DOI: 10.1159/000351072. |
| [7] | Lu CD, Altieri DC, Tanigawa N. Expression of a novel antiapoptosis gene, survivin, correlated with tumor cell apoptosis and p53 accumulation in gastric carcinomas[J]. Cancer Res,1998, 58 (9) : 1808-12. |
| [8] | 刘晓东, 季明芳. p53通路相关基因和EZH2在鼻咽癌中的表达关系 及意义[J]. 南方医科大学学报,2011, 31 (6) : 1029-33. |
| [9] | 傅建民, 石剑, 周颉. 乳腺癌血管内皮生长因子C表达及其与临床病 理相关性研究[J]. 南方医科大学学报,2009, 29 (11) : 2266-8. |
| [10] | Guo R, Overman M, Chatterjee D, et al. Aberrant expression of p53, p21, cyclin D1, and Bcl2 and their clinicopathological correlation in ampullary adenocarcinoma[J]. Hum Pathol,2014, 45 (5) : 1015-23. DOI: 10.1016/j.humpath.2013.12.016. |
| [11] | Blagosklonny MV. p53 from complexity to simplicity: mutant p53 stabilization, gain-of-function, and dominant-negative effect[J]. FASEB J,2000, 14 (13) : 1901-7. DOI: 10.1096/fj.99-1078rev. |
| [12] | 任晓彤, 姜捷. p27、p53、p21、环氧化酶-2及表皮生长因子受体在喉 癌中表达意义[J]. 中国耳鼻咽喉头颈外科,2014, 21 (7) : 353-6. |
| [13] | Cabanillas R, Rodrigo JP, Astudillo A, et al. P53 expression in squamous cell carcinomas of the supraglottic larynx and its lymph node metastases: new results for an old question[J]. Cancer,2007, 109 (9) : 1791-8. DOI: 10.1002/(ISSN)1097-0142. |
| [14] | 鲁强, 张志磊, 邹存华, 等. 卵巢上皮性肿瘤组织ATM基因表达缺失 及其临床意义的探讨[J]. 中华肿瘤防治杂志,2011, 10 (10) : 799-801. |
| [15] | He Y, Chen Q, Li B. ATM in oral carcinogenesis:association with clinico-pathological features[J]. J Cancer Res Clin Oncol,2008, 134 (9) : 1013-20. DOI: 10.1007/s00432-008-0365-7. |
| [16] | 张亚男, 陈争. ATM基因与乳腺癌[J]. 国际遗传学杂志,2007, 30 (4) : 282-6. |
| [17] | Parikh RA, White JS, Huang X, et al. Loss of distal 11q is associated with DNA repair deficiency and reduced sensitivity to ionizing radiation in head and neck squamous cell carcinoma[J]. Genes Chromosomes Cancer,2007, 46 (8) : 761-75. DOI: 10.1002/gcc.v46:8. |
| [18] | Lee KW, Tsai YS, Chiang FY, et al. Lower ataxia telangiectasia mutated (ATM) mRNA expression is correlated with poor outcome of laryngeal and pharyngeal cancer patients[J]. Ann Oncol,2011, 22 (5) : 1088-93. DOI: 10.1093/annonc/mdq569. |
| [19] | Lim AM, Young RJ, Collins M, et al. Correlation of Ataxia- Telangiectasia-Mutated (ATM) gene loss with outcome in head and neck squamous cell carcinoma[J]. Oral Oncol,2012, 48 (8) : 698-702. DOI: 10.1016/j.oraloncology.2012.02.014. |
| [20] | Gewandter JS, Bambara RA, O'reilly MA. The RNA surveillance protein SMG1 activates p53 in response to DNA double-strand breaks but not exogenously oxidized mRNA[J]. Cell Cycle,2011, 10 (15) : 2561-7. DOI: 10.4161/cc.10.15.16347. |
| [21] | Roberts TL, Ho U, Luff J, et al. Smg1 haploinsufficiency predisposes to tumor formation and inflammation[J]. Proc Natl Acad Sci USA,2013, 110 (4) : E285-94. DOI: 10.1073/pnas.1215696110. |
| [22] | Oliveira V, Romanow WJ, Geisen C, et al. A protective role for the human SMG-1 kinase against tumor necrosis factor-alpha-induced apoptosis[J]. J Biol Chem,2008, 283 (19) : 13174-84. DOI: 10.1074/jbc.M708008200. |
 2016, Vol. 36
2016, Vol. 36

