硬纤维瘤(DT),亦称韧带样纤维瘤病、侵袭性纤维瘤病,是一种少见的成纤维细胞来源的肿瘤。其年发病率仅为2~4/1000 000[1],在所有肿瘤中仅占0.03%。硬纤维瘤好发部位主要有肩胛带、腹壁、下肢、骨盆带、躯干、上肢等[2]。硬纤维瘤发病男女比例约为1∶3,平均年龄及中位年龄分别为31岁和29岁[1]。硬纤维瘤可呈稳定性或侵袭性生长,也有在生长过程中自然消退的报道[3]。硬纤维瘤的恶变极为罕见,国内曾有一例硬纤维瘤经手术及放疗刺激后恶变的报道[4]。硬纤维瘤在术后前2年内易复发,因此在该时间段内应3月至半年复查1次[5]。
硬纤维瘤的治疗难点在于硬纤维瘤术后容易复发,Peng等[6]报道211例接受手术的DT患者,5年复发率接近50%,而因为硬纤维瘤是良性肿瘤,又不能像肉瘤一样进行牺牲功能的激进的手术。放疗对术后切缘阳性或不可手术的硬纤维瘤虽可以进行局部控制,但放疗存在肢体挛缩、生长障碍、病理性骨折、放射后肉瘤等迟发的并发症。而且最近Shin等[7]的研究发现辅助放疗可以推迟肿瘤的复发,但是似乎对总复发率没有影响。对不可手术及不适合放疗的硬纤维瘤患者应进行系统性治疗,但相关研究因该病发病率低在国际上少见报道,且无大规模的随机对照研究,目前尚无治疗共识。国内对硬纤维瘤关注更少,目前尚无系统性治疗的报道。因此,为了总结单中心硬纤维瘤系统性治疗的效果,对国内硬纤维瘤的治疗提供经验借鉴,本文对我科自2009年8月~2013年12月间收治的不可手术且肿瘤持续进展的52例硬纤维瘤患者的临床特点、治疗及随访情况总结如下。
1 材料和方法 1.1 临床资料我科自2009年8月~2013年12月间共收治不可手术且肿瘤持续进展的硬纤维瘤患者52例,所有病例均经我院病理科确诊(复发病例经复阅外院手术切片而确诊;原发病例行超声引导下粗针穿刺活检而确诊)。性别、发病年龄、原发与否、肿瘤部位、肿瘤大小、临床症状等临床资料数据(表 1)。
| 表 1 52例硬纤维瘤患者临床资料 Table 1 Clinical data of 52 cases of desmoids tumor |
所有病例经MRI评估均无法在保留肢体功能及完整外观的情况下达到根治切除。我们在评估硬纤维瘤患者是否可以手术时,以硬纤维瘤是良性肿瘤为前提,谨慎权衡根治手术带给患者的获益和造成的损伤,按照安全切缘至少3 cm的标准,制定不可手术切除的标准为:根治手术会造成皮肤、肌肉等软组织的大块缺损,导致肢体外观的巨大改变及功能的丧失或需进行补片修补、皮瓣修复等重大重建手术;根治手术势必累及主要的血管、神经;肿瘤累及骨骼,在保留骨骼的前提下无法达到安全切缘;通过向患者交待病情,患者经过权衡利弊,拒绝尝试手术;截肢手术不予考虑。化疗方案具体为长春瑞滨(NVB)6~10 mg/m2 +小剂量甲氨喋呤(MTX)3~6 mg/(m2·d)5 次/周,预计化疗持续1 年。同时予以粒细胞刺激因子、保肝药等对症支持治疗。不可手术的硬纤维瘤示例见图 1,所示为一30岁女性患者,整个左大腿股后肌群均被肿瘤侵犯。
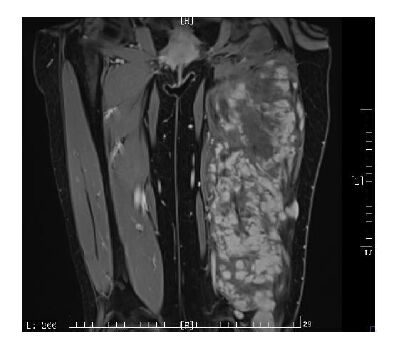
|
图 1 不可手术硬纤维瘤示例 Figure 1 Magnetic resonance image of inoperabledesmoid tumor in a representative case |
通过电话及门诊随访。化疗效果通过MRI或CT进行评估。评估分别于化疗开始前、化疗6月后、化疗结束时、化疗结束后每半年定期进行。肿瘤大小变化以RECIST标准[8]进行评价。随访时间7~64月,平均随访时间33.8月,中位随访时间29月。
1.4 统计学方法处理使用SPSS 16.0软件进行统计学分析,患者一般临床资料采用基本的统计描述分析,对不同组间化疗有效率进行卡方检验,使用Kaplan-Meier 法及Cox回归行生存分析,Log rank 法比较不同组间差异,检验水准a=0.05。
2 结果 2.1 化疗基本情况患者开始化疗时年龄范围4~69 岁。平均22.2岁,中位年龄23 岁。未成年患者24 人,成年患者28人。接受化疗治疗的病人中常见的化疗副反应有恶心、呕吐,肝功能损伤(主要是转氨酶升高),骨髓抑制(主要是白细胞减少)及口腔溃疡等,分别给予止吐、保肝、粒细胞集落刺激因子、亚叶酸钙溶液含漱等对症支持治疗及调整口服甲氨蝶呤剂量后,绝大部分患者化疗副反应均能缓解并继续用药。未出现外周神经毒性的副反应。
化疗持续时间4~30 月。其中10 例患者化疗不满1 年(5 例患者因化疗期间肿瘤进展停药,2 例患者化疗满11 月后因个人原因自行停药,1 例患者因化疗期间出现间质性肺炎及时停药,经对症治疗后症状缓解。1 例患儿因家属担心肝功能问题自行停药,1例患者化疗期间因肿瘤缩小自行于外院手术,术后肿瘤很快复发),10 例患者化疗满1 年后继续间断口服小剂量MTX。中位化疗时间12 月,平均化疗时间12.8 月。28 例患者在化疗进行6 月内出现可观察到的肿瘤缩小或症状改善。
2.2 化疗后效果评价1例CR,18 例PR,27 例SD,6 例PD。总有效率(CR+PR+SD)为88.5%。有19例患者在停药后仍观察到肿瘤持续缩小。使用SPSS 16.0软件对不同组间化疗有效率进行卡方检验,(检验水准a=0.05):未成年组与成人组间化疗总有效率无统计学差异(91.7%∶85.7%,P=0.503)。男女组间化疗总有效率无统计学差异(81.8%∶93.3%,P=0.199)。
截至随访时有10例患者出现PD。其中4例患者肿瘤进展前有再次手术或外伤的诱因。PFS时间为4~63月,平均PFS时间27.6月,中位PFS时间26.5月。使用SPSS 16.0软件Kaplan-Meier法计算生存曲线:2年PFS为0.767,3年PFS为0.691,5年PFS为0.419(图 2)。
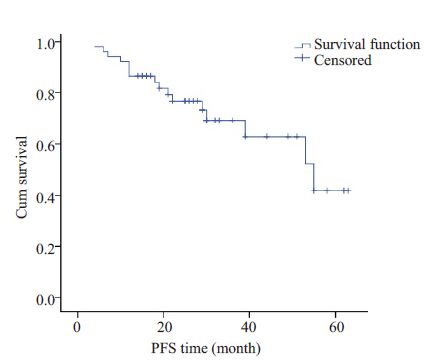
|
图 2 接受化疗的不可手术硬纤维瘤的PFS曲线 Figure 2 Progression-free survival (PFS) of the patients withinoperable desmoid tumor receiving chemotherapy. |
进一步使用SPSS 16.0 软件Kaplan-Meier 法行生存分析,Log rank法比较不同组间差异发现(检验水准a=0.05):男女性别组间PFS无统计学差异(P=0.476);成人与儿童(发病时是否年满18岁)组间PFS无统计学差异(P=0.879);不同部位:躯干(臀部及胸腹壁)、四肢(上肢及下肢)、盆腹腔组间PFS 无统计学差异(P=0.506);不同肿瘤大小(<5 cm、5~10 cm、>10 cm)组间PFS无统计学差异(P=0.373);开始化疗时年龄(开始化疗时小于18岁、开始化疗时已年满18岁)组间PFS无统计学差异(P=0.704);化疗持续时间(化疗不满12月、化疗至少12月)组间PFS有显著统计学差异(P<0.001)。化疗持续时间(化疗不满12 月、化疗至少12 月)组间PFS有显著统计学差异(P<0.001)。进一步使用SPSS16.0软件进行Cox回归分析发现不同化疗持续时间组间有显著统计学差异(P<0.001),说明长期小剂量的化疗可以获得更好的PFS(图 3)。
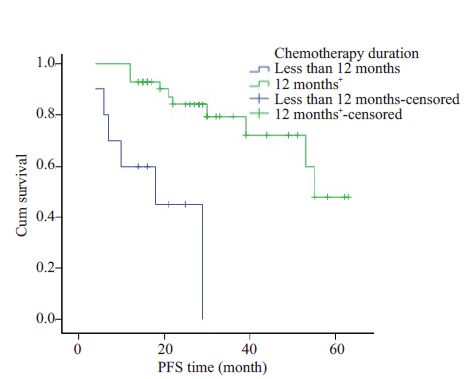
|
图 3 不同化疗持续时间组间PFS对比 Figure 3 Comparison of PFS in patients withdifferent durations of chemotherapy. |
手术切除已经作为硬纤维瘤的首选治疗而被广泛接受,外科治疗的目的是在保留肢体良好的形态和功能的前提下达到阴性切缘。有文献报道切缘阴性者较阳性者复发率低[9-10]。还有文献指出切缘阴性是唯一能降低复发率的独立因素[11]。截肢需要极为少见,只有肿瘤侵犯主要的神经血管、导致肢体功能丧失或严重疼痛才能考虑截肢[12]。
Huang等[13]报道入组214例DT患者的研究,发现单因素分析中,入院情况(入院时是原发还是复发),肿瘤部位,肿瘤大小及切缘是否阴性显著影响EFS。多因素分析中,肿瘤大小,入院情况是独立影响因素。这说明对硬纤维瘤患者初次的正确诊断和治疗十分重要,将影响后续病程及治疗效果。本组病例情况显示,来我科就诊的大部分硬纤维瘤患者为复发病例(47/52),这些患者在外院初次治疗时均误诊为常见良性肿瘤,大部分在局麻下行肿物局部切除术,术前无一例进行过病理穿刺活检。
由于缺少足够的切除边缘,相对于根治性切除,非计划性手术更易造成镜下切缘阳性(R1切除),导致更高的复发风险。复发后的肿瘤,较之初发时常表现出更强的侵袭性,如生长加速,侵犯范围更广等,再次设计根治性手术时,经常会造成大块的组织缺损或主要血管神经的损伤,也因需皮瓣转移等更复杂修复手段而加大手术难度。对于并无转移风险的硬纤维瘤而言,这种过多牺牲正常肢体形态与功能的激进治疗方式,经常难以为患者所接受,这也是本组52例成为不可切除硬纤维瘤的原因。近来Woltsche等[14]及Soto-Miranda等[15]的研究均发现,切缘是否阴性并不影响手术治疗的局部控制情况。这似乎提示硬纤维瘤具有不同寻常的生物学行为,对根治性切除手术的有效性也提出了进一步的质疑,同时再次突出了化疗等辅助治疗手段的必要性。
3.2 放疗放疗对儿童及年轻患者会造成如肢体挛缩、生长障碍、病理性骨折、放射后肉瘤等迟发的并发症[16]。而且发现放疗对硬纤维瘤的局部控制率在不同年龄存在差异[17]。因此,对于年轻或未成年的硬纤维瘤患者,不适合选择放疗。硬纤维瘤的ER、PR、Ki-67、c-kit、PDGFR、β联蛋白,生长抑素等免疫组化指标在儿童、青少年及成人患者上表现有所不同[14]。这提示了硬纤维瘤在不同年龄阶段可能存在的组织学差异及不同的生物学特性。这可能也是不同年龄硬纤维瘤患者接受放疗后疗效存在差异的原因。本组病例平均发病年龄18.7岁,中位发病年龄18岁,故未选择放疗。而最近Shin等[7]的一项研究对术后辅助放疗的意义也提出了质疑,该研究入组119例接受手术的DT患者,平均随访82月,5年及10年无复发生存率75%和72%。平均复发时间间隔是30月。研究发现辅助放疗可以推迟肿瘤的复发,但是似乎对总复发率没有影响。
3.3 传统药物治疗对于巨大硬纤维瘤位于肢体的年轻患者,系统性治疗是合适的选择[18]。美国国立综合癌症网络(NCCN)推荐多种治疗药物[19]。Skapek等[20]认为他莫昔芬及舒林酸应用于硬纤维瘤患者虽然毒副反应小,但效果不佳。Garbay等[21]报道62例复发及/或不可手术切除DT患者接受化疗。在所有化疗病人中,13例(21%)患者接受蒽环类药物为基础的化疗。27 例患者接受甲氨蝶呤(MTX)联合长春碱(VLB)化疗;7例患者接受甲氨蝶呤化疗,6例患者接受长春瑞滨化疗。研究发现蒽环类药物为基础的化疗反应率较单药化疗更高(54%∶12%),但是化疗副反应也更大。位于肢体以外部位的硬纤维瘤PFS较好(P=0.03)
Azzarelli等[22]首先报道了使用小剂量甲氨喋呤和长春碱化疗治疗不能手术硬纤维瘤患者的有效性。之后有学者报道约10%使用长春碱化疗的DT患者出现外周神经病变的副反应;而长春瑞滨神经毒性更小,但疗效和长春碱相当[23]。与Garbay等[21]的研究相比,本研究的化疗有效率较高。究其原因,考虑可能是本组研究化疗持续时间较长所致。本研究发现经过化疗肿瘤PR的患者其肿瘤缩小多在化疗开始6月后出现。本组研究也证实了化疗持续时间较长的患者PFS较好。此方案的优点在于急性及长期的副反应较小,便于在日间化疗门诊进行,化疗药及相关化疗辅助用药相对便宜,因而患者依从性较好。硬纤维瘤的化疗周期目前尚无共识,文献报道化疗周期6~18月不等,有学者建议化疗应持续至少一年,除非出现严重的化疗副反应或疾病进展[24]。而根据我们的经验及随访结果,我们建议化疗应持续至少12月,并可根据患者情况(化疗效果及化疗副反应等)延长至18月。本组病例平均随访33.8月,总有效率88.5%,与其余系统性治疗方案相比,本组病例有较好的治疗效果。
硬纤维瘤是一种少见的良性肿瘤,中国很多非肿瘤专科医院的医生对该病缺乏经验及重视,导致很多患者首诊时被误诊误治并最终造成肿瘤不可切除的治疗难题。虽然硬纤维瘤特异性表现不足,我们仍建议由影像学检查入手进行鉴别诊断。张忠林等[25]提示若肿物在CT及MRI表现为良性病变,但呈恶性病变生长特征,需警惕硬纤维瘤可能,并进一步行粗针穿刺活检明确病理诊断。本组研究报道了目前国内外最大宗的单一化疗方案治疗不可手术切除硬纤维瘤的回顾性研究。根据国外肉瘤中心治疗现状及我们的经验[26],我们认为足够疗程的长春瑞滨联合小剂量甲氨蝶呤的化疗,在肿瘤反复复发、不可切除且肿瘤持续进展的情况下,是一种安全的治疗方法。
| [1] | William M. Mendenhall, Robert A. Zlotecki, Christopher G. Morris, et al. Aggressive Fibromatosis[J]. Am J Clin Oncol,2005, 28 (6) : 211-5. |
| [2] | Gronchi A, Casali PG, Mariani L, et al. Quality of surgery and outcome in extra-abdominal aggressive fibromatosis: A series of patients surgically treated at a single institution[J]. J Clin Oncol,2003, 21 (7) : 1390-7. DOI: 10.1200/JCO.2003.05.150. |
| [3] | Lazar AJ, Hajibashi S, Lev D. Desmoid tumor: from surgical extirpation to molecular dissection[J]. Curr Opin Oncol,2009, 21 (4) : 352-9. DOI: 10.1097/CCO.0b013e32832c9502. |
| [4] | 林庆衍, 白冬雨. 侵袭性纤维瘤病恶变为纤维肉瘤1例[J]. 临床肿瘤 学杂志,2007, 6 (6) : 478-9. |
| [5] | Collins BJ, Fischer AC, Tufaro AP. Desmoid tumors of the head and neck: a review[J]. Ann Plast Surg,2005, 54 (1) : 103-8. DOI: 10.1097/01.sap.0000141373.02054.ca. |
| [6] | Peng PD, Hyder O, Mavros MN, et al. Management and recurrence patterns of desmoids tumors: a multi-institutional analysis of 211 patients[J]. Ann Surg Oncol,2012, 19 (13) : 4036-42. DOI: 10.1245/s10434-012-2634-6. |
| [7] | Shin SH, Ko KR, Cho SK, et al. Surgical outcome of desmoid tumors: adjuvant radiotherapy delayed the recurrence, but did not affect long-term outcomes[J]. J Surg Oncol,2013, 108 (1) : 28-33. DOI: 10.1002/jso.23343. |
| [8] | Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1[J]. Eur J Cancer,2009, 45 (2) : 228-47. DOI: 10.1016/j.ejca.2008.10.026. |
| [9] | Nuyttens JJ, Rust PF, Thomas CJ, et al. Surgery versus radiation therapy for patients with aggressive fibromatosis or desmoid tumors: a comparative review of 22 articles[J]. Cancer,2000, 88 (7) : 1517-23. DOI: 10.1002/(ISSN)1097-0142. |
| [10] | Zeng WG, Zhou ZX, Liang JW, et al. Prognostic factors for desmoid tumor: a surgical series of 233 patients at a single institution[J]. Tumor Biol,2014, 35 (8) : 7513-21. DOI: 10.1007/s13277-014-2002-1. |
| [11] | Pignatti G, Barbanti-Bròdano G, Ferrari D, et al. Extraabdominal desmoid tumor: a study of 83 cases[J]. Clin Orthop Relat Res,2000, 6 (375) : 207-13. |
| [12] | Lewis JJ, Boland PJ, Leung DH, et al. The enigma of desmoid tumors[J]. Ann Surg,1999, 229 (6) : 866-72. DOI: 10.1097/00000658-199906000-00014. |
| [13] | Huang K, Wang CM, Chen JG, et al. Prognostic factors influencing event-free survival and treatments in desmoid-type fibromatosis: analysis from a large institution[J]. Am J Surg,2014, 207 (6) : 847-54. DOI: 10.1016/j.amjsurg.2013.08.007. |
| [14] | Woltsche N, Gilg MM, Fraissler LA, et al. Is wide resection obsolete for desmoid tumors in children and adolescents? evaluation of histological margins, immunohistochemical markers, and review of literature[J]. Pediatr Hematol Oncol,2015, 32 (1) : 60-9. DOI: 10.3109/08880018.2014.956905. |
| [15] | Soto-Miranda M, Sandoval JA, Rao B, et al. Surgical treatment of pediatric desmoid tumors. A 12-year, single-center experience[J]. Ann Surg Oncol,2013, 20 (11) : 3384-90. DOI: 10.1245/s10434-013-3090-7. |
| [16] | Kriz J, Eich HT, Haverkamp U, et al. Radiotherapy is effective for desmoid tumors(aggressive fibromatosis)-long-term results of a German multicenter study[J]. Oncol Res Treat,2014, 37 (5) : 255-60. |
| [17] | Rutenberg MS, Indelicato DJ, Knapik JA, et al. External-beam Radiotherapy for Pediatric and Young Adult Desmoid Tumors[J]. Int J Radiat Oncol Biol Phys,2009, 75 (3) : S41-2. |
| [18] | Crago AM, Denton B, Salas S, et al. A prognostic nomogram for prediction of recurrence in desmoid fibromatosis[J]. Ann Surg,2013, 258 (2) : 347-53. DOI: 10.1097/SLA.0b013e31828c8a30. |
| [19] | von Mehren M1, Randall RL, Benjamin RS, et al. Soft tissue sarcoma, version 2.2014[J]. J Natl Compr Canc Netw,2014, 12 (4) : 473-83. |
| [20] | Skapek SX, Anderson JR, Hill DA, et al. Safety and efficacy of high-dose tamoxifen and sulindac for desmoid tumor in children: Results of a Children's Oncology Group (COG) Phase II Study[J]. Pediatr Blood Cancer,2013, 60 (7) : 1108-12. DOI: 10.1002/pbc.24457. |
| [21] | Garbay D, Le Cesne A, Penel N, et al. Chemotherapy in patients with desmoid tumors: a study from the French Sarcoma Group (FSG)[J]. Annals of Oncology,2012, 23 (1) : 182-U517. DOI: 10.1093/annonc/mdr051. |
| [22] | Azzarelli A, Gronchi A, Bertulli R, et al. Low dose chemotherapy with methotrexate and vinblastine for patients with advanced aggressive fibromatosis[J]. Cancer,2001, 92 (5) : 1259-64. DOI: 10.1002/(ISSN)1097-0142. |
| [23] | Weiss AJ, Horowitz S, Lackmen RD. Therapy of desmoid tumors and fibromatosis using vinorelbine[J]. Am J Clin Oncol,1999, 22 (2) : 193-5. DOI: 10.1097/00000421-199904000-00020. |
| [24] | Janinis J, Patriki M, Vini L, et al. The pharmacological treatment of aggressive fibromatosis: a systematic review[J]. Ann Onco,2003, 14 (2) : 181-90. DOI: 10.1093/annonc/mdg064. |
| [25] | 张忠林, 梁长虹, 刘于宝, 等. 韧带样型纤维瘤病CT、MRI表现与病理 对照分析[J]. 南方医科大学学报,2010, 30 (11) : 2495-7. |
| [26] | 李舒, 方志伟. 硬纤维瘤治疗研究进展[J]. 中华肿瘤防治杂志,2010, 17 (17) : 1391-5. |
 2016, Vol. 36
2016, Vol. 36
